新疆野核桃SRAP—PCR反应体系的优化及引物筛选
2016-05-03张捷李勤霞张萍余甜
张捷+李勤霞+张萍+余甜
摘要: 利用正交设计对新疆野核桃序列相关扩增多态性PCR(SRAP-PCR)反应体系中的5个因素(模板DNA、Mg2+、引物、dNTPs、TaqDNA聚合酶浓度)在5水平上进行优化,对比不同浓度模板DNA对扩增结果的影响,建立了新疆野核桃SRAP最佳反应体系。结果表明,优化的新疆野核桃SRAP-PCR最佳反应体系为:20 μL的反应体系中,2.5 μg/mL模板DNA、0.4 μmol/L引物、2 mmol/L Mg2+、0.2 mmol/L dNTPs、25 U/mL Taq酶U;最佳PCR扩增程序的退火温度为54 ℃。各因素扩增结果表明,Mg2+浓度对扩增反应结果影响最大,dNTPs浓度影响最小。运用该体系对新疆野核桃样本进行了验证,表明该体系扩增稳定可靠。用该体系对100个SRAP引物组合进行筛选,筛选出15个扩增条带清晰且多态性丰富的引物组合,为新疆野核桃种质资源研究奠定了基础。
关键词: SRAP分子标记;新疆野核桃;正交试验;引物筛选;体系优化
中图分类号: S664.103 文献标志码: A
文章编号:1002-1302(2016)03-0064-03
新疆野核桃(Juglans regia L.)是胡桃科胡桃属植物,也是栽培核桃(Uuglms regia L.)的野生种之一[1],在我国仅分布于新疆伊犁巩留县(后称野核桃沟自然保护区)内,是我国珍贵的天然野生资源[2-4]。
国内目前对于新疆野核桃领域的研究薄弱,而分子标记技术已经在核桃的遗传多样性分析[5-13]、分子标记辅助育种[14]、特异性基因标记[15-16]和遗传图谱的构建[17]等方面普遍应用,但其饱和程度不高,不能满足科研工作发展的需要。本研究利用正交设计试验对新疆野核桃序列相关扩增多态性PCR(SRAP-PCR)反应体系进行了优化[18-20],考察SRAP-PCR反应体系中各因素的相互影响[21],得到最佳优化组合。与单因素试验相比,不但可以快速获得试验结果,而且减少了试验的成本和工作量。并对100对SRAP引物进行了多态性标记筛选,得到一些多态性较高的SRAP引物组合[22-24],为进一步研究新疆野核桃种质资源遗传多样性打下了一定的基础。
1 材料与方法
1.1 供试材料
1.1.1 材料 试验材料为从新疆伊犁巩留县野核桃沟内采集的野核桃叶片。
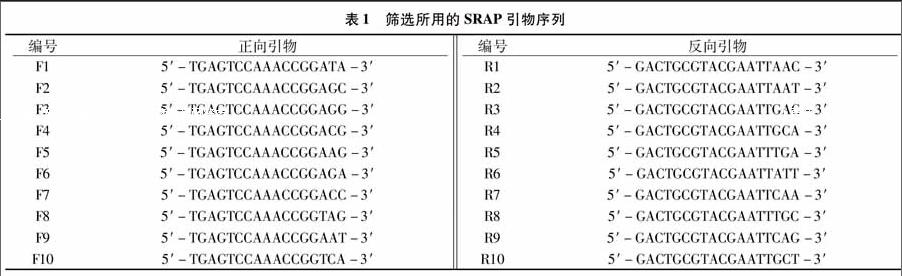
1.1.2 试剂 根据Li等已发表的SRAP引物[25]设计10条正向引物、10条反向引物序列(表1),由深圳华大基因科技服务有限公司合成;10×Taq Buffer(含Mg2+)、Taq DNA聚合酶、dNTPs、DNA Ladder(100 bp)、10×Loading buffer均购于北京全式金生物公司。
1.2 试验方法
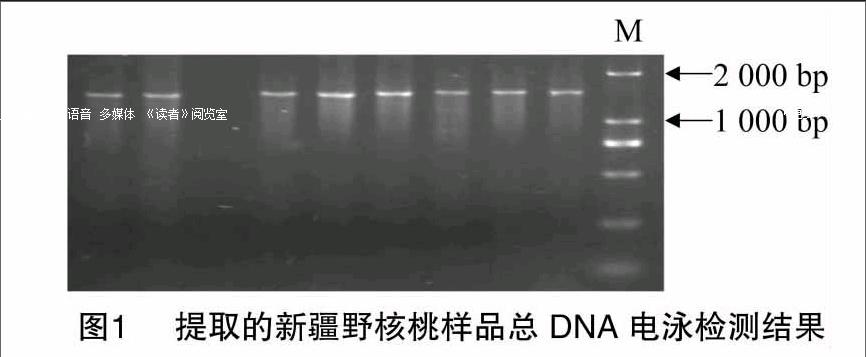
1.2.1 基因组DNA的提取及检测 以新疆野核桃的幼嫩叶片为材料,利用改良高盐低pH值法提取基因组DNA[20],干燥后加入1× TE溶解沉淀,检验质量后于-20 ℃条件下长期保存。试验所提取的DNA沉淀为白色,经风干后呈透明黏状。在0.8%的琼脂糖凝胶中,于100 V电压下电泳1 h,经0.5 μg/mL EB染色,然后在凝胶成像系统下拍照检测DNA质量。
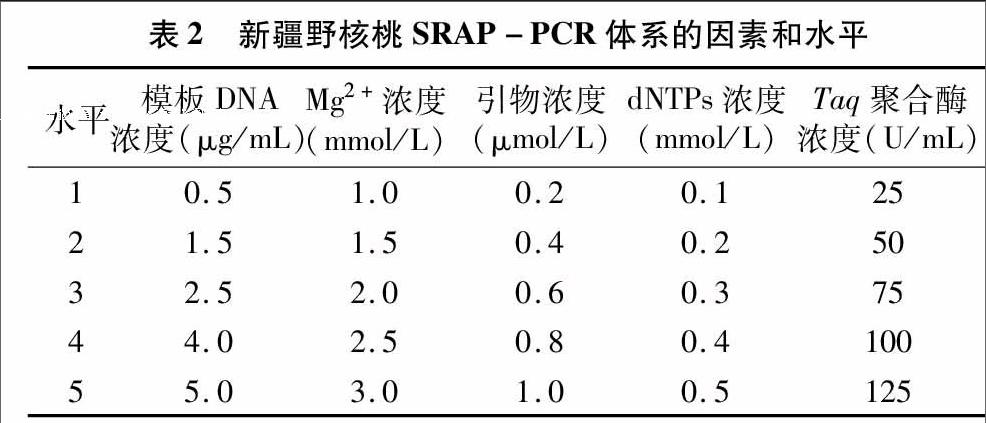
1.2.2 PCR反应体系优化的正交试验设计 利用L25(55)正交设计试验[21],对模板DNA、引物、Mg2+、dNTPs和Taq聚合酶浓度进行5因素5水平筛选试验(表2)。
1.2.3 SRAP-PCR扩增程序及扩增产物的检测 制备总体积为20 μL的PCR 反应体系,除变化因素外,其余的用ddH2O补足,所用的引物组合为F2+R3,引物序列见表1。SRAP-PCR的扩增程序为:94 ℃预变性4 min;94 ℃变性 1 min,35 ℃复性1 min,72 ℃延伸2 min,5个循环;94 ℃变性1 min,54 ℃复性1 min,72 ℃延伸2 min,35个循环;72 ℃延伸8 min,4 ℃保存。扩增反应在Thermal Cycler S1000型PCR仪上进行,扩增产物用8%非变性聚丙烯酰胺凝胶电泳分离(电泳仪电源为 DYY-10C型,电泳仪为DYCZ-20C型),快速银染法显色,清水清洗,裹上保鲜膜,最后在胶片观察灯上观察并拍照保存。
1.2.4 多态性SRAP引物组合的筛选 根据表2设计的正交优化试验方案确定新疆野核桃SRAP-PCR的最佳反应体系,用10条正向引物和10条反向引物组成的100对引物组合对48份不同区域的新疆野核桃材料进行多态性SRAP引物组合的筛选。
2 结果与分析
2.1 基因组DNA的提取
利用改良高盐低pH值法所提取的新疆野核桃基因组DNA,经0.8%的琼脂糖凝胶电泳检测,结果显示DNA条带清晰,无拖尾现象,表明DNA完整(图1)。通过UV2000紫外分光光度计对DNA浓度进行检测,测得D260 nm/D280 nm的比值在1.8~2.0之间。由此可知,经上述方法提取的新疆野核桃DNA的质量较高,能够满足SRAP反应对DNA的要求。
2.2 正交设计优化SRAP-PCR的结果分析
依据“1.2.2”节中设定的正交试验,进行PCR扩增反应和聚丙烯酰胺凝胶电泳,根据电泳结果(图2),统计扩增条带数量,将结果输入SPSS 19.0软件进行方差分析(表3)。
从电泳结果可以看出,第6、10、15泳道电泳条带多且清晰,都可作为新疆野核桃正交试验组合,但从经济性考虑,最后选择第15个组合为新疆野核桃SRAP-PCR最佳反应组合。
从方差分析中能够看出,5种PCR因子的F值大小依次为:Mg2+浓度>引物浓度>Taq酶浓度>模板DNA浓度>dNTPs浓度,这表明Mg2+浓度对新疆野核桃SRAP-PCR的反应体系有最大的影响。
依据上述试验结果,确定新疆野核桃SRAP-PCR的最优反应体系为:2.5 μg/mL模版DNA、2 mmol/L Mg2+、0.4 μmol/L 引物、0.2 mmol/L dNTPs、25 U/mL Taq酶,剩余体积用去离子水补齐至20 μL;最佳PCR扩增程序的退火温度为 54 ℃,相应SRAP-PCR扩增程序为:94 ℃ 4 min;94 ℃ 45 s,35 ℃ 45 s,72 ℃ 1 min,5个循环;94 ℃ 45 s,54 ℃ 45 s,72 ℃ 1 min,35个循环;72 ℃ 8 min,4 ℃保存。
2.3 SRAP-PCR反应体系的验证
从不同引物组合中随机选取引物分别对48个样品DNA进行扩增验证(图3)。结果表明该反应体系能得到较好的结果,且在不同的引物组合之间和不同的DNA样品之间带型有明显差异,扩增出的谱带较清晰且多态性较丰富。
2.4 SRAP-PCR多态性引物组合的筛选
应用“2.2”节建立的新疆野核桃SRAP-PCR的反应体系,用由10个上游引物、10个下游引物组成的100对 SRAP-PCR的引物组合对48份新疆野核桃样品进行SRAP扩增,每个扩增试验都重复3次,并选取条带清晰且重复性较好的结果进行分析。最后筛选出15对条带清晰,多态性好的引物组合:F1/R2、F1/R5、F1/R7、F2/R2、 F2/R3、F2/R4、F3/R2、F3/R3、F3/R4、F5/R1、F5/R2、F5/R5、F6/R8、F6/R9、F6/R10。其中F3/R2扩增结果见图4。
3 结论与讨论
SRAP作为一种新型的分子标记技术,不但具有多态性高、扩增稳定、引物通用和产量中等的特点,而且重复性较好,操作简易。然而,SRAP分子标记的扩增结果容易受PCR反应条件(比如DNA、dNTPs、Mg2+浓度、引物和Taq聚合酶用量等)和基因组的影响,并且不同的植物对SRAP-PCR反应体系的要求也各不相同[21]。所以,对反应体系进行优化是进行SRAP分析的前提条件。
试验结果表明:Mg2+浓度对SRAP-PCR反应体系的结果影响最大,而模板浓度和退火温度的变化对SRAP-PCR反应体系影响相对较为轻微。本试验建立了适合新疆野核桃的SRAP-PCR优化体系,模版DNA浓度为2.5 μg/mL、Mg2+浓度为2.0 mmol/L、引物浓度为0.4 μmol/L、dNTPs浓度为 0.2 mmol/L、Taq酶浓度为25 U/mL,剩余体积用去离子水补齐至 20 μL。利用该体系筛选出15对扩增产物条带清晰并且多态性较丰富的引物组合。新疆野核桃SRAP-PCR优化体系的建立和引物组合的筛选为野核桃种质资源的遗传多样性分析研究奠定了良好的基础。
利用本研究的反应体系,能扩增出条带清晰、多态性丰富的谱带,且重复性好、稳定性强,这为今后新疆野核桃在SRAP这种新型分子标记方面的研究提供了依据,也为新疆野核桃通过SRAP分子标记技术在种质资源遗传多样性和野核桃遗传图谱的构建方面提奠定了基础。
参考文献:
[1]张 钊,严兆福. 新疆野生核桃的调查研究[J]. 新疆农业科学,1962(10):404-407.
[2]张新时. 伊犁野果林的生态地理特征和群落学问题[J]. 植物学报,1973,15(2):239-253.
[3]王家友. 伊犁野生核桃林的初步调查[J]. 新疆林业,1980(6):27-31.
[4]新疆维吾尔自治区自然保护区考察队.新疆的野核桃林[J]. 林业科技通讯,1982(10):15-18.
[5]金 强,杨 宇,王新建,等. 新疆核桃种质资源遗传多样性AFLP分析[J]. 江苏农业科学,2009(2):28-31.
[6]王 磊. 新疆野核桃、野樱桃李和野扁桃[J]. 新疆农业科学,1990,27(1):33-34.
[7]王 磊,李 霞,杨 辽,等. 新疆野核桃种质资源数量分类研究[J]. 北方园艺,1998(1):5-7.
[8]王 磊,崔乃然,张汉斐. 新疆野核桃的研究[J]. 干旱区研究,1997,14(1):17-27.
[9]徐德炎. 新疆野核桃生态气候特征的研究[J]. 生态学杂志,1989,8(4):24-27.
[10]徐德炎,朱晓专. 新疆野核桃生存繁衍的生态条件研究[J]. 中国林副特产,1991(4):1-6.
[11]佘定域. 巩留野核桃林土壤的形成及其特征特性[J]. 干旱区研究,1994,11(2):11-15.
[12]刘立诚,排祖拉,徐华君. 伊犁谷地野核桃林下土壤的形成特点及其系统分类[J]. 新疆大学学报:自然科学版,1998,15(2):60-65.
[13]王肇延. 新疆野核桃资源及遗传多样性的分析[D]. 乌鲁木齐:新疆农业大学,2011:22-27.
[14]曾 斌. 新疆野生核桃资源的现状与发展[J]. 北方果树,2005(4):1-3.
[15]张 维,赵 玉,张相锋,等. 新疆伊犁野核桃复叶的表型变异及生长规律[J]. 东北师大学报:自然科学版,2011,43(1):113-117.
[16]刘晓丽,陈学森,张美勇,等. 普通核桃(Juglans regia)3个群体遗传结构的SSR分析[J]. 果树学报,2008,25(4):526-530.
[17]司 鹏. 苹果分子遗传图谱构建及其部分性状SRAP分析[D]. 北京:中国农业科学院,2010.
[18]杨向晖,黄建峰,傅嘉欣,等. 黄皮SRAP反应体系优化正交实验研究[J]. 亚热带植物科学,2009,38(4):27-30.
[19]王 燕;龚义勤;赵统敏. 番茄SRAP-PCR体系优化与品种分子鉴定[J]. 南京农业大学报,2007,30(1):23-29.
[20]王肇延,董玉芝,陈 虹,等. 适用于新疆野核桃SSR-PCR的快速提取DNA的方法[J]. 北方园艺,2011(19):100-103.
[21]郑轶琦,王志勇,郭海林,等. 正交设计优化假俭草SRAP-PCR反应体系及引物筛选[J]. 草业学报,2008,17(4):110-117.
[22]张安世,邢智峰,刘永英,等. SRAP分子标记及其应用[J]. 安徽农业科学,2007,35(9):2562-2563.
[23]李巧燕,林瑞庆,朱兴全. SRAP分子标记及其应用概述[J]. 热带医学杂志,2006,6(4):467-469,封四.
[24]李 超,罗淑萍,秦 伟,等. 新疆核桃亲缘关系的ISSR分析[J]. 新疆农业科学,2010,47(9):1722-1727.
[25]Li G,Quiros C F. Sequence-related amplified polymorphism (SRAP),a new marker system based on a simple PCR reaction:its application to mapping and gene tagging in Brassica[J]. Theoretical and Applied Genetics,2001,103(2/3):455-461.
