水稻无选择标记Xa21转基因系CX8621的获得与遗传分析
2016-04-28夏志辉刘鹏程高利芬刘栋峰姜丽江光怀郭乐群翟文学
夏志辉 刘鹏程 高利芬 刘栋峰 姜丽 江光怀 郭乐群 翟文学,*
(1中国科学院 遗传与发育生物学研究所,北京 100101;2海南省热带生物资源可持续利用重点实验室/海南大学 农学院,海口570228; #共同第一作者;*通讯联系人,E-mail: wxzhai@genetics.ac.cn)
水稻无选择标记Xa21转基因系CX8621的获得与遗传分析
夏志辉1,2,#刘鹏程1,#高利芬1刘栋峰1姜丽1江光怀1郭乐群1翟文学1,*
(1中国科学院 遗传与发育生物学研究所,北京 100101;2海南省热带生物资源可持续利用重点实验室/海南大学 农学院,海口570228;#共同第一作者;*通讯联系人,E-mail: wxzhai@genetics.ac.cn)
夏志辉, 刘鹏程, 高利芬, 等. 水稻无选择标记Xa21转基因系CX8621的获得与遗传分析. 中国水稻科学, 2016, 30(1): 10-16.
摘要:无选择标记和转基因稳定遗传是转基因作物安全应用的基本要求。按照我国转基因作物安全评价指南,利用双右边界T-DNA载体系统将广谱抗白叶枯病基因Xa21转入水稻恢复系明恢86。通过抗性鉴定、PCR分析和Southern杂交,跟踪了外源Xa21基因在转基因后代植株的遗传,并在T3代获得了无选择标记和载体骨架序列的单拷贝抗病纯合系CX8621。多年的观察和鉴定表明转基因恢复系CX8621具有稳定的白叶枯病抗性。目前CX8621已经稳定遗传至T(16),并已通过小规模的田间试验(环境释放)和大规模的田间试验(生产性试验)的安全评价。
关键词:转基因水稻; 白叶枯病; Xa21; 无选择标记; 稳定遗传
水稻是世界上最重要的粮食作物,为全球一半以上的人口提供食物[1];它作为我国第一大粮食作物,更是占我国粮食总产量的40%[2]。伴随着转基因技术的快速发展,兼之水稻的重要战略地位,我国在转基因水稻的研发和培育方面取得了巨大进展[3]。目前已经培育出抗虫[4-5]、抗病[6]、抗除草剂[7]以及具有优良品质[8-9]的转基因水稻,其中转基因抗虫水稻“华恢1号”和“Bt汕优63”于2009年获得生产应用安全证书[10]。此外,还有多项转基因水稻获准进行生产性试验[11]。我国转基因作物的安全评价依据是《农业转基因生物安全评价管理办法》;评价过程包括试验研究、中间试验、环境释放、生产性试验及最后的生产应用安全证书[12]。外源基因在转基因作物的整合情况鉴定及遗传稳定性分析结果是转基因安全评价的必备技术资料[13]。迄今为止,严格按照转基因安全评价的要求,对外源基因遗传稳定性多代分析的研究资料报道甚少。本研究重点阐述转Xa21基因抗白叶枯病恢复CX8621的获得流程、稳定整合与遗传、抗病能力及其分子鉴定,以期为其他开展转基因作物工作的同仁提供参考。
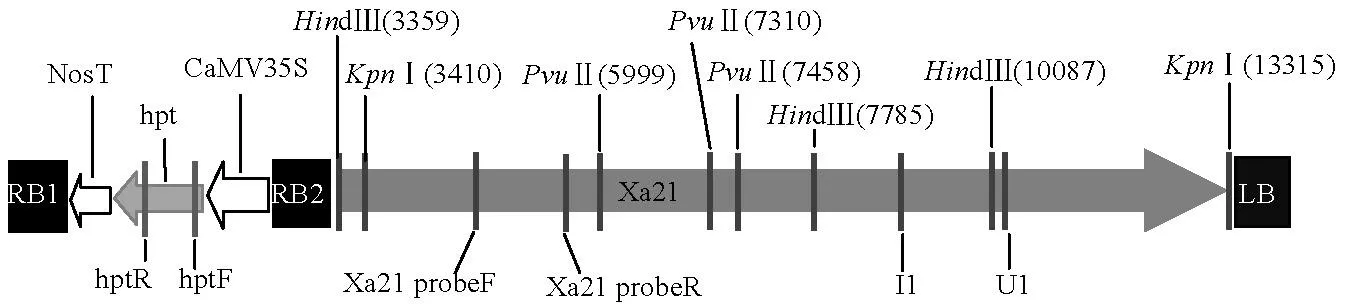
图1 简化的pBXa21线性结构与酶切图谱
Fig. 1. Simplified linear structure and enzyme pattern of pBXa21.
1材料与方法
1.1实验材料
受体材料明恢86为杂交水稻育种中广泛应用的籼稻恢复系。抗性鉴定所用到的供试菌株为来源于菲律宾的白叶枯病鉴别小种,包括PXO61(P1)、PXO86(P2)、PXO79(P3)、PXO71(P4)、PXO99(P6)、PXO145(P7)、PXO280(P8)、PXO339(P9)、PXO124(P10),由中国农业科学院作物科学研究所提供,本实验室保存。
1.2转基因载体与转化
在前期工作中,我们已将广谱显性抗白叶枯病基因Xa21构建到能去除标记基因的双右边界双元载体pBXa21上,并利用该载体成功获得了无标记的转Xa21基因水稻(图1)[6,14-15]。pBXa21的细菌选择标记为壮观霉素抗性基因(spectinomycinresistantgene,specR),转化选择标记为潮霉素B磷酸转移酶基因(hygromycinBphosphotransferasegene,hpt)。籼稻明恢86转化方法参照文献[6]和[16]。
1.3转基因植株的种植管理
转基因植株的种植管理,严格按照《农业转基因生物安全评价管理办法》、《转基因植物安全评价指南》与《农业转基因生物安全管理条例》的要求进行,在温室转基因作物种植区和设有隔离带的田间种植。2004年获得转基因T0植株,以后每年在北京或海南种植转基因后代植株,先后进行了中间试验、环境释放和生产性试验各阶段的安全评估。目前已繁殖至 T16代。
1.4转基因植株的抗性鉴定
转基因水稻对白叶枯病的抗性鉴定参照国家标准《转基因植物及其产品环境安全检测——抗病水稻》第一部分对靶标病害的抗性(农业部953号公告-9.1-2007)进行。
1.5目的基因在植物基因组中的整合及遗传分析
根据农业部《转基因植物安全评价指南》对申请转化体安全证书的要求,对不同世代的转基因株系进行了PCR鉴定和Southern杂交分析,以明确外源基因的整合情况和遗传稳定性。
在进行PCR鉴定时,目的基因Xa21的检测使用的是UI/I1引物对,由王国梁等根据Xa21基因激酶区序列设计[17],在转基因植株中能扩增出1377 bp和1248 bp两条带,而在非转基因对照中只能扩出1248 bp一条条带。鉴定标记基因hpt使用的引物为hpt-F/R,在转基因植株中扩增产物为1035 bp,对照和非转基因植株中无扩增。左边界引物为LB-F/R,在转基因植株中产物为339 bp,对照和非转基因植株中无扩增。具体序列参考夏志辉等无选择标记和载体骨干序列的Xa21转基因水稻的获得[6]。
在Southern 杂交分析时,用限制性内切酶(T0代和T1代分析用的PvuⅡ、T11代分析用KpnⅠ、PvuⅡ、HindⅢ)37℃酶切过夜;0.8%的琼脂糖凝胶电泳,转移到尼龙膜上用于分子杂交。分子杂交使用的是北京美莱博生物技术有限公司的Hyb高效杂交液,Xa21杂交探针使用的是引物Xa21-PF/PR扩增的片段,标记基因hpt以及左边界LB分析所用的探针与PCR鉴定时扩增的产物相同。探针具体位置与酶切图谱见图1。

A-hpt基因的PCR分析; B-Xa21基因的PCR分析。pMNDRBBin6-不含Xa21的空载体; pBXa21-以pMNDRBBin6为骨架构建的含Xa21的载体; MH86-非转基因对照明恢86。
A, PCR analysis ofhpt; B,PCR analysis ofXa21. pMNDRBBin6,Vector withoutXa21;pBXa21,Vector withXa21;MH86,Non-transgenic control Minghui 86.
图2T0阳性植株PCR分析结果
Fig. 2. PCR analysis of transgenic positive T0plants.

A-Xa21基因的Southern 杂交; B-hpt基因的Southern杂交。
A, Southern blot analysis ofXa21; B, Southern blot analysis ofhpt.
图3T0代部分转基因株系的Southern杂交分析
Fig. 3. Southern blot hybridization analysis of T0plants.
2结果与分析
2.1转基因植株T0代中外源插入片段的整合分析
用构建的pBXa21载体转化明恢86,T0代共获得转基因株系94个。对既能够扩增出潮霉素基因特异的1035 bp,也能够扩增出Xa21基因特异的1377 bp条带的T0代转基因植株(图2)进行田间接种P6鉴定,得到阳性株系49个。根据pBXa21载体的结构和T-DNA整合原理[6,15],阳性植株中可筛选到不同的整合类型(图3)。在Southern分析中显示出的不同带型,不仅能区分插入片段是单拷贝还是多拷贝,还可分辨出Xa21与hpt的串联整合与分离整合。在Southern杂交中,Xa21基因有比hpt基因多出的条带,则表明Xa21基因与hpt基因是分离整合;在此类型的分离后代中即可筛选出无选择标记的Xa21转基因植株,如T0代植株CX86 34-3。

A-Xa21的PCR检测; B-左边界侧翼序列的PCR检测; C-hpt基因的PCR检测。
A, PCR analysis ofXa21; B, PCR analysis of left border; C, PCR analysis ofhpt.
图4CX86 34-3株系T1代PCR分子鉴定
Fig. 4. PCR analysis of transgenic T1plants of CX86 34-3.
2.2转基因植株T1代中外源插入片段的遗传分析
T1代植株分蘖盛期对各株系单株接种P6菌株进行抗病性鉴定,大多数转基因植株在T1代表现出抗感分离。对接种鉴定后的抗病植株,分别进行Xa21基因、潮霉素hpt基因以及载体左边界侧翼骨架序列的PCR 鉴定(由于潮霉素基因位于右边界,所以不再对更右侧的载体骨架序列进行单独检测),从中筛选不含选择标记和载体左边界侧翼骨架序列而只含有Xa21基因的抗病转基因植株。在此,我们以CX86 34-3 T1代转基因单株为例,展示其整合及遗传规律。PCR鉴定结果显示(图4),在其抗病转基因分离后代中能筛选出标记基因(hpt)和载体左边界侧翼骨架序列检测均为阴性,而Xa21基因为阳性的单株。
接着对CX86 34-3 的T1代转基因单株进行Southern杂交分析,图5显示了部分单株的分析结果。结果表明Xa21与hpt以及不同拷贝之间发生分离。不同的转基因单株中Xa21有单拷贝、双拷贝和三拷贝,有hpt和无hpt。如CX86 34-3-3植株为单拷贝无选择标记而只含有Xa21基因单株。同时利用左边界LB序列作探针的分子杂交可以显示转基因植株有无左边界载体骨架序列(数据未列出)。多拷贝的转基因植株后代可以继续分离,在分离后代中获得单拷贝的转基因植株。对各植株套袋自交繁殖T2代和T3代,进一步筛选和验证,在T3代获得了无选择标记和载体骨架序列的单拷贝Xa21转基因纯合系。纯合系植株生长整齐一致,所有植株都表现对P6 的高度抗性,没有抗感分离。将无选择标记的单拷贝Xa21转基因纯合系命名为CX8621,进行后续的研究。
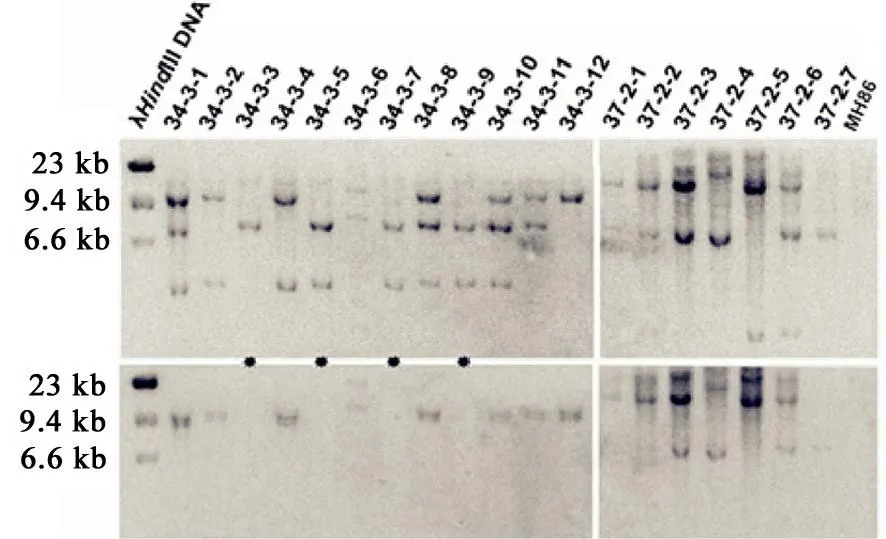
A-Xa21基因Southern杂交分析;B-hpt基因Southern杂交分析。无选择标记Xa21阳性植株用星号(*)标出。
A, Southern blot analysis ofXa21; B,Southern blot analysis ofhpt. Selectable marker-free transgenic plants are makered as *.
图5T1株系 CX86 34-3 Southern杂交分析
Fig. 5. Southern blot hybridization analysis of T1plants CX86 34-3.
2.3转基因系CX8621的稳定遗传与精细杂交指纹图谱
由于转基因作物在申请安全证书时,不仅要明确外源片段(如转化载体骨架、目的基因和标记基因等)整合拷贝数,还需要具有转化事件特异性的分子杂交图谱。因此,我们对转基因系CX8621的T11代植株提取基因组DNA,参考pBXa21线性图谱(图1),用3种限制性内切酶PvuⅡ 、HindⅢ和KpnⅠ酶切后,用1139 bpXa21基因特异的探针进行了Southern杂交分析,获得了该转基因系特异的杂交指纹图谱(图6)。KpnⅠ酶切得到了9.9kb片段,即全长Xa21基因插入片段,说明Xa21基因完整插入到水稻染色体内,在后续继代过程中没有片段丢失。HindⅢ酶切得到长为4.4 kb的片段,与预期的片段大小一致,说明在继代繁殖过程中转基因Xa21基因内部也没有发生缺失。PvuⅡ酶切得到长约5.0 kb左右的特异性片段,根据Xa21基因内切酶图谱判断,该片段的一个酶切位点位于整合位点的侧翼序列, 因此5.0 kb片段可以作为CX8621转基因系特异的鉴定标记。

T-CX8621; N-明恢86。
T-CX8621; N-Minghui 86.
图6转基因株系CX8621第T11代Southern杂交
Fig. 6. Southern blot hybridization analysis of T11plants from CX8621.
2.4转基因系CX8621的抗谱鉴定以及病情指数分析
在分蘖盛期,对明恢 86、CX8621接种9个来自菲律宾的生理小种进行抗谱鉴定,并按照表1的病情分级标准,计算了病情指数:病情指数(%)=∑(各病级病叶数×各级代表数值)/(调查总叶数×发病最重级的代表数值)× 100%。发病最重的病情指数是100%,完全无病是0%,数值的高低表示发病的轻重。根据接种鉴定的结果,CX8621对8个菲律宾生理小种的抗性达到了高抗(表2)。相比对照明恢86以及IRBB21,抗性有显著增强,抗谱也有扩宽(图7)。
表1水稻白叶枯病病情分级标准
Table 1. Classification standard for rice bacterial blight disease.
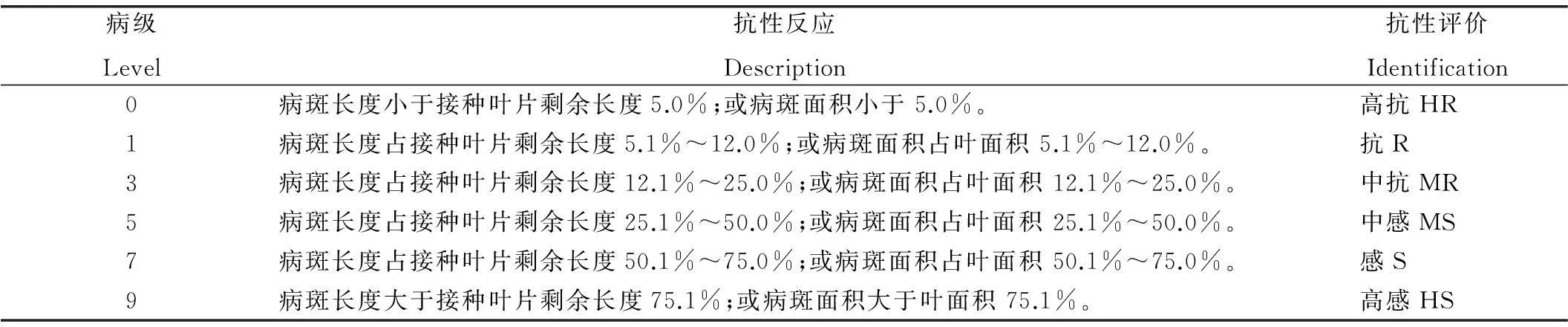
病级Level抗性反应Description抗性评价Identification0病斑长度小于接种叶片剩余长度5.0%;或病斑面积小于5.0%。高抗HR1病斑长度占接种叶片剩余长度5.1%~12.0%;或病斑面积占叶面积5.1%~12.0%。抗R3病斑长度占接种叶片剩余长度12.1%~25.0%;或病斑面积占叶面积12.1%~25.0%。中抗MR5病斑长度占接种叶片剩余长度25.1%~50.0%;或病斑面积占叶面积25.1%~50.0%。中感MS7病斑长度占接种叶片剩余长度50.1%~75.0%;或病斑面积占叶面积50.1%~75.0%。感S9病斑长度大于接种叶片剩余长度75.1%;或病斑面积大于叶面积75.1%。高感HS
HR,Highly resistant; R,Resistant; MR,Moderately resistent; MS,Moderately sensitive; S,Sensitive; HS,Highly sensitive. The same as below.
表2明恢86和CX8621对白叶枯病菌的抗性鉴定结果
Table 2. Resistance analysis of Minghui 86 and CX8621.

材料MaterialP1P2P3P4P6P7P8P9P10明恢86Minghui86MSHSSSSMSMSMRSCX8621HRHRRHRHRHRHRHRHR

1-10表示白叶枯菌小种P1~P10;图下数字表示平均病情指数,单位为%。
1-10,Xanthomonasoryzaepv.oryzaeP1 to P10, respectively; Number below the figure stands for the average disease index(%).
图7明恢86、CX8621和IRBB21的抗谱鉴定以及病情指数
Fig.7. Spectrum identification and resistance index of Minghui 86,CX8621 and IRBB21.
3讨论
无论转基因粮食作物还是转基因非粮食作物,外源基因在受体中的整合与遗传分析是开展安全评价的基本条件,标准都是一致的[18]。而对转基因作物的环境与食用安全评价的标准,则依据受体种类和外源基因的来源,需要个案对待[19]。为提高转化效率,富集转基因阳性植株,在遗传转化时常引入标记基因进行共转化;使用较多的是抗生素和抗除草剂标记[20]。然而在获得目标转基因株系后,这些标记就变成了冗余基因,它们的存在可能带来潜在的安全威胁[21]。此外,对携带选择标记基因的转基因生物体,在安全评价过程中还需要对标记的环境安全和食用安全进行评价,将大大增加转基因安全评价的项目内容与成本[22]。无选择标记将是转基因作物申请安全证书的基本要求。
对于得到的转基因株系,由于作物本身的多态性,对转基因工程体的检测是一项十分巨大的工作,尤其是在区分杂合状态下的转基因材料与分子标记辅助育种材料[23]。为了便于监管,我们用3种限制性内切酶绘制了转基因株系CX8621的杂交指纹图谱,其中PvuⅡ的一个酶切位点位于整合位点的侧翼序列,因此所获得的5.0 kb的片段可以作为此基因工程体特异的检测标记,便于日后对转基因材料的监管。
外源基因引入到植物体后要经历复杂的有性繁殖,尤其是减数分裂过程中的同源重组和交叉互换,这对转基因的遗传稳定性提出了挑战[24]。我们对CX8621进行了长达16代的跟踪研究,不仅在抗病性上没有发现分离;整合片段也没有发生丢失和改变,说明了Xa21在CX8621中能稳定遗传,对CX8621的利用可以有效改良水稻对白叶枯病的抗性。
谢辞:感谢中国农业科学院作物科学研究所周永力研究员提供白叶枯病鉴定菌株;感谢转基因生物新品种培育重大专项抗病转基因水稻新品种培育课题主持单位中国水稻研究所对本研究的支持。
参考文献:
[1]Lu B R, Snow A A. Gene flow from genetically modified rice and its environmental consequences.BioScience, 2005, 55(8): 669-678.
[2] 程式华,胡培松.中国水稻科技发展战略.中国水稻科学,2008,22(3):223-226.
Chen S Y, Hu P S. Development strategy of rice science and technology in China.ChinJRiceSci, 2008,22(3):223-226. (in Chinese with English abstract)
[3] 陈浩,林拥军,张启发. 转基因水稻研究的回顾与展望.科学通报,2009,54(18):2699-2717.
Chen H, Lin Y J, Zhang Q F. Review and prospect of transgenic rice research.ChinSciBull, 2009, 54: 2699-2717. (in Chinese with English abstract)
[4]Tang W, Chen H,Xu C, et al. Development of insect-resistant transgenic indica rice with a syntheticcry1C*gene.MolBreeding, 2006, 18(1): 1-10.
[5]尚玉花,李莉,陆徐忠,等.利用Cre/loxP系统删除转Bt基因水稻中的选择标记基因.生物学杂志,2011,28(2):5-8.
Shang Y H, Li L, Lu X Z, et al. Using Cre/loxP system to excise marker gene in Bt-transgenic rice.JBiol, 2011, 28(2): 5-8. (in Chinese with English abstract)
[6]夏志辉,李晓兵,陈彩艳,等.无选择标记和载体骨干序列的Xa21转基因水稻的获得. 生物工程学报,2006,22(2):204-210.
Xia Z H, Li X B, Chen C Y, et al. Generation of selectable marker-free and vector backbone sequence-freeXa21 transgenic rice.ChinJBiotech, 2006, 22(2): 204-210. (in Chinese with English abstract)
[7]吴爱忠,唐克轩,潘俊松,等.转基因培育抗除草剂水稻.遗传学报,2000,27(11):992-998.
Wu A Z, Tang K X, Pan J S, et al. Production of herbicide-resistant rice with transforming heterogene.ActaGeneSin, 2000, 27(11): 992-998. (in Chinese with English abstract)
[8]于恒秀,刘巧泉,陈秀花,等.根癌农杆菌介导的水稻转化体系的优化及转反义Wx基因植株的获得.中国水稻科学,2002, 16(4):304-310.
Yu H X, Liu Q Q, Chen X H, et al. Optimization ofAgrobacterium-mediated transformation of rice and regeneration of transgenic plants with antisenseWxgene.ChinJRiceSci, 2002, 16(4): 304-310. (in Chinese with English abstract)
[9]Gao Y F, Jing Y X, Shen S H, et al. Transfer of lysine-rich protein gene into rice and production of fertile transgenic plants.ActaBotSin, 2001, 43(5): 506-511.
[10]朱祯.转基因水稻研发进展.中国农业科技导报,2010,12(2):9-16.
Zhu Z. Progress in research and development of transgenic rice.JAgricSciTech, 2010, 12(2): 9-16. (in Chinese with English abstract)
[11]李黎红,叶卫军,郭龙彪.我国转基因水稻研究进展和商业化前景分析.中国稻米,2012,18(6):1-4.
Li L H, Ye W J, Guo L B. Research progress and commercialization prospect of transgenic rice in China.ChinaRice, 2012, 18(6): 1-4. (in Chinese with English abstract)
[12]农业部.农业转基因生物安全评价管理办法.中华人民共和国国务院公报,2002,35:28-33.
China Ministry of Agriculture. Measures for the safety assessment of agricultural genetically modified organisms. Gazette of the State Council of the People's Republic of China, 2002, 35: 28-33. (in Chinese)
[13]Maqbool S B, Christou P. Multiple traits of agronomic importance in transgenic indica rice plants: Analysis of transgene integration patterns, expression levels and stability.MolBreeding, 1999, 5(5): 471-480.
[14]Song W Y, Wang G L, Chen L L, et al. A receptor kinase-like protein encoded by the rice disease resistance gene,Xa21.Science, 1995, 270(5243): 1804-1806.
[15]Gao L F, Xia Z H, Jiang G H, et al. Generation of marker-free, bacterial blight-resistant transgenic sterile line and hybrid rice withXa21.PlantBreeding, 2011, 130(4):438-443.
[16]翟文学, 周永力. 由农杆菌介导将白叶枯病抗性基因Xa21 转入我国的5个水稻品种. 中国科学: C辑,2000,30(2):200-206.
Zhai W X, Zhou Y L. The rice bacterial blight resistance gene Xa21 was transferred into 5 rice varieties in China.SciChina:SeriesC, 2000, 30(2): 200-206. (in Chinese with English abstract)
[17]Wang G L, Song W Y, Ruan D L, et al. The cloned gene,Xa21, confers resistance to multipleXanthomonasoryzaepv.oryzaeisolates in transgenic plants.MolPlantMicrobeIn, 1996, 9(9): 850-855.
[18]武小霞,张彬彬,王志坤,等.转基因作物的生物安全性管理及安全评价.作物杂志,2010,4(1):1-4.
Wu X X, Zhang B B, Wang Z K, et al. Safety management and assessment of genetically modified organisms.Crops, 2010, 4(1): 1-4. (in Chinese with English abstract)
[19]何礼健,周玉婷,左停.转基因生物技术在农业领域的发展现状分析.安徽农业科学,2011,39(1):66-68.
He L J, Zhou Y T, Zuo T. Analysis on the development status of transgenic biotechnology in agricultural field.JAnhuiAgriSci, 2011, 39(1): 66-68. (in Chinese with English abstract)
[20]陈松彪, 李旭刚, 王锋, 等. 无选择标记转基因植物的培育. 中国生物工程杂志, 2005,25(2): 1-7.
Chen S B, Li X G, Wang F, et al. Culturing maker-free transgenic plants.ChinaBiotechnol, 2005, 35(2): 1-7. (in Chinese with English abstract)
[21]于恒秀,刘巧泉,徐丽,等.无抗性选择标记转基因软米和糯稻新品系的选育及中间试验.作物学报,2009,35(6):967-973.
Yu H X, Liu Q Q, Xu L, et al. Breeding and field performance of novel soft and waxy transgenic rice lines without selectable markers.ActaAgronSin, 2009, 35(6): 967-973. (in Chinese with English abstract)
[22]Yoder J I, Goldsbrough A P. Transformation systems for generating marker-free transgenic plants.Biotechnology, 1994, 12(3): 263-267.
[23]李晓飞,谭小力,李俊,等.转基因水稻检测用阳性质粒分子的构建及应用.生物技术通报,2013,7:71-77.
Li X F, Tan X L, Li J, et al. Construction and application of a plasmid reference molecule for detecting transgenic rice.BiotechnolBull, 2013, 7: 71-77. (in Chinese with English abstract)
[24]金万梅,潘青华,尹淑萍,等.外源基因在转基因植物中的遗传稳定性及其转育研究进展.分子植物育种,2005,3(6):112-116.
Jin W M, Pan Q H, Yin S P, et al. Progress of the genetic stability and breeding behavior of foreign gene in genetically modified plants.MolPlantBreeding, 2005, 3(6): 112-116. (in Chinese with English abstract)
Generation and Genetic Analysis ofXa21 Transgenic Rice Line CX8621 Without Selectable Markers
XIA Zhi-hui1,2,#, LIU Peng-cheng1,#, GAO Li-fen1, LIU Dong-feng1, JIANG Li1, JIANG Guang-huai1,GUO Le-qun1, ZHAI Wen-xue1,*
(1Institute of Genetics and Developmental Biology, Chinese Academy of Sciences, Beijing 100101, China;2Hainan Key Laboratory for Sustainable Utilization of Tropical Bioresources/College of Agriculture, Hainan University, Haikou 570228, China;#These authors contributed equally to this work;*Corresponding author, E-mail: wxzhai@genetics.ac.cn)
XIA Zhihui, LIU Pengcheng, GAO Lifen, et al. Generation and genetic analysis ofXa21 transgenic rice line CX8621 without selectable markers. Chin J Rice Sci, 2016, 30(1): 10-16.
Abstract:Selectable marker-free and stable inheritance are the basic requirements for safe application of transgenic crops. Following the regulations approved by the National Committee for Transgenic Biosafety, the wide spectrum bacterial blight resistance gene Xa21 was transferred into a widely used restorer line Minghui 86 by using a double right-borders T-DNA vector through Agrobacterium tumefaciens-mediated system. The transgene Xa21 was confirmed by resistance identification, PCR analysis and Southern blot in the progenies. The single-copy homozygous transgenic line CX8621 without selectable marker and vector backbone sequences was obtained from T3 generation. The transgenic restorer line CX8621 has stable bacterial blight resistance with years of observation and identification. Up to now, CX8621 has self-fertilized to 16th generation with stable inheritance of transgene Xa21 and passed the bio-safety evaluation of small and large scale of field tests (environmental release and productive test).
Key words:transgenic rice; bacterial blight; Xa21; selectable maker-free; stable inheritance
文章编号:1001-7216(2016)01-0010-07
中图分类号:Q755; S11.032
文献标识码:A
基金项目:国家转基因生物新品种培育重大专项(2008/2014ZX08001-002);中国科学院知识创新方向项目(KSCX2-EWN-01)。
收稿日期:2015-09-07; 修改稿收到日期: 2015-10-16。
