樟树茎段组培快繁
2016-04-28叶润燕童再康张俊红朱玉球浙江农林大学亚热带森林培育国家重点实验室培育基地浙江临安311300
叶润燕,童再康,张俊红,朱玉球(浙江农林大学亚热带森林培育国家重点实验室培育基地,浙江临安311300)
樟树茎段组培快繁
叶润燕,童再康,张俊红,朱玉球
(浙江农林大学亚热带森林培育国家重点实验室培育基地,浙江临安311300)
摘要:以当年生樟树Cinnamomum camphora带芽茎段为外植体,研究6-苄基腺膘呤(6-BA)和萘乙酸(NAA)在初代培养和继代培养过程中对樟树茎段腋芽及丛生芽诱导增殖的影响。结果表明:最适腋芽诱导培养基为MS(Murashige and Skoog)+1.00 mg·L(-1)6-BA+(0.01~0.10 mg·L(-1))NAA。继代培养时采用正交试验设计进行培养基筛选,经极差分析和方差分析得知丛生芽发生率较高的培养基为MS+1.00 mg·L(-1)6-BA+0.10 mg·L(-1)NAA,而丛生芽增殖最佳培养基为MS+(0.50~1.00)mg·L(-1)6-BA。将无菌苗转入最适生根培养基1/2MS+1.50 mg·L(-1)NAA,生根率可达90%;生根的无菌苗移栽至m(蛭石)∶m(泥炭)为1∶1的混合基质中,经过15~20 d练苗,95%以上无菌苗均能成活。这一结果为樟树优良品种的工业化育苗奠定了技术基础。图2表5参13
关键词:森林培育学;樟树;丛生芽;无性快繁;组织培养
樟树Cinnamomum camphora又名香樟,树型优美,适应性广,是传统的绿化观赏乔木树种。同时,樟树木材品质优异,用途独特,属珍贵用材树种。然而,对天然资源的调查发现,多数樟树树干分枝较低,出材率不高,只有极少数优良单株的干形通直,分枝高,出材率高。若这些优良单株通过有性繁殖其优良基因型不能固定,则后代分离严重,且多数劣变[1-2],因此,通过无性扩繁是固定樟树优良基因型的必然途径。无性繁殖主要包括扦插和组织培养两方面,但扦插繁殖受实验材料和季节的限制,繁殖系数较低[3]。组织培养技术可克服扦插繁殖存在的问题,不受材料和季节的限制可获得大量无性系。樟树茎段组培快繁技术的研究具有重要的现实意义。据相关研究报道[4-7],6-苄基腺膘呤(6-BA)和萘乙酸(NAA)的不同配比是影响樟树腋芽诱导率以及丛生芽增殖系数高低的关键,故如何筛选出丛生芽增殖系数较高的培养基配比方案,提高樟树繁殖的效率和效益,已成为樟树优良品种产业化的关键问题。因此,本研究采用正交试验设计,以初代培养获得的无菌苗为外植体,研究了基本培养基、6-BA和NAA 等3个因素对樟树丛生芽诱导与增殖的影响,以期获得樟树丛生芽增殖最佳之方案。同时探索试管苗生根[8]、练苗与移栽[9]等环节,力求得到试管苗移栽高成活率的方法。
1 材料与方法
1.1材料
樟树外植体茎段均来自于浙江农林大学遗传学科种质资源苗圃地选育的具有优良性状的个体。
1.2实验方法
1.2.1培养基针对丛生芽诱导增殖和生根的最佳培养基,设计了不同植物生长调节物质配比,包括6-BA和NAA以及3-吲哚丁酸(IBA)的培养基进行筛选。所用基本培养基无特殊说明均为MS(Murashige and Skoog)培养基,添加蔗糖30.00 g·L-1,琼脂5.50 g·L-1,pH 5.90。茎段和丛生芽数均为30个·处理-1,接3个·瓶-1,共10瓶,重复3次·处理-1。培养温度(25±2)℃,光照强度1 500 lx,光照时间为12 h·d-1。
1.2.2无菌苗的获得选取当年生半木质化、无病虫害、健壮的樟树茎段为外植体。进行材料处理时,首先去掉叶片,用漂白粉漂洗10~15 min,在流动的自来水中冲洗1~2 h,拭干水分待用。在无菌室内的超净工作台上用0.75 kg·L-1乙醇处理30 s,无菌蒸馏水冲洗3次后,1.00 g·L-1升汞灭菌10 min,再用无菌蒸馏水冲洗5~7次,洗去残余升汞。将消毒后的外植体剪成1.00~1.50 cm长带1~2个腋芽的茎段,快速接种在添加不同植物生长调节物质配比的A1~A6培养基中培养1个月。
1.2.3丛生芽的诱导及增殖以无菌苗为外植体,将其剪成1.00~1.50 cm的茎段,接种到丛生芽诱导培养基B1~B9中培养,1个月后统计丛生芽发生情况。采用正交试验设计,考虑基本培养基、6-BA和NAA等3个因素,3个水平·因素-1,选用L9(34)正交表的1,3和4列,共9种培养基。将樟树丛生芽切割成3株·丛-1接种在增殖培养基C1~C5中,进行丛生芽增殖试验,筛选出丛生芽增殖的最佳培养基。
1.2.4生根、练苗与移栽选择具叶色翠绿、具光泽、薄革质、完全展开叶片的高度约3 cm单芽,接种在生根培养基D1~D8中。15 d后统计其生根情况。生根培养时所用基本培养基为1/2MS。当植株的根系长度大于5 cm时,可将组培苗置于大棚内进行练苗试验,设定0,5,10,15,20和25 d共6个时间段,各个时间段收集20瓶苗。待设定时间结束后,将植株从瓶内取出,用自来水清洗根部培养基,移栽至m(蛭石)∶m(泥炭)为1∶1的混合基质中,统计其成活率。
1.2.5统计分析记录与统计不同阶段茎段产生的腋芽个数、丛生芽个数以及生根情况,其中正交试验结果采用SPSS统计分析软件进行极差分析和方差分析。
2 结果与分析
2.1 6-BA和NAA对樟树腋芽诱导的影响
不同植物生长调节物质配比对樟树茎段的腋芽诱导与生长情况统计结果见表1。对照组A6在未添加植物生长调节物质时,腋芽诱导率仅16.67%,外植体褐化率高达83.33%,显著低于其他组合,表明添加NAA和6-BA对腋芽诱导有显著影响;A1~A5处理的茎段随6-BA质量浓度和NAA质量浓度的增加,诱导率均呈下降趋势,以A2号即1.00 mg·L-16-BA + 0.01 mg·L-1NAA的诱导率最高,为90%;随着NAA质量浓度增加,畸形芽数和褐化率均有所增加,但芽的萌发个数并不完全随着NAA的增加而减少,例如,当NAA质量浓度为0.01~0.10 mg·L-1时,萌芽个数从63个增加到75个。综合分析表明,樟树腋芽诱导最佳培养基为MS+1.00 mg·L-16-BA+(0.01~0.10 mg·L-1)NAA。
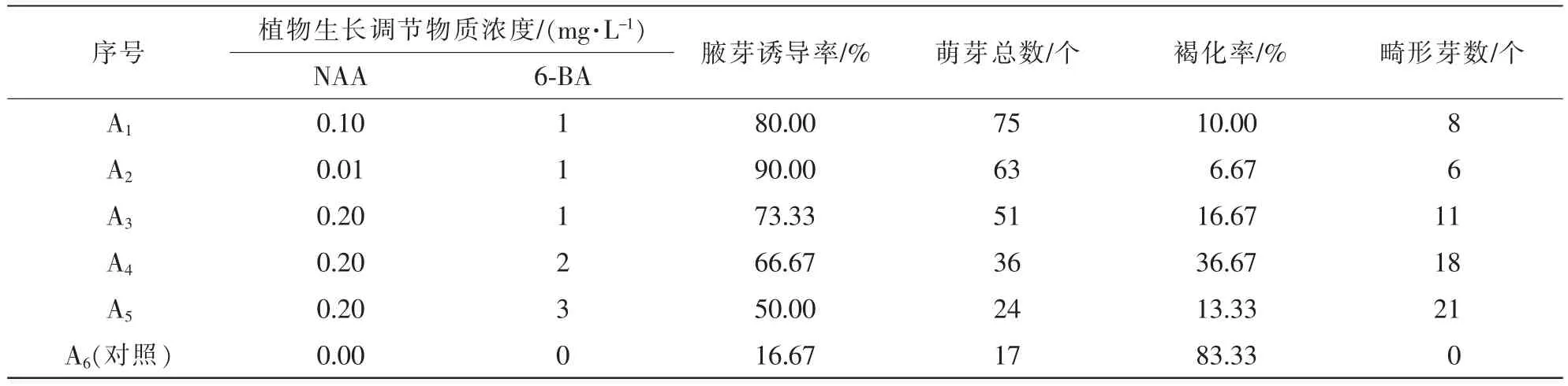
表1 不同质量浓度NAA和6-BA组合对樟树腋芽诱导的影响Table 1 Effect of different combinations of NAA and 6-BA on inducing the axillary bud in Cinnamomum camphora
2.2樟树丛生芽诱导最佳培养基筛选
采用正交试验设计研究基本培养基、6-BA和NAA对丛生芽诱导率的影响。9种处理组合获得的丛生芽诱导率经极差分析(表2)后表明,6-BA对樟树丛生芽诱导的影响最显著,R值高达105.13,其次为基本培养基,R值为63.47,而NAA的影响明显小于前2个因素,R值仅为19.77。方差分析(表3)表明:不同基本培养基和6-BA对丛生芽诱导存在显著差异,其显著性值为P<0.01,即2个因素对丛生芽诱导的影响是极显著的,而NAA对丛生芽形成存在显著影响(P=0.02),但未达极显著水平。最小显著差法(LSD)多重比较结果表明,丛生芽诱导的最适基本培养基为MS>1/2MS>B5,且三者间存在显著差异;1.00 mg·L-16-BA对丛生芽诱导的影响最大,0.50 mg·L-16-BA影响次之,0.10 mg·L-16-BA影响最小,且三者之间存在极显著差异;而0.10 mg·L-1NAA的影响最大,0 mg·L-1NAA影响次之,0.01 mg·L-1NAA影响最小,其中,0 mg·L-1和0.01 mg·L-1无显著差异,而1.00 mg·L-1和其余2个质量浓度之间存在显著差异。综合分析表明,樟树丛生芽诱导率最佳培养基为MS+1.00 mg·L-16-BA+0.10 mg·L-1NAA。

表2 樟树丛生芽诱导率极差分析Table 2 Range analysis for the induce of multiple shoots in C.camphora
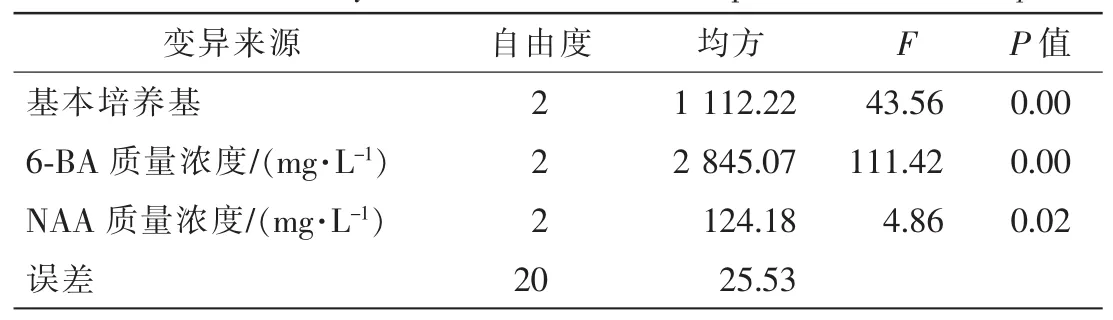
表3 樟树丛生芽诱导率方差分析Table 3 Variance analysis for the induce of multiple shoots in C.camphora
2.3 6-BA,NAA对樟树丛生芽增殖的影响
不同植物生长调节物质的质量浓度组合对樟树丛生芽增殖的影响见表4。5种培养基都使丛生芽成活均在96%以上,但丛生芽的增殖系数差异很大。当6-BA质量浓度在0.20~1.00 mg·L-1时,随着6-BA质量浓度升高,丛生芽的增殖系数显著提高,当6-BA质量浓度达到1.00 mg·L-1时,丛生芽增殖系数达到13.10,且芽苗生长正常。丛生芽增殖对NAA比较敏感,当NAA质量浓度达到0.10 mg·L-1时,出现愈合组织和畸形芽;当质量浓度高达0.20 mg·L-1时愈合化严重,影响芽苗的正常生长,且易形成畸形苗。因此,丛生芽增殖的最佳培养基为MS+(0.50~ 1.00 mg·L-1)6-BA。
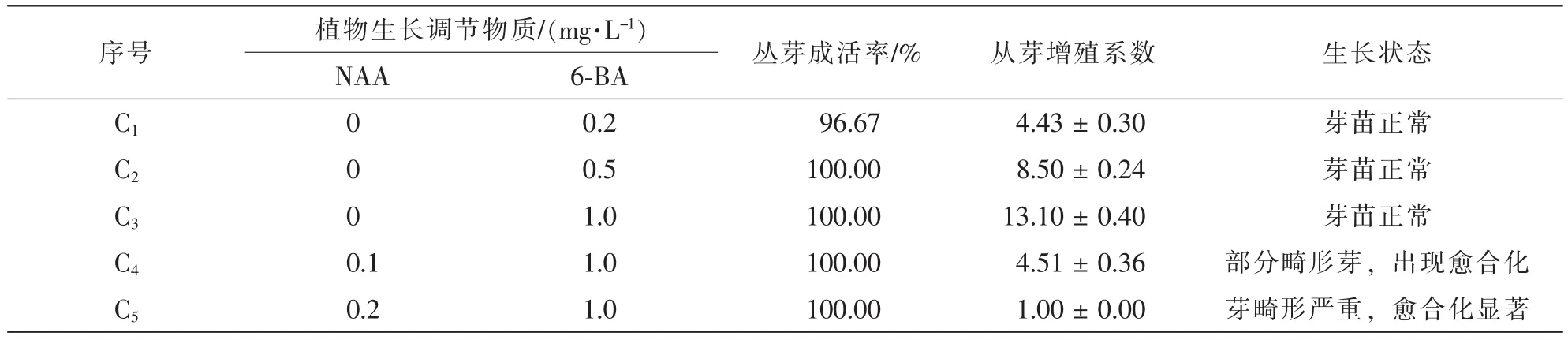
表4 不同质量浓度6-BA和NAA对丛生芽增殖的影响Table 4 Effect of the different combinations of NAA and 6-BA on the proliferation of multiple shoots
2.4 NAA和IBA对试管苗生根的影响
不同植物生长调节物质浓度组合对樟树试管苗生根的影响见表5。相同质量浓度的NAA和IBA对试管苗生根的影响不同,NAA比IBA更好地促进樟树试管苗生根。D3组合即NAA为1.50 mg·L-1时生根率高达90%,平均根数为7.23根·株-1,达到实验组合中最高水平;随着NAA质量浓度升高,平均根长变短,根变细且出现愈合化,D4组合即NAA质量浓度达到2.0 mg·L-1时平均根长仅3.11 cm,根细长,不利于移栽后的成活;D3组合中根生长状况虽不如D1和D2组合,但其根长(4.31 cm)与D2(4.59 cm)差异不大,且其生根率和平均根数都远高于其余组合。因此,认为樟树试管苗的最适生根培养基为1/2MS+1.50 mg·L-1NAA。

表5 不同质量浓度NAA和IBA对樟树试管苗生根的影响Table 5 Effect of the different combinations of NAA and IBA on the rooting of test-tube plantlet
2.5练苗时间对试验苗移栽成活率的影响
研究不同的练苗时间对樟树无菌苗成活率的影响见图1。发现随着练苗时间的增加,无菌苗移栽成活率呈现先上升后下降的趋势。其中,无菌苗的成活率最高时的练苗时间为15 d,成活率接近99.00%,随着练苗时间继续增加成活率开始下降,练苗20 d时下降至97.32%,这说明最佳的练苗时间应在15~20 d之内。练苗0 d或5 d时,植株的成活率均很低,不足60.00%,这说明练苗时间对樟树移栽成活率的影响较大,选择合适的练苗时间能有效提高试验苗移栽的成活率。
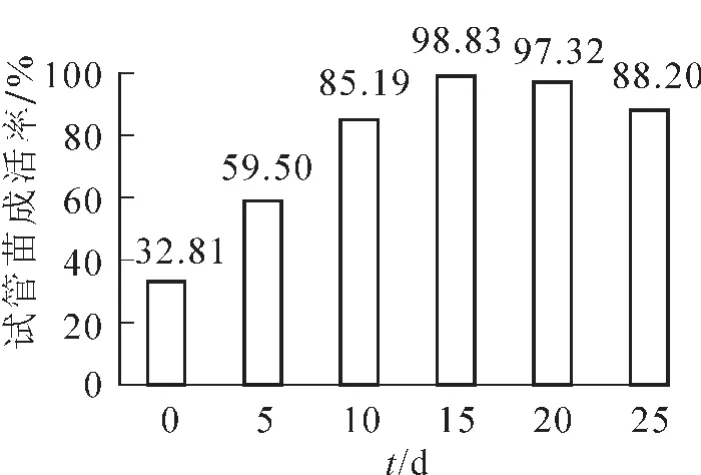
图1 练苗时间对试管苗成活率的影响Figure 1 Effect of the time for hardening-seedlings on the survival rate of the test-tube plantlet
3 小结与讨论
本研究选取了具有优良性状的樟树从腋芽诱导、丛生芽形成及增殖、试管苗生根到练苗移栽(图2)4个方面进行樟树茎段组培快繁技术的研究,得到最适腋芽诱导培养基为MS+1.00 mg·L-16-BA+(0.01~0.10 mg·L-1)NAA。采用正交试验设计分析得到丛生芽诱导最适培养基为MS+1.00 mg·L-16-BA+0.10 mg·L-1NAA而最佳增殖培养基则为MS+(0.50~1.00 mg·L-1)6-BA。将无菌苗转入最适生根培养基1/2MS+1.50 mg·L-1NAA,生根率可达90%,然后将生根的无菌苗移栽至m(蛭石)∶m(泥炭)为1∶1的混合基质中,经过15~20 d练苗,95%以上无菌苗均能成活。

图2 樟树丛生芽组织培养快繁不同阶段Figure 2 Different stages of mass propagation for multiple shoots in Cinnamomum camphora
6-BA和NAA是木本植物丛生芽快繁[10-13]中用途最广、价格也较便宜的2种植物生长调节物质。本研究即采用该2种植物生长调节物质进行腋芽诱导、丛生芽诱导和增殖,力求得到樟树丛生芽高效增殖培养基方案。经试验发现6-BA对樟树不定芽诱导具有突出的促进作用,在一定范围内,产生的不定芽数量随6-BA质量浓度的增加而增加[4],而NAA在一定质量浓度范围内可促进丛生芽诱导,但因其易产生愈合组织而影响苗生长,因此,在丛生芽诱导形成后可适量降低质量浓度甚至去除NAA,更利于丛生芽增殖分化。本研究中在樟树丛生芽增殖培养基中去除了NAA,其增殖系数可达到13.10,且芽苗生长状况良好无畸形芽出现。因此,在不同阶段合理利用NAA是木本植物提高丛生芽诱导率和增殖系数的关键因素。移栽组培苗是樟树组培的最后一个环节,也是关系成败的重要环节之一,直接影响组培苗的生长和成活率。研究发现练苗时间对樟树组培苗移栽成活率的影响较大,未经过练苗的成活率仅为32.81%,而经过15~20 d则可达到97.00%以上,且移栽后的幼苗生命力旺盛,长势良好。所以提高丛生芽增殖系数和移栽成活率,能有效提高人工快繁效率,为樟树优良品种的产业化栽培提供实验基础。
4 参考文献
[1]连芳青,熊伟,张露.樟树茎段的离体培养和植株再生[J].江西林业科技,1992(3):20-21.LIAN Fangqing,XIONG Wei,ZHANG Lu.In vitro culture and plantlet regeneration of stem segments of Cinnamomum camphora[J].J Jiangxi For Sci Technol,1992(3):20-21.
[2]黄建,闵伟.樟树幼叶愈伤组织诱导培养基的筛选[J].江西农业大学学报,1993,15(4):393-396.HUANG Jian,MIN Wei.Selection of medium for the callus induction from the tender leaves of Cinnamomum camphora[J].Acta Agric Univ Jiangxi,1993,15(4):393-396.
[3]欧景华.香樟组织培养快繁技术研究[J].内蒙古林业调查设计,2012,35(5):44-45.OU Jinghua.Tissue culture and rapid propagation of Cinnamomum caphora[J].Inner Mongolia For Invest Des,2012,35(5):44-45.
[4]王长宪,刘静,黄艳艳,等.山东抗寒香樟组培快繁体系的建立[J].山东农业大学学报:自然科学版,2006,37(4):513-516.WANG Changxian,LIU Jing,HUANG Yanyan,et al.Establishment of fast reproductive system of Shandong chilling tolerant Cinnamomum camphora Presl[J].J Shandong Agric Univ Nat Sci,2006,37(4):513-516.
[5]辜夕容,黄建国,杨庆.香樟离体培养体系的构建初探[J].中国农学通报,2005,21(2):97-100.GU Xirong,HUANG Jianguo,YANG Qing.Initial culture of Cinnamomum camphora(L.)Presl in vitro[J].Chin A-gric Sci Bull,2005,21(2):97-100.
[6]吴幼媚,王以红,蔡铃,等.香樟优良无性系快繁技术的研究[J].广西农业生物科学,2006,25(1):60-64.WU Youmei,WANG Yihong,CAI Ling,et al.Research of rapid propagation and tissue culture of elite clone Cinnamomum camphora[J].J Guangxi Agric Biol Sci,2006,25(1):60-64.
[7]郑红建.香樟组培快繁技术研究[J].林业科技开发,2012,26(1):103-105.ZHENG Hongjian.A tissue culture technique of Cinnamomum camphora[J].China For Sci Technol,2012,26(1):103-105.
[8]李乾振,吴丽君,陈碧华,等.芳樟工厂化育苗技术研究[J].福建林业科技,2001,28(4):21-24.LI Qianzhen,WU Lijun,CHEN Bihua,et al.The technical research on the Cinnamomum nominale factory-styled breeding[J].J Fujian For Sci Technol,2001,28(4):21-24.
[9]索长江,蔡斌华.香樟丛生芽的诱导和快速繁殖研究[J].林业科技开发,1997(3):29-30.SUO Changjiang,CAI Binhua.Clustered shoots induction and fast propagation in Cinnamomum camphora[J].China For Sci Technol,1997(3):29-30.
[10]李伟平,马丹丹,蒋福升,等.滴水珠组培快繁的实验研究[J].北京联合大学学报:自然科学版,2012,26(3):46-51.LI Weiping,MA Dandan,JIANG Fusheng,et al.A Study on rapid propagation technology of Cordate pinellia Tuber [J].J Beijing Union Univ Nat Sci,2012,26(3):46-51.
[11]王以红,陈晓明,蔡玲,等.大叶栎组织培养再生植株的研究[J].广西林业科技,2009,38(2):71-74.WANG Yihong,CHEN Xiaoming,CAI Ling,et al.Studies on tissue culture and plantlet regeneration of Castanopsis fissa[J].Guangxi For Sci,2009,38(2):71-74.
[12]周燕青,丁兰,徐步青,等.不同植物生长调节物质对条叶榕组织培养的影响[J].浙江农林大学学报,2013,30(3):453-458.ZHOU Yanqing,DING Lan,XU Buqing,et al.Tissue culture and rapid propagation of Ficus pandurata var.angustifolia with different plant growth regulators[J].J Zhejiang A&F Univ,2013,30(3):453-458.
[13]阮慧泽,李珍,任燕燕,等.半蒴苣苔的叶片组织培养及植株再生[J].浙江农林大学学报,2013,31(1):162-166.RUAN Huize,LI Zhen,RENG Yanyan,et al.Plantlet regeneration of Hemiboea subcapitata with subculturing[J].J Zhejiang A&F Univ,2013,31(1):162-166.
Tissue culture and rapid propagation for stems of Cinnamomum camphora
YE Runyan,TONG Zaikang,ZHANG Junhong,ZHU Yuqiu
(The Nurturing Station for the State Key Laboratory of Subtropical Silviculture,Zhejiang A &F University,Lin’an 311300,Zhejiang,China)
Abstract:To study the effect of naphthalene-acetic acid(NAA)and 6-benzylaminopurine 6-BA on the induction and multiplication of multiple shoots for Cinnamomum camphora during the process of primary culture and subculture,stems with axillary buds which sprouted at the beginning of spring were used as explants.To select the optimum medium for subculture,an orthogonal experiment was designed,and an extreme difference analysis and variance analysis(ANOVA)was used.Results showed that the optimal medium for inducing axillary buds was Murashige and Skoog(MS)+ 1.00 mg·L(-1)6-BA +(0.01-0.10 mg·L(-1))NAA.The orthogonal experiment and ANOVA showed that the best medium for formation of multiple shoots was MS + 1.00 mg·L(-1)6-BA + 0.10 mg·L(-1)NAA,and the optimum medium for proliferation of multiple shoots was MS + 0.50-1.00 mg·L(-1)6-BA.After the aseptic seedling was transferred to the optimum rooting medium(1/2MS + 1.50 mg·L(-1)NAA),the rooting rate reached above 90%.After 15-20 d of hardening,seedlings were transplanted to a mixed matrix with equal vermiculite and peat where the survival rate was greater than 95%.Thus,an efficient breeding technology for C.camphora was studied laying a technical foundation for industrialization of improved varieties.[Ch,2 fig.5 tab.13 ref.]
Key words:silviculture;Cinnamomum camphora;clustered shoots;asexual rapid propagation;tissue culture
作者简介:叶润燕,从事竹木育种研究。E-mail:yerunyan@126.com。通信作者:朱玉球,高级实验师,从事竹木育种研究。E-mail:yqzhu@zafu.edu.cn
基金项目:浙江省林木种苗产业创新团队资助项目(2009R50035);浙江省竹木育种重大专项(2012C12908-7);浙江农林大学研究生科研创新基金资助项目(3122013240236)
收稿日期:2015-01-29;修回日期:2015-06-04
doi:10.11833/j.issn.2095-0756.2016.01.024
中图分类号:S723.1;Q945.5
文献标志码:A
文章编号:2095-0756(2016)01-0177-06
