发酵葡萄籽粕对5~12周龄五龙鹅消化生理、免疫器官指数和抗氧化指标的影响
2016-04-27王宝维葛文华张名爱张开磊贾玉辉史雪萍
王宝维 隋 丽 岳 斌 葛文华 张名爱 张开磊 贾玉辉 史雪萍
(青岛农业大学优质水禽研究所,国家水禽产业技术体系营养与饲料功能研究室,青岛266109)
发酵葡萄籽粕对5~12周龄五龙鹅消化生理、免疫器官指数和抗氧化指标的影响
王宝维隋丽岳斌葛文华张名爱张开磊贾玉辉史雪萍
(青岛农业大学优质水禽研究所,国家水禽产业技术体系营养与饲料功能研究室,青岛266109)
摘要:本试验旨在研究饲粮中不同水平发酵葡萄籽粕对5~12周龄五龙鹅消化生理、免疫器官指数和血清抗氧化指标的影响,以确定发酵葡萄籽粕使用效果和适宜添加水平。选用5周龄五龙鹅288只,随机分为6个组,每个组6个重复,每个重复8只鹅(公母各占1/2)。对照组(Ⅰ组)饲喂基础饲粮,试验组在基础饲粮中分别添加2%(Ⅱ组)、4%(Ⅲ组)、6%(Ⅳ组)、8%(Ⅴ组)、10%(Ⅵ组)的发酵葡萄籽粕。试验期8周。结果表明:1)与对照组相比,Ⅴ组十二指肠和空肠中淀粉酶、胰蛋白酶、胰脂肪酶及胰腺中淀粉酶、胰蛋白酶活性极显著提高(P<0.01),Ⅳ组胰腺中胰脂肪酶活性极显著提高(P<0.01),Ⅴ组胃蛋白酶活性显著提高(P<0.05)。2)与对照组相比,Ⅳ组肠道中大肠杆菌数量显著降低(P<0.05),Ⅴ组肠道中乳酸杆菌数量显著提高(P<0.05),Ⅳ、Ⅴ组之间差异不显著(P>0.05)。3)与对照组相比,Ⅳ组肠绒毛高度显著提高(P<0.05),Ⅳ组肌层厚度显著提高(P<0.05),Ⅴ组隐窝深度极显著降低(P<0.01)。4)各组免疫器官指数差异不显著(P>0.05)。与对照组相比,Ⅴ组血清总抗氧化能力极显著提高(P<0.01);Ⅳ组血清丙二醛含量极显著降低(P<0.01),Ⅴ组血清总超氧化物歧化酶、谷胱甘肽过氧化物酶活性极显著提高(P<0.01)。由此可见,发酵葡萄籽粕能显著提高5~12周龄五龙鹅消化酶活性,优化肠道组织结构,提高鹅的抗氧化能力,对免疫器官指数没有影响。建议饲粮中发酵葡萄籽粕适宜添加水平为6%~8%。
关键词:发酵葡萄籽粕;鹅;消化生理;免疫器官指数;抗氧化指标
葡萄籽粕是由葡萄酒厂下脚料压榨葡萄籽油的副产品构成。葡萄籽粕通过微生物发酵解决其抗营养因子及过量木质素问题。益生菌作为重要绿色饲料添加剂,能够改善宿主肠道内环境,调节肠道微生态平衡和诱导宿主肠道免疫反应,替代抗生素,增强抗氧化能力。将发酵葡萄籽粕应用于饲料中,对于减少闲置资源、开发新型饲料资源具有重要经济价值和社会意义。好氧益生菌如芽孢杆菌等进入动物胃肠道后耗氧,能够抑制有害菌,减少肠道疾病,提高机体抗病能力,研究表明,益生菌能降低机体内大肠杆菌的数量,提高肠道内乳酸杆菌的数量[1-5]。益生菌能促进动物机体的消化酶分泌,加强物质代谢,尤其是芽孢杆菌,枯草芽孢杆菌和地衣芽孢杆菌具有较强的蛋白酶、脂肪酶、淀粉酶活性[6-7]。王洪瑞[8]研究表明,豆粕组合发酵物能够显著提高仔猪十二指肠、空肠和回肠内容物的蛋白酶活性,并能明显提高仔猪结肠内乳酸菌与大肠杆菌比值。邱良伟[9]研究表明,发酵棉粕能够提高肉仔鸡绒毛高度,降低隐窝深度,有效优化肠道结构,提高肠道消化吸收能力,并且能够显著提高免疫器官指数。葡萄籽粕中含有大量的多酚类物质,多酚类物质中原花青素(OPC)为主要物质,具有超强抗氧化能力,是维生素E的50倍,是维生素C的20倍,它能清除体内过多的自由基,其抗氧化能力已得到国际公认[10]。边玲等[11]研究表明,葡萄籽原花青素可增强机体组织抗氧化酶系统的活性,从而增强抗氧化能力,减少过氧化脂质的生成。张乐乐[12]研究表明,葡萄籽油能够提高小白鼠的肝脏、肾脏器官谷胱甘肽过氧化物酶(GSH-Px)、超氧化物酶的活性,具有一定抗氧化作用。朱立国[13]研究表明,微生物发酵生产的饲料中的有益菌能够调节肉鸭体内的微生态平衡,增强肉鸭的抗病能力。迄今为止,国内外关于葡萄籽粕对于人和动物的抗氧化功能、发酵饲料对动物消化生理影响已经进行了研究,但发酵葡萄籽粕对鹅消化酶活性、肠道微生物、消化器官及组织结构、抗氧化功能的影响的研究仍处于空白。本试验以5~12周龄五龙鹅为试验对象,通过研究不同水平发酵葡萄籽粕对鹅消化生理、肠道微生物、免疫器官指数与抗氧化指标的影响,以确定鹅对发酵葡萄籽粕利用效果与最适宜添加水平,丰富葡萄籽粕饲料营养价值数据库,为开发利用葡萄籽粕饲料资源和指导养鹅生产提供理论依据。
1材料与方法
1.1试验材料
葡萄籽粕粗纤维(CF)含量50.81%,粗蛋白质(CP)含量11.52%,钙含量0.55%,磷含量0.22%,市场选购。发酵葡萄籽粕由本实验室发酵制备,由草酸青霉(F67)、枯草芽孢杆菌、酿酒酵母菌和乳酸菌复合发酵葡萄籽粕(葡萄籽粕+辅料)制成;其产品营养成分为:CF含量35.99%,CP含量8.35%,钙含量0.59%,总磷含量0.49%,小肽(1 000 u以下)含量1.78%,经毒理学试验证明该产品安全无毒。试验鹅由国家水禽产业技术体系示范基地莱阳天森豁眼鹅繁育中心提供。
1.2试验设计
选择5周龄健康、体重均匀一致的五龙鹅288只,采用随机分配编号法,随机分为6个组,每组6个重复,每个重复8只(公母各占1/2)。Ⅰ组为对照组,饲喂基础饲粮;试验组在基础饲粮中分别添加2%(Ⅱ组)、4%(Ⅲ组)、6%(Ⅳ组)、8%(Ⅴ组)、10%(Ⅵ组)的发酵葡萄籽粕。试验期为8周。
1.3试验饲粮
基础饲粮参照NRC《家禽营养需要量》(1994年版)设计。同时每组饲粮营养水平按照能量、CP、钙、磷等一致的原则来设计,试验饲粮组成及营养水平见表1。
1.4饲养管理
试验前对鹅舍进行全面消毒;全期采取舍饲,地面厚垫料分栏饲养;试验鹅自由饮水和采食;少添勤喂;注意经常观察鹅群的生长状况。
1.5样品采集与处理
12周龄初,从每个重复随机抽取2只鹅(公母各占1/2),共计72只,饲养试验结束时,翅静脉采血10 mL,3 000 r/min离心15 min制得血清样品。屠宰放血处死后,迅速剖开腹腔,立即结扎肠道各部分的分界,取盲肠于灭菌的离心管中,-40 ℃冷冻保存。摘取全部消化道,分离腺胃、十二指肠、胰腺、空肠,用液氮速冻,并转至-20 ℃的冰箱内保存备用。取其胸腺、脾脏、法氏囊,用滤纸吸取多余水分和血液,剔去多余组织、脂肪,称重。
腺胃内容物上清液的制备:腺胃室温下解冻,将采集的内容物样品用4 ℃的去离子水按其重量10倍体积稀释,低温匀浆后离心15 min(3 000 r/min)得上清液分装-20 ℃冰箱中保存待用。
胰腺上清液的制备:胰腺解冻后从头、体、尾3个部位采取胰腺样品,用其重量10倍体积的4 ℃去离子水稀释,低温下研碎并4 ℃离心20 min(3 000 r/min)得上清液分装-20 ℃冰箱中保存待用。
十二指肠、空肠内容物上清液的制备:置室温下的小肠在完全解冻前沿肠管纵向剪开,样品均用10倍体积的4 ℃去离子水稀释。稀释液匀浆45 s(1 200 r/min),匀浆玻璃管外设冰浴。4 ℃下离心15 min(3 000 r/min)得上清液分装-20 ℃冰箱中保存待用。
1.6消化酶活性指标测定
胃蛋白酶(腺胃)、胰蛋白酶(胰腺、十二指肠、空肠)、淀粉酶(胰腺、十二指肠、空肠)、胰脂肪酶(胰腺、十二指肠、空肠)的活性,试剂盒购自南京建成生物工程研究所,具体测定方法参照说明书进行。
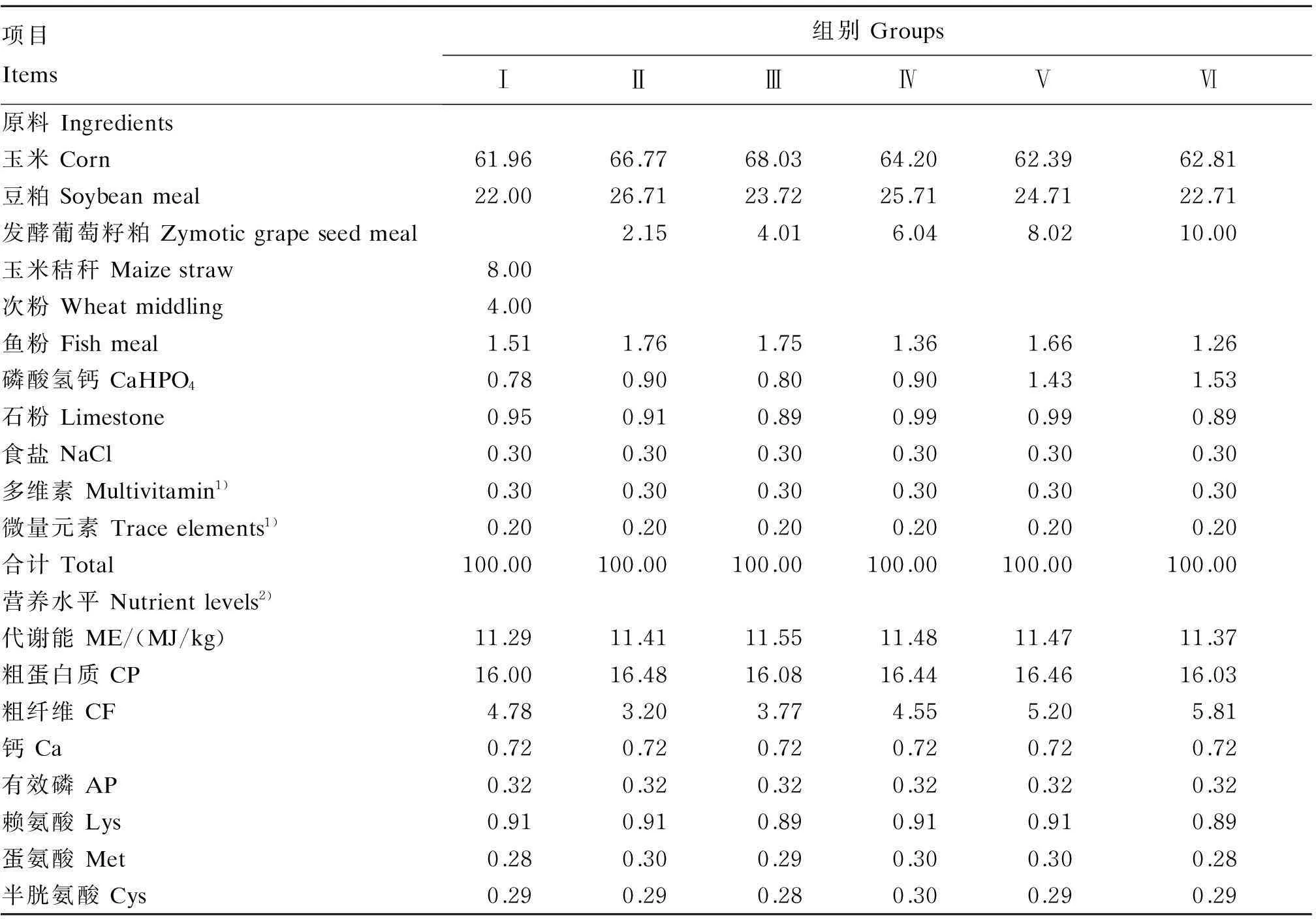
表1 试验饲粮组成及营养水平(风干基础)
1)多维素和微量元素为每千克饲粮提供The multivitamin and trace elements provided the following per kg of diets:烟酸 nicotinic acid 65 mg,泛酸 pantothenate 15 mg,叶酸 folic acid 0.5 mg,VD3200 IU,VA 1 500 mg,VB12.2 mg,VB25.0 mg,VB62 mg,VE 12.5 mg,VK31.5 mg,生物素 biotin 0.2 mg,胆碱 choline 1 000 mg,Fe 85 mg,Zn 80 mg,Mn 80 mg,I 0.42 mg,Se 0.3 mg,Co 2.5 mg,Cu 6 mg。
2)营养水平为计算值。Nutrient levels were calculated values.
1.7肠道微生物测定
取室温解冻后盲肠1 g内容物于盛有9 mL灭菌稀释液的灭菌试管中,用漩涡振荡器混匀,制成10-1稀释液,用微量移液枪准确吸取该稀释液1 mL于盛有9 mL事先灭菌的稀释液试管中,用旋涡振荡器振荡1~2 min,制成10-2稀释液,依次进行10-5~10-3倍稀释。每个稀释度各3滴分别接种于相应的培养基上,每个梯度设2个重复,其中大肠杆菌采用伊红美蓝琼脂培养基(EMB培养基),双歧杆菌采用双歧杆菌选择性培养基(BBL培养基),乳酸杆菌采用乳酸细菌培养基(MRS培养基),其中大肠杆菌37 ℃有氧培养24 h后进行菌落计数,乳酸杆菌和双歧杆菌35 ℃厌氧培养48 h。以30~300个菌落的稀释度作为计数用。细菌数量采用平板菌落计数法进行统计,按公式(每克肠道内容物中细菌数量=菌落数×滴数×稀释倍数)计算出每克内容物中的细菌数量,最后以每克肠道内容物中细菌个数的对数值[lg(CFU/g)]表示。
1.8抗氧化指标测定
血清总抗氧化能力(T-AOC)、总超氧化物歧化酶(T-SOD)活性、GSH-Px活性和丙二醛(MDA)含量均用试剂盒测定,试剂盒购自南京建成生物工程研究所,具体测定方法参照说明书进行。
1.9统计分析
用SPSS 17.0统计软件进行统计分析。显著性检验采用LSD法多重比较,试验数据以“平均值±标准差”表示。P<0.05和P<0.01分别为差异显著和极显著水平。
2结果与分析
2.1饲粮中不同水平发酵葡萄籽粕对鹅消化酶活性的影响
由表2可知,Ⅴ组的十二指肠中淀粉酶、胰蛋白酶、胰脂肪酶活性最高,极显著高于对照组(P<0.01),Ⅳ、Ⅴ组之间胰蛋白酶活性差异不显著(P>0.05);Ⅴ组的空肠中淀粉酶、胰蛋白酶、胰脂肪酶活性最高,极显著高于对照组(P<0.01),Ⅳ、Ⅴ组之间淀粉酶、胰脂肪酶活性差异不显著(P>0.05);Ⅴ组的胰腺中淀粉酶、胰蛋白酶活性最高,极显著高于对照组(P<0.01),Ⅳ组的胰腺中胰脂肪酶活性最高,极显著高于对照组(P<0.01),Ⅳ、Ⅴ组之间淀粉酶、胰脂肪酶活性差异不显著(P>0.05);Ⅴ组的胃蛋白酶活性最高,显著高于对照组(P<0.05)。
以上结果表明,发酵葡萄籽粕的添加可以显著或极显著提高十二指肠、胰腺、空肠中消化酶的活性,提高胃蛋白酶的活性,当发酵葡萄籽粕的添加水平为6%~8%时消化酶活性最高。

表2 饲粮中不同发酵葡萄籽粕水平对鹅消化酶活性的影响
同列数据肩标相同小写字母或无字母表示差异不显著(P>0.05),相邻小写字母表示差异显著(P<0.05),相间小写字母表示差异极显著(P<0.01)。表3、表6同。
In the same column, values with the same small or no letter superscripts mean no significant difference (P>0.05), while with adjacent small letter superscripts mean significant difference (P<0.05), and with alternate small letter superscripts mean significant difference (P<0.01). The same as Table 3 and Table 6.
2.2饲粮中不同水平发酵葡萄籽粕对鹅肠道菌群平衡的影响
由表3可知,Ⅳ组的大肠杆菌数量最少,与对照组相比差异显著(P<0.05),Ⅳ、Ⅴ组之间差异不显著(P>0.05);Ⅴ组的乳酸菌数量最多,与对照组相比差异显著(P<0.05),Ⅳ、Ⅴ组之间差异不显著(P>0.05);Ⅴ组的双歧杆菌数量最多,各组间差异不显著(P>0.05)。
以上结果表明,发酵葡萄籽粕能够明显降低鹅盲肠中的大肠杆菌数量,增加盲肠中的乳酸杆菌、双歧杆菌的数量,当发酵葡萄籽粕添加水平为6%~8%时肠道有益菌群比例提高。

表3 饲粮中不同水平发酵葡萄籽粕对鹅盲肠菌群平衡的影响
2.3饲粮中不同水平发酵葡萄籽粕对鹅空肠组织结构的影响
由表4可知,Ⅳ组的肠绒毛高度最大,与对照组相比差异显著(P<0.05),与Ⅲ、Ⅴ组差异不显著(P>0.05);Ⅳ组的肌层厚度最厚,与对照组相比差异显著(P<0.05),与Ⅲ组差异不显著(P>0.05);
Ⅴ组的隐窝深度最浅,与对照组相比差异极显著(P<0.01)。
以上结果表明,发酵葡萄籽粕能够优化肠道结构,当发酵葡萄籽粕添加水平为6%~8%时肠道组织发育最快。
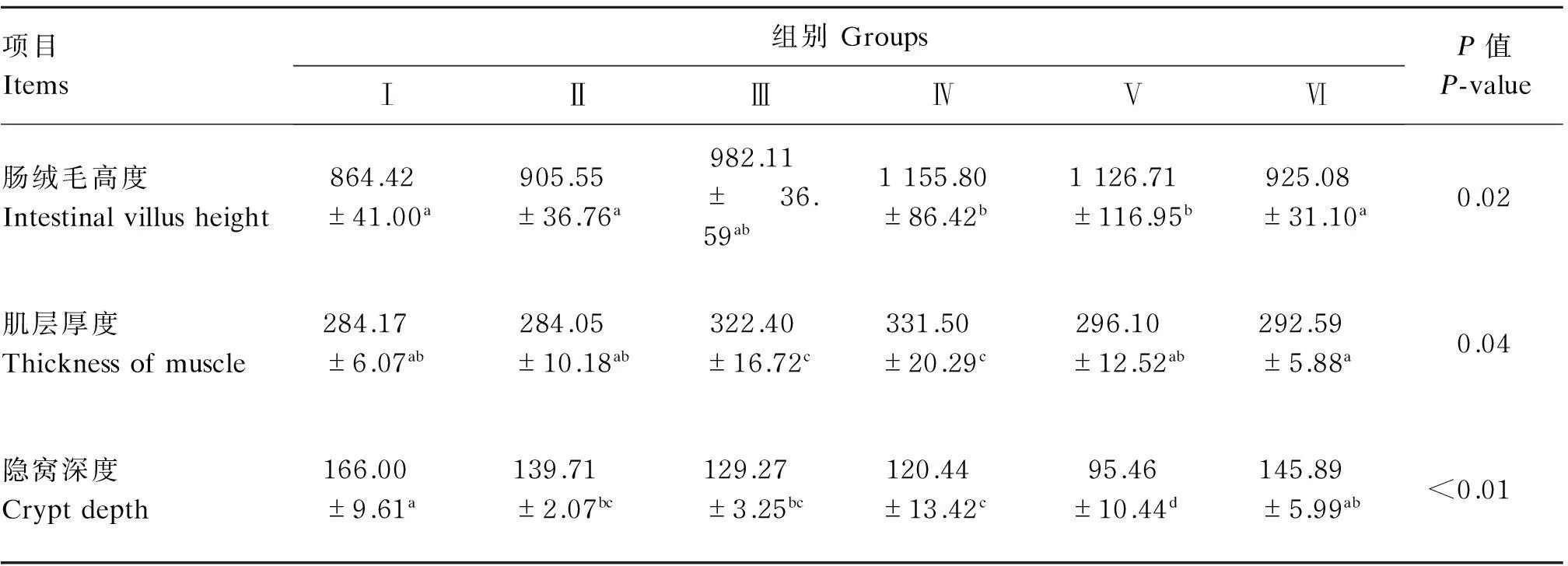
表4 饲粮中不同水平发酵葡萄籽粕对鹅空肠组织结构的影响
同行数据肩标相同小写字母或无字母表示差异不显著(P>0.05),相邻小写字母表示差异显著(P<0.05),相间小写字母表示差异极显著(P<0.01)。表5同。
In the same row, values with the same small or no letter superscripts mean no significant difference (P>0.05), while with adjacent small letter superscripts mean significant difference (P<0.05), and with alternate small letter superscripts mean significant difference (P<0.01). The same as Table 5.
2.4饲粮中不同水平发酵葡萄籽粕对鹅免疫器官指数的影响
由表5可知,Ⅳ组的胸腺指数最大,各组间差异不显著(P>0.05);Ⅳ、Ⅴ组的脾脏指数最大,各组间差异不显著(P>0.05);Ⅳ组的法氏囊指数最大,各组间差异不显著(P>0.05)。
以上结果表明,发酵葡萄籽粕能够影响鹅的免疫器官发育,当发酵葡萄籽粕的添加水平为6%~8%时免疫器官指数最高。
2.5饲粮中不同水平发酵葡萄籽粕对鹅血清抗氧化指标的影响
由表6可知,Ⅴ组的血清T-AOC最高,与对照组相比差异极显著(P<0.01);Ⅳ组的血清MDA含量最少,与对照组相比差异极显著(P<0.01),Ⅲ、Ⅳ、Ⅴ、Ⅵ组之间差异不显著(P>0.05);Ⅴ组血清T-SOD、GSH-Px活性最高,与对照组相比差异极显著(P<0.01);Ⅳ、Ⅴ组之间差异不显著(P>0.05)。
以上结果表明,发酵葡萄籽粕能够提高鹅的抗氧化能力,当发酵葡萄籽粕添加水平为6%~8%时机体抗氧化指标最高。

表5 饲粮中不同水平发酵葡萄籽粕对鹅免疫器官指数的影响

表6 饲粮中不同水平发酵葡萄籽粕对鹅血清抗氧化指标的影响
3讨论
3.1饲粮中不同水平发酵葡萄籽粕对鹅消化酶活性的影响
熊峰[14]研究表明,纳豆芽孢杆菌制剂能显著提高21、42日龄肉鸡十二指肠和空肠内淀粉酶﹑胰蛋白酶活性。刘济[15]研究表明,饲喂发酵豆粕能够显著提高爱拔益加肉鸡的十二指肠、空肠中胰蛋白酶和脂肪酶活性。胡永娜等[16]研究表明,发酵菜籽粕显著提高了21和42日龄肉仔鸡十二指肠、空肠、回肠和盲肠中蛋白酶、淀粉酶和脂肪酶活性。杨维仁等[17]研究表明,哺乳期仔猪饲粮中添加4%植物小肽显著提高断奶仔猪胰脏中胃蛋白酶、十二指肠中脂肪酶和淀粉酶活性。郭元晟等[18]研究表明,饲粮中添加适量乳酸菌能够提高肉鸡空肠和胰腺组织淀粉酶活性,空肠和回肠胰蛋白酶活性及十二指肠糜蛋白酶活性也有显著的增强效果。汤江武等[19]试验证实,芽孢能在爱拔益加肉鸡肠道内萌发并停留超过72 h,并对提高肠道内消化酶活性和改善菌落结构发挥作用。本试验结果表明,发酵葡萄籽粕添加水平为6%~8%,可以显著提高十二指肠、胰腺、空肠中消化酶的活性,提高胃蛋白酶的活性,此结果与上述研究结果一致。
3.2饲粮中不同水平发酵葡萄籽粕对鹅肠道菌群平衡的影响
熊峰[14]研究表明,纳豆芽孢杆菌制剂能显著减少21、42日龄肉鸡回肠﹑盲肠内大肠杆菌和沙门氏菌数量,增加乳酸杆菌数量。Guerra等[20]也报道了乳酸菌可以有效的抑制肠道中大肠杆菌的生长繁殖。Juven等[21]和Reid等[22]研究发现,乳酸杆菌产生的细菌素有抑制沙门氏菌、大肠杆菌、志贺氏菌的作用。黄其永[23]研究表明,灌服德氏乳杆菌提高了仔猪的绒毛高度和隐窝深度。马治宇等[24]研究表明,单独在饲粮中添加乳酸菌菌粉能显著抑制大肠埃希菌的繁殖,促进乳酸菌、双歧杆菌的增殖,效果显著。乳酸菌菌粉和菌液能够显著促进盲肠和回肠绒毛的生长,使肠壁的厚度增加;乳酸菌残液和灭活菌液效果不显著。胡顺珍等[25]研究表明,复合微生态制剂及其辅佐剂的添加能在一定条件下降低肉鸡盲肠大肠杆菌数量。本试验结果表明,发酵葡萄籽粕6%~8%添加水平可以显著减少盲肠中大肠杆菌的数量,显著增加乳酸菌的数量,增加双歧杆菌的数量,此结果与上述研究结果一致。
3.3饲粮中不同水平发酵葡萄籽粕对鹅免疫器官指数和血清抗氧化指标的影响
葡萄籽粕本身所含有的丰富的维生素E,还有原花青素都具有抗氧化功能,用来发酵葡萄籽粕的混合菌种,也能够产生抗氧化物质。刘济[15]研究表明,饲喂发酵豆粕能促进爱拔益肉鸡免疫器官的生长发育,显著提高胸腺指数、脾脏指数、法氏囊指数。胡永娜等[16]研究表明,发酵菜籽粕组显著提高了21、42日龄肉仔鸡的脾脏指数、胸腺指数。胡顺珍等[25]研究表明,复合微生态制剂及其辅佐剂的添加能显著提高肉鸡血清T-AOC。张爱忠等[26]研究表明,适量添加酵母培养物(yeast culture,YC)可以显著降低试验期绒山羊血清MDA含量,提高血清GSH-Px的活性,显著提高血清T-SOD的活性和各组机体T-AOC;李银平等[10]研究表明,应用原花青素可使血清MDA含量降低,且应用剂量越大,降低幅度越大。微生物发酵产生小肽,小肽参与机体免疫调节,提高其免疫机能[27]。祝平[28]研究表明,哺乳期补饲植物小肽能够刺激断奶仔猪肠道发育,使断奶仔猪肠道绒毛高度增加,隐窝深度变浅,陈生龙[29]研究表明,断奶仔猪的饲粮中添加适量活性饲料酵母粉能增强断奶仔猪的免疫功能。本试验结果表明,发酵葡萄籽粕添加水平为6%~8%可以显著提高鹅抗氧化能力,此结果与上述研究结果一致,但对其免疫器官指数没有影响。
4结论
① 饲粮中添加适宜水平发酵葡萄籽粕显著提高十二指肠、胰腺、空肠中消化酶的活性,提高胃蛋白酶的活性。
② 饲粮中添加适宜水平发酵葡萄籽粕显著减少盲肠中大肠杆菌的数量,增加乳酸杆菌、双歧杆菌的数量,提高肠绒毛高度、肌层厚度,使隐窝深度变浅,优化肠道组织结构。
③ 饲粮中添加适宜水平发酵葡萄籽粕能够提高鹅的胸腺指数、脾脏指数、法氏囊指数,但不明显;显著提高鹅的血清T-AOC及T-SOD、GSH-Px活性,减少血清MDA含量。
④ 建议鹅饲粮中发酵葡萄籽粕添加适宜水平为6%~8%。
参考文献:
[1]苏绍辉.益生菌在动物生产中的应用与发展趋势[J].安徽农学通报,2007,13(3):116-117,121.
[2]周淑兰,曹国文,戴荣国,等.混合芽孢杆菌对肉用仔鸡生产性能和盲肠微生物菌群的影响试验[J].甘肃畜牧兽医,2007,37(6):23-26.
[3]李玲,杨桂芹.益生菌和异麦芽寡糖对肉仔鸡盲肠菌群及生产性能的影响[J].中国畜牧杂志,2008,44(1):32-34.
[4]苏勇,姚文,黄瑞华,等.芽孢乳杆菌S1对断奶前后仔猪肠道乳酸菌、大肠杆菌和挥发性脂肪酸含量变化的影响[J].福建农林大学学报:自然科学版,2006,35(1):73-76.
[5]FULLER R,GIBSON G R.Modification of the intestinal microflora using probiotics and prebiotics[J].Scandinavian Journal of Gastroenterology,1997,32:28-31.
[6]唐志刚,钱巧玲,侯晓莹,等.益生菌的作用机理及其在肉鸡和蛋鸡中的应用[J].家畜生态学报,2010,31(2):5-8.
[7]陈丽艳,白凤珍,程立军.芽孢杆菌对肉仔鸡蛋白质代谢的影响[J].内蒙古民族大学学报:自然科学版,2005,20(1):86-88.
[8]王洪瑞.豆粕发酵工艺改进及发酵物对仔猪生长性能的影响[D].硕士学位论文.泰安:山东农业大学,2012.
[9]邱良伟.发酵对棉粕营养特性及其在肉鸡中的应用研究[D].硕士学位论文.合肥:安徽农业大学,2012.
[10]李银平,薛雪萍,袁春龙,等.葡萄籽成分与营养评价[J].食品与发酵工业,2006,32(12):108-113.
[11]边玲,范培红.葡萄籽提取物的化学成分及药理活性研究概况[J].食品与药品,2005,7(4A):20-22.
[12]张乐乐.葡萄籽在动物营养中的研究进展[J].饲料工业,2009,30(19):46-48.
[13]朱立国.肉鸭微生物发酵饲料的工艺研究及应用[D].硕士学位论文.西安:西北大学,2007.
[14]熊峰.大豆低聚糖和纳豆芽孢杆菌制剂及其组合对肉鸡生产性能、肠道消化酶及菌群平衡的影响[D].硕士学位论文.乌鲁木齐:新疆农业大学,2008.
[15]刘济.发酵豆粕对AA肉鸡生长性能、免疫功能及其消化酶的影响[D].硕士学位论文.湛江:广东海洋大学,2012.
[16]胡永娜,王之盛,李爱科.固态发酵菜籽粕对肉仔鸡生长性能、免疫功能及消化酶活性的影响[J].动物营养学报,2012,24(7):1293-1301.
[17]杨维仁,祝平,杨在宾,等.哺乳期使用植物小肽对断奶仔猪消化酶活性、免疫功能及消化道酸度的影响[J].中国粮油学报,2008,23(2):136-141.
[18]郭元晟,闫素梅,张和平,等.发酵乳酸杆菌对肉鸡胰腺和小肠消化酶活性及营养物质消化率的影响[J].动物营养学报,2011,23(7):1225-1232.
[19]汤江武,孙宏,姚晓红,等.芽孢杆菌在肉鸡肠道内的分布及对肠道菌群、消化酶活性的影响[J].浙江大学学报:农业与生命科学版,2011,37(3):319-325.
[20]GUERRA N P,BERNRDEZ P F,MÉNDEZ J,et al.Production of four potentially probiotic lactic acid bacteria and their evaluation as feed additives for weaned piglets[J].Animal Feed Science and Technology,2007,134(1/2):89-107.
[21]JUVEN B J,MEINERSMANN R J,STERN N J.Antagonistic effects of lactobacilli and pediococci to control intestinal colonization by human enteropathogens in live poultry[J].Journal of Applied Bacteriology,1991,70(2):95-103.
[22]REID G,MCGROARTY J A,ANGOTTI R,et al.Lactobacillusinhibitor production againstEscherichiacoliand coaggregation ability with uropathogens[J].Canadian Journal of Microbiology,1988,34(3):344-351.
[23]黄其永.德氏乳杆菌对哺乳仔猪消化器官及消化酶活性的影响研究[D].硕士学位论文.长沙:湖南农业大学,2013.
[24]马治宇,赵献军,张晓庆,等.乳酸菌及其培养液对肉鸡盲肠菌群的影响[J].西北农业学报,2008,17(3):33-36.
[25]胡顺珍,张建梅,谢全喜,等.复合微生态制剂对肉鸡生产性能、肠道菌群、抗氧化指标和免疫功能的影响[J].动物营养学报,2012,24(2):334-341.
[26]张爱忠,卢德勋,姜宁,等.酵母培养物对绒山羊机体抗氧化能力的影响[J].动物营养学报,2010,22(3):781-786.
[27]张呈军,李建鑫.小肽的营养及其在畜禽生产上的应用[J].安徽农业科学,2006,34(13):3072-3074.
[28]祝平.植物小肽对断奶仔猪生产性能影响及其机理的研究[D].硕士学位论文.泰安:山东农业大学,2007.
[29]陈生龙.活酵母对断奶仔猪生产性能、免疫功能和肠道微生物区系的影响[D].硕士学位论文.福州:福建农林大学,2009.
Author, WANG Baowei, professor, E-mail: wangbw@qau.edu.cn
(责任编辑武海龙)
Effects of Zymotic Grape Seed Meal on Digestive Physiology,Immune Organ Indices and Antioxidant Indices ofWulongGeese Aged from 5 to 12 Weeks
WANG BaoweiSUI LiYUE BinGE WenhuaZHANG Ming’ai ZHANG KaileiJIA YuhuiSHI Xueping
(Institute of High Quality Waterfowl, Qingdao Agricultural University, Nutrition and Feed Laboratory of China Agriculture Research System, Qingdao 266109, China)
Abstract:This experiment was conducted to study the effects of dietary different zymotic grape seed meal levels on digestive physiology, immune organ indices and serum antioxidant indices of Wulong geese aged from 5 to 12 weeks, to find the appropriate supplemental level of the zymotic grape seed meal and its feed effect. A total of 288 five-week-old Wulong geese were randomly divided into 6 groups with 6 replicates per group and 8 geese per replicate (half male and half female). Geese in the control group (group Ⅰ) were fed a basal diet, and the others were fed the basal diet supplemented with 2% (group Ⅱ), 4% (group Ⅲ), 6% (group Ⅳ), 8% (group Ⅴ), 10% (group Ⅵ) zymotic grape seed meal, respectively. The experiment lasted for 8 weeks. The results showed as follows: 1) compared with the control group, the activities of amylase, trypsin, lipase in duodenum and jejunum in group Ⅴ were significantly increased (P<0.01), the activities of amylase and trypsin in pancreas in group Ⅴ were significantly increased (P<0.01); the activity of lipase in pancreas in group Ⅳ was significantly increased (P<0.01); the activity of pepsin in group Ⅴ was significantly increased (P<0.05). 2) Compared with the control group, the number of Escherichia coli in intestinal tract in group Ⅳ was significantly decreased (P<0.05), the number of Lactobacillus in intestinal tract in group Ⅴ was significantly increased (P<0.05), but there were no significant differences between group Ⅳ and group Ⅴ (P>0.05). 3) Compared with the control group, the intestinal villus height in group Ⅳ was significantly increased (P<0.05); the thickness of muscle in group Ⅳ was significantly increased (P<0.05); the crypt depth in group Ⅴ was significantly decreased (P<0.01). 4) There were no significant differences on immune organ indices among all groups (P>0.05). Compared with the control group, the serum total antioxidant capacity in group Ⅴ was significantly increased (P<0.01); the serum malonaldehyde content in group Ⅳ was significantly decreased (P<0.01), the activities of total superoxide dismutase and glutathione peroxidase in serum in group Ⅴ were significantly increased (P<0.01). In conclusion, zymotic grape seed meal can improve digestive enzyme activity, optimize the structure of intestinal tissue, improve antioxidant function of Wulong geese aged from 5 to 12 weeks, and has no effect on immune organ index, and the dietary appropriate supplemental level is 6% to 8%.[Chinese Journal of Animal Nutrition, 2016, 28(1):163-171]
Key words:zymotic grape seed meal; geese; digestive physiology; immune organ indices; antioxidant indices
中图分类号:S835
文献标识码:A
文章编号:1006-267X(2016)01-0163-09
作者简介:王宝维(1959—),男,山东荣成人,教授,硕士生导师,研究方向为动物营养与保健。E-mail: wangbw@qau.edu.cn
基金项目:国家水禽产业技术体系专项基金(CARS-43-11);山东省良种工程(2014LZ19)
收稿日期:2015-07-08
doi:10.3969/j.issn.1006-267x.2016.01.022
