米渣蛋白双酶法制备工艺的研究
2016-04-26曾国强胡中泽
曾国强,胡中泽、2
(1.武汉轻工大学 食品科学与工程学院,湖北 武汉 430023;2.农产品加工湖北省协同创新中心,湖北 武汉 430023)
米渣蛋白双酶法制备工艺的研究
曾国强1,胡中泽1、2
(1.武汉轻工大学 食品科学与工程学院,湖北 武汉 430023;2.农产品加工湖北省协同创新中心,湖北 武汉 430023)
摘要:以淀粉糖生产过程中产生的副产物米渣为原料,先用正己烷进行脱脂,采用高温α-淀粉酶和纤维素酶双酶法对米渣进行酶解,提高蛋白质的纯度,研究了液固比、高温α-淀粉酶添加量、纤维素酶添加量、双酶酶解时间对蛋白质纯度的影响。在单因素试验的基础上,通过正交试验优化,确定了米渣蛋白的最佳提取工艺为:液固比8∶1,高温α-淀粉酶添加量300 U/mL,纤维素酶添加量110 U/g,高温α-淀粉酶作用时间1.5 h,纤维素酶作用时间2.5 h。在此条件下米渣蛋白的纯度为93.8%,得率为88.76%。
关键词:米渣蛋白;蛋白质纯度;酶添加量
1引言
米渣是以早籼稻或碎米为原料生产淀粉糖或发酵生产谷氨酸、柠檬酸、乳酸以及生化药品时,米粉高温液化或是糖化后的副产品。在以大米为原料的工业生产 (如发酵和淀粉糖等) 中一般只利用大米的淀粉部分, 副产品米渣中蛋白质含量为 40%以上,是纯大米的5—7倍[1]。米渣中的蛋白质虽然经过高温处理,但它仍保留了大米中蛋白质的部分性质,具有大米蛋白的很多优点,不含影响食物利用的毒性物质和酶阻碍物[2]。大米蛋白氨基酸组成平衡合理,与WHO/FAO推荐理想模式非常接近[3]。大米蛋白具有良好的氨基酸组成配比和低过敏性,消化率较高,是一种优良的植物蛋白[4]。在谷物蛋白中,大米蛋白的生物价(B.V.)和蛋白价(P.V.)均比其他蛋白质高[5]。长期以来,米渣以干粉的形式廉价卖给饲料厂,经济效益很低,米渣的增值利用一直是企业难以解决的难题[6]。
米渣中提取大米蛋白的方法主要有碱洗酸沉法、纤维素酶和酸洗法,碱酶两步法等[7]。强碱能使大米淀粉的紧密结构变得疏松,同时,碱液对蛋白质分子的次级键特别是氢键有破坏作用,从而促使淀粉和蛋白质分离,但是强碱的处理会引起大米蛋白理化性质的改变,降低其营养价值,产生有毒物质。另外,碱法还具有等电点要大量消耗酸、脱盐纯化难度大等问题[8]。酶法提取主要是采用一些蛋白酶对大米蛋白进行降解和修饰作用,使其变成可溶性多肽而被提取,酶法提取的米渣蛋白溶解性较好,但酶法提取率较低[9]。米渣中除蛋白质外,非蛋白成分主要有油脂、未经酶水解或水解不完全而残留的纤维素、淀粉和糊精等糖类物质。除杂法实质上是一个纯化的过程,从理论上分析具有更多的合理性。由于纤维素酶和淀粉酶的使用使提取成本有所提高,因此提取的工艺需要进一步优化,降低生产成本,提高产品的纯度和提取率[10]。本文采用排杂法制备米渣蛋白,先用正己烷脱脂,用高温α-淀粉酶酶解去除大部分淀粉,在用纤维素酶酶解去除大部分纤维素等多糖,用高温度水水洗米渣蛋白去除糊精、酶解产生的糖类物质和盐类物质,最后获得高纯度的米渣蛋白。
2材料与方法
2.1主要材料与试剂
米渣:(湖北仙源米业集团有限公司),高温α-淀粉酶:20 000 U/mL,( 江苏锐阳生物科技有限公司),纤维素酶:10 000 U/g,(阿拉丁(上海)试剂有限公司),正己烷、氢氧化钠、浓硫酸、浓盐酸、定氮指示剂、硫酸铜、硫酸钾:均为分析纯。
2.2主要设备和仪器
pH计FE20:(梅特勒—托利多仪器(上海)有限公司);85-2数显恒温磁力搅拌器:(江苏省金坛市荣华仪器制造有限公司);SHA-C2水浴恒温振荡器:(常州华冠仪器制造有限公司);k9840自动凯式定氮仪:(济南海能仪器股份有限公司);电热鼓风干燥箱:(上海一恒科学仪器有限公司);SHZ-III型循环水真空泵:(上海亚荣生化仪器厂)。
2.3试验方法
2.3.1米渣蛋白提取工艺流程
米渣→过20目筛→脱脂→抽滤→通风厨吹干→加入一定比例的水→用氢氧化钠溶液调节pH至6.0→90 ℃水浴10 min,摇速120 r/min→加入高温α-淀粉酶反应一段时间→冷却→调节pH值至4.5→55 ℃水浴10 min,摇速120 r/min→加入纤维素酶反应一段时间→抽滤→90 ℃水洗→抽滤→电热鼓风干燥箱内干燥并保存样品
2.3.2蛋白质含量测定方法
蛋白质:按GB5009.5-2010中的凯式定氮法进行测定,其中蛋白质系数为6.25。
2.3.3米渣脱脂
参照文献[1]的方法加以改进,称取20 g过20目筛的米渣,加入正己烷,料液比为1∶3,在60 ℃水浴恒温振荡器下脱脂4 h,摇速为120 r/min。
2.3.4单因素试验
单因素试验在液固比8∶1、高温α-淀粉酶添加量200 U/mL、纤维素酶添加量100 U/g、酶解时间:高温α-淀粉酶1 h与纤维素酶2 h的基础上,相应变换某因素的水平。液固比选择4∶1、6∶1、8∶1、10∶1,高温α-淀粉酶添加量选择100 U/mL、200 U/mL、300 U/mL、400 U/mL,纤维素酶添加量选择60 U/g、80 U/g、100 U/g、120 U/g,酶解时间选择高温α-淀粉酶1 h与纤维素酶1 h、高温α-淀粉酶1 h与纤维素酶2 h、高温α-淀粉酶2 h与纤维素酶3 h、高温α-淀粉酶2 h与纤维素酶4 h,按提取工艺流程提取,测样品的蛋白质纯度,考察各因素对蛋白质纯度的影响。
2.3.5正交试验
选取液固比、高温α-淀粉酶添加量、纤维素酶添加量、酶解时间4个因素,以样品的蛋白质纯度为指标,用 L9(34)正交实验表进行正交实验,因素水平表如表1所示。
3结果与分析
3.1单因素实验结果与分析
3.1.1液固比对米渣蛋白质纯度的影响
液固比影响酶与底物接触和碰撞的几率,与酶解工艺相关,因此会影响蛋白质纯度,液固比对蛋白质纯度的影响如图1所示。
表1正交试验因素水平表
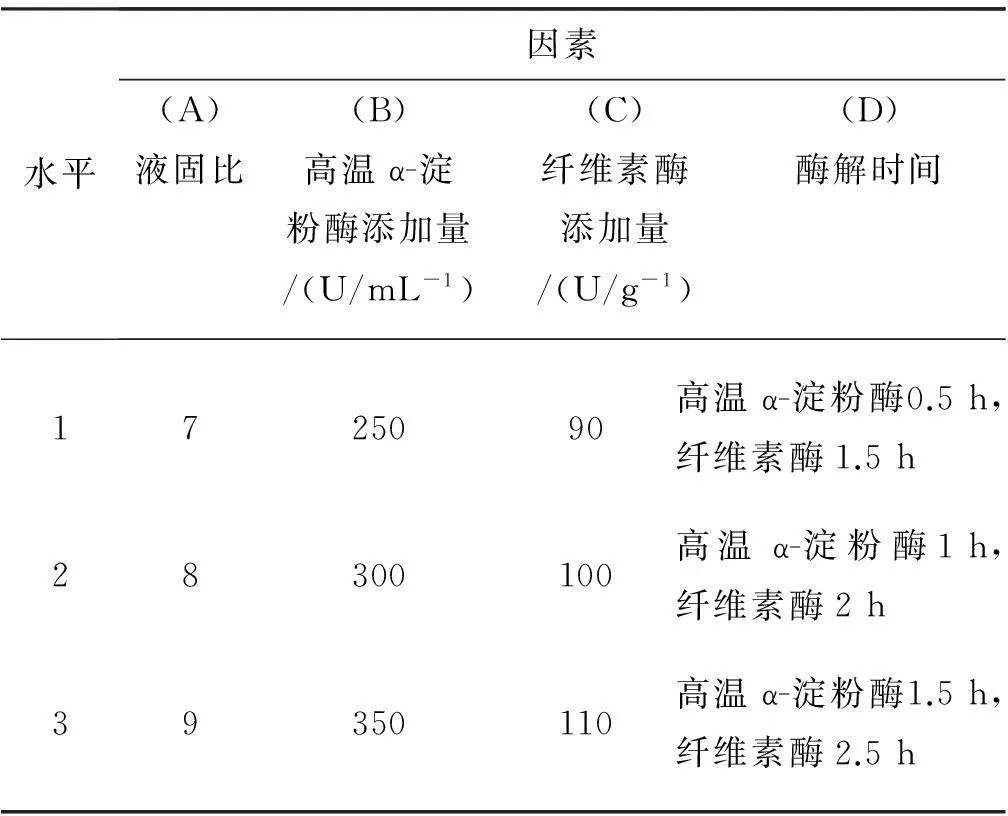
水平因素(A)液固比(B)高温α-淀粉酶添加量/(U/mL-1)(C)纤维素酶添加量/(U/g-1)(D)酶解时间1725090高温α-淀粉酶0.5h,纤维素酶1.5p8300100高温α-淀粉酶1h,纤维素酶2p9350110高温α-淀粉酶1.5h,纤维素酶2.5h
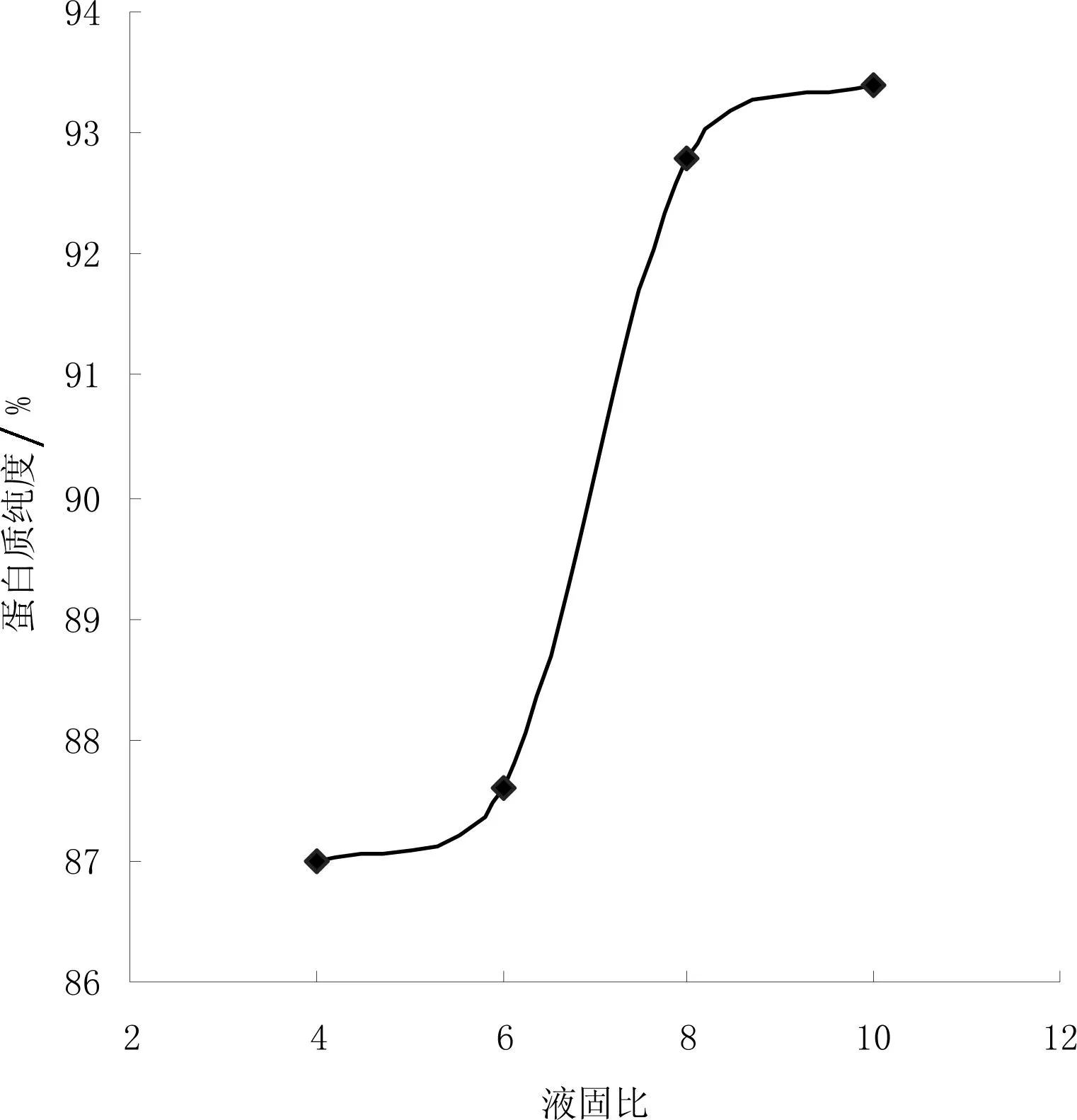
图1 液固比对蛋白质纯度的影响
从图1可看出,液固比增大,蛋白质纯度呈上升趋势,液固比从4到6时,蛋白质纯度不高,而且上升趋势趋于平稳。液固比从6到8,蛋白质纯度有明显的上升趋势,可能是液固比从6开始,酶与底物碰撞几率越来越大,因此蛋白质纯度越来越高,液固比从8开始,酶与底物接触的几率很大且趋于稳定,从后期液体处理量以及经济角度考虑,选择液固比8。
3.1.2高温α-淀粉酶添加量对蛋白质纯度的影响
高温α-淀粉酶添加量直接影响酶解工艺,影响去淀粉的程度和能力,从而影响蛋白质的纯度,高温α-淀粉酶添加量对蛋白质纯度的影响如图2所示。
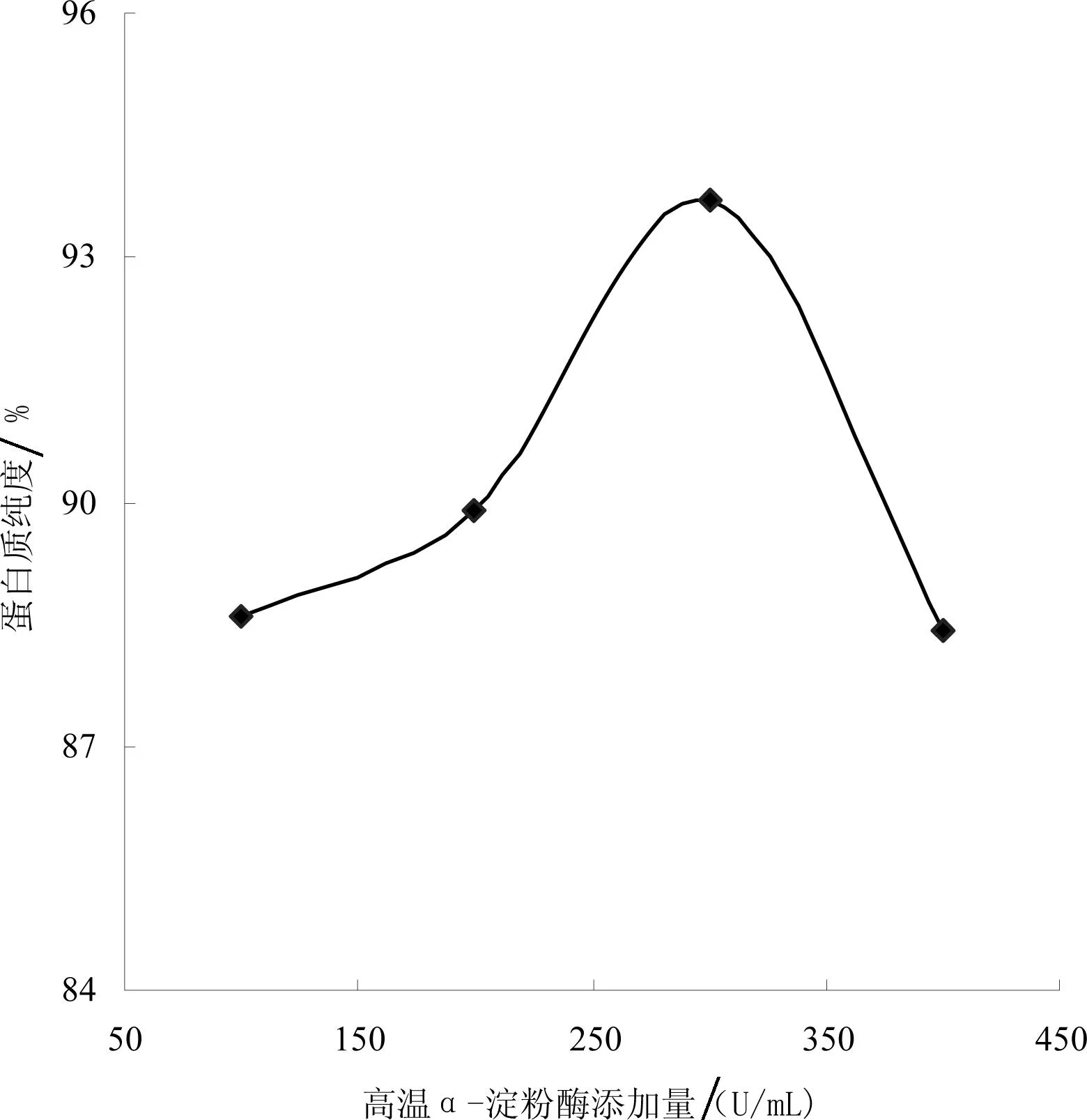
图2 高温α-淀粉酶添加量对蛋白质纯度的影响
从图2看出高温α-淀粉酶添加量从100 U/mL到300 U/mL时,蛋白质纯度呈上升趋势,从300 U/mL开始,蛋白质纯度呈下降趋势,可能是300 U/mL之前,高温α-淀粉酶添加量越大,酶与底物接触和碰撞的几率就越大,酶解越彻底,蛋白质纯度就越高,300 U/mL之后,高温α-淀粉酶添加量越大,反而抑制了酶与底物接触和碰撞,酶解不彻底,蛋白质纯度更低。因此选择高温α-淀粉酶添加量为300 U/mL。
3.1.3纤维素酶添加量对蛋白质纯度的影响
纤维素酶添加量影响去纤维素等多糖的程度和能力,从而影响蛋白质纯度,纤维素酶添加量对蛋白质纯度的影响如图3所示。
从图3可看出,随着纤维素酶添加量变化,蛋白质纯度呈波浪形变化,纤维素酶添加量从60 U/g到80 U/g,蛋白质纯度呈下降趋势。纤维素酶添加量从80 U/g到100 U/g,细胞壁破裂的较多,纤维素酶添加量越大,加速了纤维素等物质的酶解,蛋白质纯度呈上升趋势。纤维素酶添加量从100 U/g到120 U/g,随着纤维素酶添加量增加,反而抑制了酶与底物接触与碰撞。因此选择纤维素酶添加量为100 U/g。
3.1.4酶解时间对蛋白质纯度的影响
高温α-淀粉酶和纤维素酶的酶解时间影响去除淀粉和纤维素等物质的程度,从而影响蛋白质纯度,酶解时间对蛋白质纯度的影响如图4所示。
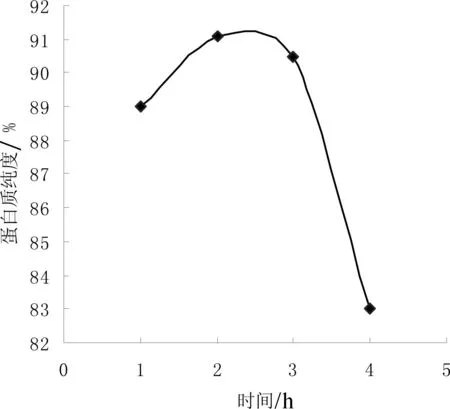
图4 酶解时间对蛋白质纯度的影响注:1表示高温α-淀粉酶1 h,纤维素酶1 h,2表示高温α-淀粉酶1 h,纤维素酶2 h,3表示高温α-淀粉酶2 h,纤维素酶3 h,4表示高温α-淀粉酶2 h,纤维素酶4 h
从图4可看出,从高温α-淀粉酶1 h、纤维素酶1 h到高温α-淀粉酶1 h、纤维素酶2 h,随着纤维素酶时间从1 h到2 h,可能是此时底物浓度较大,随着纤维素酶酶解时间增长,蛋白质纯度增加。从高温α-淀粉酶1 h、纤维素酶2 h到高温α-淀粉酶2 h、纤维素酶3 h,蛋白质纯度趋于平稳趋势。从高温α-淀粉酶2 h、纤维素酶3 h到高温α-淀粉酶2 h、纤维素酶4 h,蛋白质呈下降趋势,可能是因为随着纤维素酶的作用时间增长,酶活力下降。因此选择高温α-淀粉酶1 h,纤维素酶2 h。
3.2正交试验结果及分析
正交试验结果及分析如表2和表3所示。
表2正交试验结果
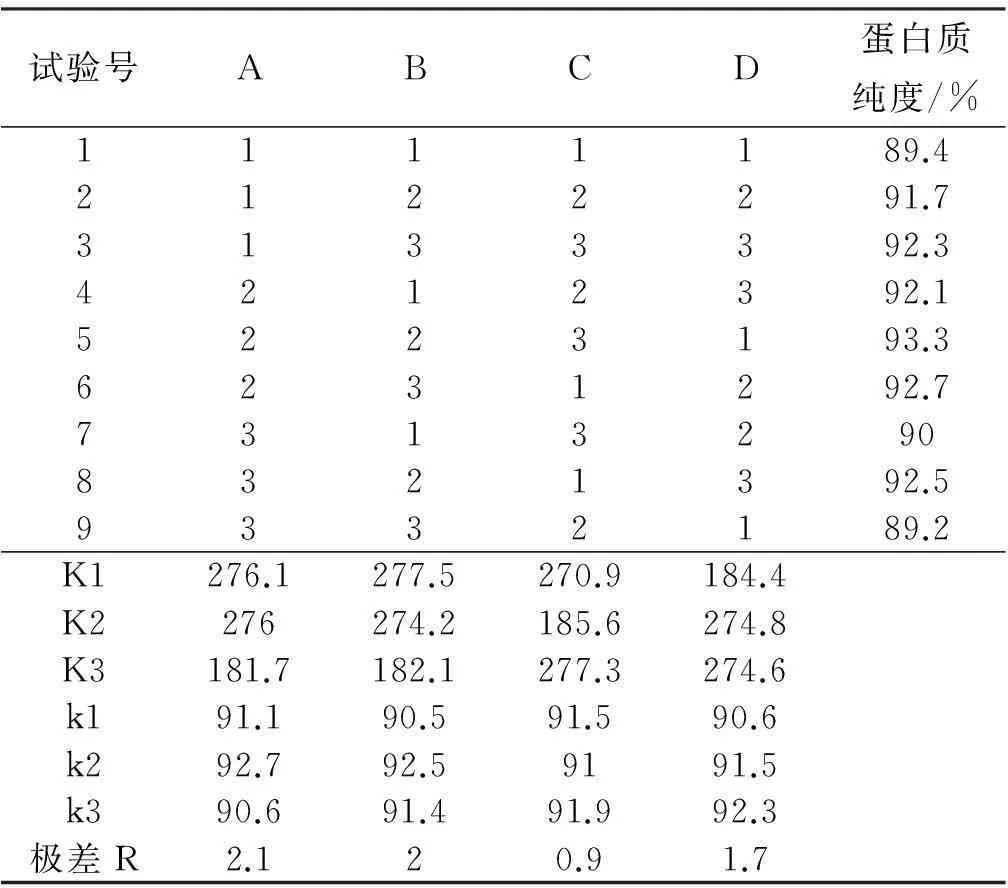
试验号ABCD蛋白质纯度/%1111189.42122291.73133392.34212392.15223193.36231292.773132908321392.59332189.2K1276.1277.5270.9184.4K2276274.2185.6274.8K3181.7182.1277.3274.6k191.190.591.590.6k292.792.59191.5k390.691.491.992.3极差R2.120.91.7
表3主体间效应的检验
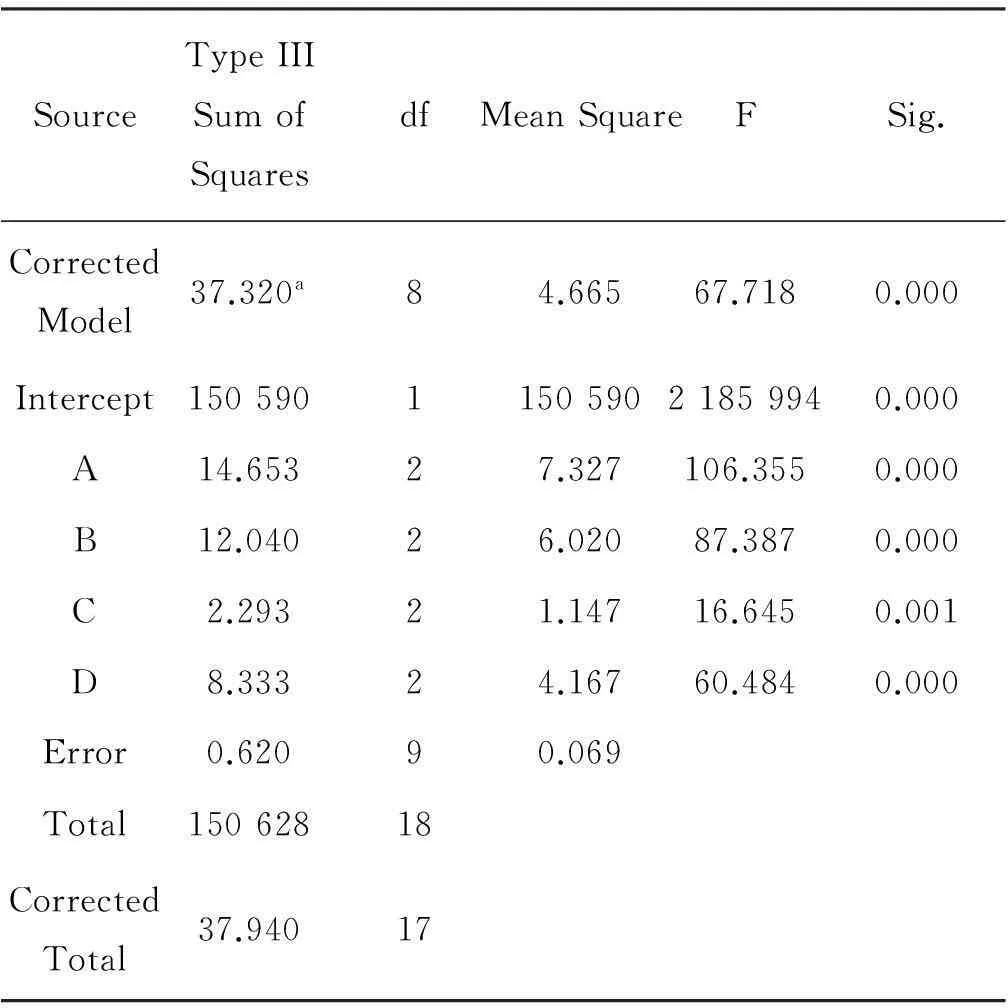
SourceTypeIIISumofSquaresdfMeanSquareFSig.CorrectedModel37.320a84.66567.7180.000Intercept150590115059021859940.000A14.65327.327106.3550.000B12.04026.02087.3870.000C2.29321.14716.6450.001D8.33324.16760.4840.000Error0.62090.069Total15062818CorrectedTotal37.94017
注:a表示R Squared 0.984(Adjusted 及squared=0.969)
根据表2的试验结果可知:蛋白质纯度影响因素由大到小依次是液固比A>高温α-淀粉酶添加量B>酶解时间D>纤维素酶C,由各因素的平均值可以比较出最优水平,并初步确定最佳组合为A2B2C3D3,,即液固比8∶1,高温α-淀粉酶添加量300 U/mL,纤维素酶添加量110 U/g,高温α-淀粉酶酶解时间1.5 h,纤维素酶酶解时间2.5 h。
根据表3的试验结果可知:液固比A、高温α-淀粉酶添加量B、纤维素酶C、酶解时间D对蛋白质纯度都有非常显著的影响,影响因素的主次顺序为液固比A>高温α-淀粉酶添加量B>酶解时间D>纤维素酶C,与极差法分析结果一致。对最优组合条件进行验证的结果:蛋白质纯度为93.8%,得率为88.76%。
3结论
采用双酶法制备米渣蛋白,蛋白质纯度和得率均较高,通过实验确定了米渣蛋白双酶法制备的最佳工艺为:液固比8∶1,高温α-淀粉酶添加量300 U/mL,纤维素酶添加量110 U/g,高温α-淀粉酶作用时间1.5 h,纤维素酶作用时间2.5 h。在此条件下米渣蛋白的纯度为93.8%,得率为88.76%。
参考文献:
[1]孙红星,庞雪凤,尤梦圆,等.从米渣中制备米渣蛋白的研究[J].农业机械,2013(23):50-53.
[2]李明,李赟高,高红艳.大米蛋白研究概述[J].粮食与油脂, 2006(8):3-5.
[3]姚惠源,周素梅,王立,等.米糠和米糠蛋白的开发利用[J].无锡轻工大学学报,2002,21(3):312-316.
[4]董欢欢,曹树稳,余燕影.异抗坏血酸钠改善米渣蛋白加工性能的研究[J].食品科学,2008,29(4):167-191.
[5]余兆海.稻谷综合利用[M].北京:中国农业出版社,1987:1-15.
[6]王威,曾里.中性蛋白酶提取米渣中大米蛋白的工艺研究[J].饲料工业,2008,29(6):35-37.
[7]黄军,熊华,李亮,等.米渣美杰工艺及其蛋白等电点测定[J].食品工业科技,2008,29(9):174-176.
[8]陈季旺,孙庆杰,夏文水,等.碱酶两步法制备大米蛋白的研究[J].农业工程学报,2006,22(5):169-172.
[9]李清筱,王修法.碱性蛋白酶提取米蛋白的功能特性研究[J].广西轻工业,2006,6:17-18.
[10]江漓,林洮,赵小虎,等.除杂和酶法相结合提取米渣蛋白[J].2011,36(12):179-186.
[11]任东东.米渣蛋白改性及在高蛋白粉末油脂中的应用[D].南昌:南昌大学,2008.
Study on double enzymatic preparation of rice residue protein
ZENGGuo-qiang1,HUZhong-ze1、2
(1.School of Food Science and Engineeing,Wuhan Polytechnic University,Wuhan 430023,China;2.Hubei Collaborative Innovation Center for Processing of Agricultural Products,Wuhan 430023,China)
Abstract:By product rice residue of starch sugar production process for raw materials, rice residue was first degreased with n-hexane, rice residue was hydrolysised at high temperature α- amylase and cellulase double enzyme, to improve the purity of protein.Effects of liquid-solid ratio, the amount of high-temperature α- amylase, cellulase dosage, double enzyme hydrolysis time on protein purity were studied. On the basis of single factor test, through orthogonal experiment, best rice residue protein good extraction process was determined: liquid to solid ratio of 8∶1, the amount of high-temperature α-amylase 300U/mL, cellulase enzyme dosage 110U/g, high temperature α- amylase time 1.5h, the cellulase reaction time 2.5h. Under these conditions, rice residue protein purity was 93.8%, yield was 88.76%.
Key words:rice residue protein;purity of protein;the amount of enzyme
中图分类号:TS 210.9
文献标识码:A
DOI:10.3969/j.issn.2095-7386.2016.01.022
文章编号:2095-7386(2016)01-0099-05
作者简介:曾国强(1991-),男,硕士研究生,E-mail:974401442@qq.com.
收稿日期:2015-11-30.
