珠子参多糖结构的初步表征和抗补体活性研究
2016-04-26杨涛,陈平
杨 涛,陈 平
(武汉轻工大学 生物与制药工程学院,湖北 武汉 430023)
珠子参多糖结构的初步表征和抗补体活性研究
杨涛,陈平
(武汉轻工大学 生物与制药工程学院,湖北 武汉 430023)
摘要:采用水提醇沉法提取珠子参根茎中的粗多糖,经活性炭脱除色素、Sevage法脱除蛋白质后得到珠子参精制多糖。苯酚硫酸法测定珠子参多糖的含量、高效液相色谱法(HPLC-GPC)测定其相对分子量、红外光谱法对珠子参多糖的结构进行分析并采用细胞溶血法对经典途径抗补体活性进行研究。结果:精制后的珠子参多糖含量约为92.4%,相对分子质量为1.25×10(4 )Da;红外光谱结果表明:珠子参多糖具有明显的多糖特征峰;抗补体实验表明珠子参多糖具有良好的抗补体活性。
关键词:珠子参多糖;结构表征;抗补体活性
1引言
珠子参是五加科(Araliaceae)人参属(Panax.L)植物珠子参PanaxjaponicusC. A. Mey.var.major(Burk.) C. Y. Wu et K. M. Feng的干燥根茎[1],历来就是被中国药典收载的一种名贵中药材。珠子参性味苦、甘、微寒,主治关节疼痛、虚劳咳嗽、气阴两虚、跌扑损伤等病症[2]。人参属植物的化学成分研究已经有一百多年的历史,皂苷类化合物一直以来就被公认是主要的活性物质,但是皂苷不能代表人参属植物的所有成分也不能全部阐明人参属植物的药理活性和临床疗效。随着现代生化药学和生物医学的发展,为了解释人参属植物的药理机制,越来越多的学者将研究重心转移到了多糖上,最近的信息显示多糖的医疗价值逐渐被人们发掘,竹节参、人参、西洋参等一大批中药的基础性研究取得进展,其中三七多糖、竹节参多糖、人参多糖[3-5]等都被证实具有很强的药理活性。珠子参同样为五加科人参属药用植物,根据同科属的药用植物具有较为一致的化学成分的规律,我们认为珠子参中的多糖成分同样具有较为重要的药用价值。但是目前国内对珠子参植物的研究主要集中在珠子参的栽培生产技术[6-7]和有效成分的提取工艺上[8-9],因此对珠子参多糖的系统性研究迫在眉睫。本实验拟为珠子参多糖的提取奠定基础;通过适当手段精制多糖和鉴定其结构并初步探讨珠子参多糖的抗补体活性。
2材料与方法
2.1仪器设备及材料
PB203-N型与XP205型电子天平(瑞士METTLER TOLED GROUP);Evolution 300紫外/可见光分光光度计(德国THERMO);LC-250超声波清洗机(济宁市中区鲁超仪器厂);YB-Z真空恒温干燥箱(天津药典标准仪器厂);Milli-Q Reference超纯水机(德国默克);Centrifuge 5804R冷冻高速离心机(德国EPPENDORF);R-210旋转蒸发仪(瑞士BUCHI);Waters e2695高效液相色谱仪(美国Waters 公司);xMark型酶标仪(美国Bio-RAD);2%绵羊红细胞、豚鼠血清均来自于武汉生物制品检定所。珠子参,购自云南。
2.2方法
2.2.1珠子参多糖的提取
本实验采用水提醇沉法[10]对珠子参药材中的多糖成分进行提取。具体实验操作步骤如下:用高速万能粉碎机将珠子参药材打磨成细粉然后用75%的乙醇,在85 °C下回流提取2次,每次2 h。快速离心去掉上层的有色物质、寡糖和一些小分子物质,将下层滤渣置于40 °C真空干燥箱中干燥尽量去掉其水分。将干燥好的药渣加入40倍量水(料液比1∶40),在90 °C下回流提取2次,每次3 h。高速离心机离心去掉不溶性滤渣后合并每一步的滤液,滤液在旋转蒸发仪上浓缩至15 mL左右加入无水乙醇,使其最终浓度达到80%,会发现有白色絮状沉淀生成。在4 °C冰箱中静置过夜,8 000 r/min下离心收集沉淀,冷冻干燥后即得珠子参粗多糖[11]。
2.2.2珠子参多糖的精制
将冷冻干燥得到的珠子参粗多糖溶于适量温水,将多糖溶液体积0.5%的活性炭加入溶液中一起加热回流15 min脱色,重复以上步骤一到两次离心弃渣。在脱色后的珠子参多糖溶液中加入适量的氯仿—正丁醇(4∶1)溶液,反复震荡15 min脱蛋白[12],重复以上步骤多次直到不产生沉淀为止。
2.2.3珠子参多糖含量的测定
珠子参多糖总糖含量的测定采用崔红华等[13]在测定人参多糖含量中建立的苯酚硫酸法。具体实验操作步骤如下:用容量瓶准确配制1.0 mg/mL的葡萄糖标准贮备溶液。1mL的刻度吸管分别量取0 mL,0.2 mL,0.4 mL,0.6 mL,0.8 mL,1.0 mL的葡萄糖标准贮备溶液到5 mL具塞试管中,加纯化水补至1.0 mL,使各管浓度依次为0 mg/mL, 0.02 mg/mL,0.04 mg/mL,0.06 mg/mL, 0.08 mg/mL,0.1 mg/mL。依次在每管中加入新配制好的0.5 mL 6% 的苯酚溶液和2.5 mL的浓硫酸,在振荡器上快速振荡摇匀,沸水浴15 min,在冰水中迅速冷却到室温,用空白管调零,用分光光度计在490 nm处分别测定其余各管的OD值。以葡萄糖的浓度为横坐标X(mg/mL),OD值为纵坐标Y绘制标准曲线。珠子参多糖含量的测定:将珠子参多糖准确稀释到标准曲线浓度的范围内,按以上的步骤操作,测量其OD值,将测好的OD值代入葡萄糖标准曲线中计算即可得到珠子参多糖的含量。
2.2.4珠子参多糖相对分子量的测定
采用凝胶渗透色谱法和示差折光检测器对提取的珠子参多糖的相对分子量进行测定。色谱柱为凝胶色谱柱TSKgel G4000SWxl,流动相为0.7%的Na2SO4,流速0.5 mL/min,柱温30 °C,示差折光检测器温度为35 °C。配制相对分子量不同的五种右旋葡聚糖酐标准物质溶液相继进样[14]。然后以标准分子量葡聚糖酐的保留时间为横轴,分子量的对数为纵轴,建立分子量对数和保留时间关系的线性曲线。在相同的色谱条件下,将浓度约为10 mg/mL珠子参多糖样品自动进样,记录其保留时间,用龙智达色谱工作站进行数据处理分析,即可计算出珠子参多糖样品的相对分子量。
2.2.5珠子参多糖的红外光谱分析
取大约2 mg干燥至恒重的珠子参多糖样品与200 mg的溴化钾粉末混匀后进行压片,用傅立叶红外光谱在4 000—400 cm-1波长范围内扫描,记录珠子参多糖的红外光谱图。
2.2.6珠子参多糖抗补体活性分析
采用细胞溶血法对珠子参多糖经典途径的抗补体活性[15]进行测定。通过本实验室前期的补体浓度测试,新鲜的豚鼠血清稀释80倍作为最低溶血浓度,与珠子参多糖样品充分混匀后加下列配置好的试剂,实验同时设置多糖对照组、补体组和全溶血组,见表1。 将上述混合完全的样品在37 °C下水浴60 min, 0 °C冰箱内冷却5 min,2 000r/min离心5 min ,取每管上清液在405 nm波长下用分光光度计测定OD值。珠子参多糖溶血活性的抑制率计算方法如下列公式:抑制率(%)= [(标准对照OD值-样品对照OD值)/标准对照OD值] × 100%,最后以珠子参多糖浓度作X轴,珠子参多糖的溶血抑制率为Y轴作图,计算珠子参多糖抗补体活性的CH50值。
表1补体经典途径溶血实验所加各成分体积/mL
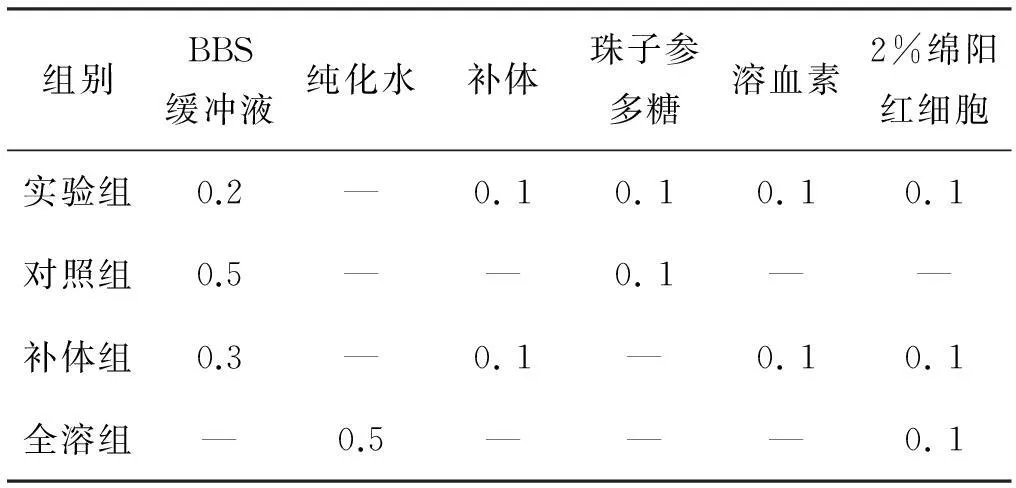
组别BBS缓冲液纯化水补体珠子参多糖溶血素2%绵阳红细胞实验组0.2—0.10.10.10.1对照组0.5——0.1——补体组0.3—0.1—0.10.1全溶组—0.5———0.1
3结果及讨论
3.1珠子参多糖含量的测定
珠子参多糖含量测定的标准曲线如图1所示。
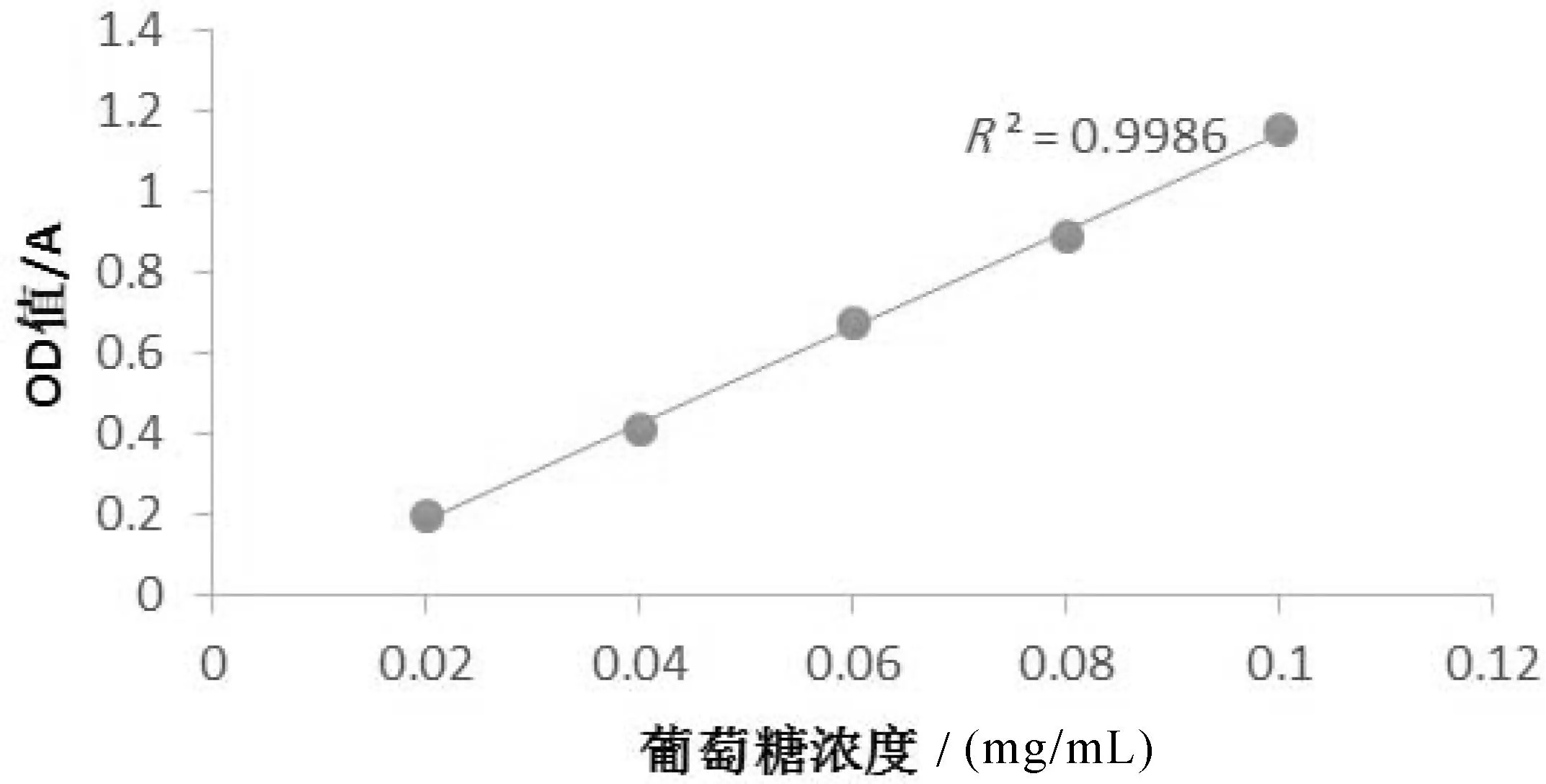
图1 葡萄糖标准曲线
该葡萄糖标准曲线的回归方程为Y=11.97X-0.0526,R2=0.9986,说明在0.02—0.1 mg/mL浓度范围内,葡萄糖的含量与吸收度值呈良好线性关系。根据此标准曲线计算精制后的珠子参多糖含量为98.6%。
3.2珠子参多糖相对分子量的测定
采用GPC专用软件绘制标准曲线,得线性回归方程:Log(Mw)=9.2379-0.2926tR,R2=0.9996。Mw为标样的已知重均分子量;tR为标样的保留时间。得到的珠子参多糖的HPGPC图谱见图2。通过GPC软件计算可得珠子参多糖的相对分子量为1.25×104Da。
3.3珠子参多糖红外分析
图3为珠子参多糖在红外区扫描获得的红外光谱图。
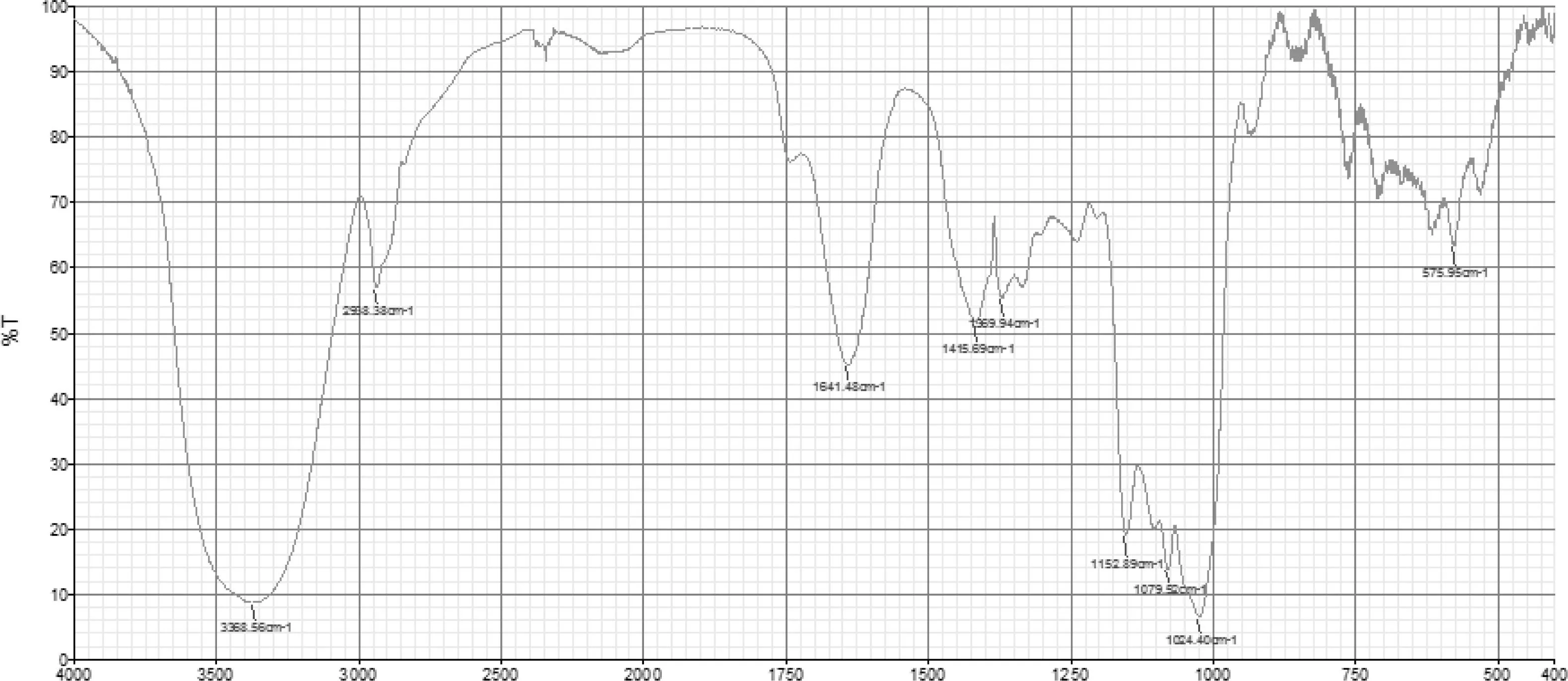
图3 珠子参多糖红外光谱图
从红外光谱图上可以看出,3 369 cm-1处强而宽的吸收峰为羟基(-OH)的振动吸收峰,2 938 cm-1处的吸收峰为亚甲基(C-H)的伸缩振动吸收峰,1 641 cm-1处吸收峰说明了C=O峰的存在。
3.4多糖抗补体活性研究
在抗补体实验中通常选取肝素钠作为阳性对照组[16],一种具有很强抗补体活性的物质。CH50值即在抗补体实验中能够使补体系统产生50%溶血的最低样品浓度。珠子参多糖的抗补体活性CH50为0.31 mg/mL,阳性对照肝素的抗补体活性CH50为0.24 mg/mL,表明珠子参多糖在经典途径中有较好的抗补体活性。
4结束语
利用水提醇沉法提取珠子参药材中的多糖有效成分,对其结构进行基本的表征并研究其药理活性。提取出的粗多糖含有多种杂质,先利用活性炭吸附法除去粗多糖中的色素,然后采用Sevage法脱除蛋白,至此得到纯度比较高的珠子参多糖组分。采用高效液相色谱法测得珠子参多糖的相对分子量为1.25 × 104Da,红外光谱表明其具有明显的多糖特征峰。经典途径抗补体活性实验证明,珠子参多糖具有很好的抗补体活性,这为珠子参多糖开发成抗补体药物提供了初步的科学依据,也为珠子参的扩大应用提供了新的途径。
参考文献:
[1]国家药典委员会.中华人民共和国药典 [M].北京:中国医药科技出版社, 2010:254-255.
[2]杜泽乡.药用植物学[M].北京:北京人民卫生出版社,2009:185.
[3]Wang R F, Chen P, Jia F, et al. Characterization and antioxidant activities of polysaccharides fromPanaxjaponicusC.A.Meyer[J]. Carbohydrate Polymers, 2012:88, 1402-1406.
[4]蔡瑛,黄青青,张朝贵,等.肠内营养加三七多糖对创伤大鼠CD4+/CD8+和白细胞介素-2水平的影响[J].中国危重病急救医学,2006,18(10):626-627.
[5]赵俊,吴宏,王亚平,等.人参多糖的化学与药理学研究进展[J].国外医学(中医中药分册),2004,26(2):79-81.
[6]刘万里,刘婷,何忠军,等.珠子参规范化栽培技术[J].陕西农业科学,2014,60(8):127-128.
[7]赵仁,赵毅,何双凌,等.珠子参生产技术标准操作规程(SOP)[J].中国现代中药,2014,16(7):556-560.
[8]袁菊丽,房方,张旋,等.珠子参多糖提取纯化工艺研究[J].河南中医,2007,27(12):73-74.
[9]高培红,曹军毅,宋小妹,等.正交实验法优选珠子参总皂苷的提取工艺[J].陕西中医学院学报,2006,29(2):66-68.
[10]卢艳花.中药有效成分提取分离技术[M].北京:化学工业出版社,2005:58.
[11]陈茂华.珠子参多糖提取及抗肝癌作用的实验研究[D].宜昌:三峡大学,2008:10.
[12]张娟娟,卢燕,陈道峰.鱼腥草抗补体活性多糖的制备工艺研究[J].中国中药杂志,2010,37(14):2071.
[13]崔红华,李超英,张大方,等.用苯酚—硫酸法测定人参多糖含量的研究[J].中国中医药信息杂志, 1999,6(2):24.
[14]蔡亚平,赵蕊,朱丹,等.HPGPC法对五种中药多糖的分子量分布测定和种类考察[J].牡丹江医学院学报,2011,32(1):28-30.
[15]倪付勇,刘露,宋亚玲,等.金银花中抗补体活性酚酸类成分的研究[J].中国中药杂志,2015(02):269-274.
[16]吴彦,魏和平,王建波。半枝莲多糖B3-PS2分离纯化及抗补体活性研究[J].药学学报,2009(06):615-619.
Preliminary characterization and anti-complementary activity of polysaccharides from Rhizoma Panacis Majoris
YANGTao,CHENPing
(School of Biology and Pharmaceutical Engineering ,Wuhan Polytechnic University, Wuhan 430023,China)
Abstract:Preliminary characterization and anti-complementary activity of polysaccharides from Rhizoma Panacis Majoris were studied. Crude polysaccharides from Rhizoma Panacis Majoris was obtained by water extraction and ethanol precipitation. Then the crude polysaccharides was depurated by the following method: Decolorized by active carbon; removed protein by Sevage way. The total carbohydrate content was determined by the Phenol-Sulfuric acid method, with D-glucose as the standard; the molecular weight (MW) was determined by HPLC-GPC; chemical structure was investigated by FT-IR. The anti-complementary activity was evaluated with the hemolysis assay. The results showed that the total carbohydrate content was 92.4%, the molecular weight (MW) was 1.25 × 104 Da, FT-IR spectra confirmed obvious characteristic peaks of polysaccharides. The hemolysis assay was exhibited that polysaccharides from Rhizoma Panacis Majoris showed anti-complementary activity.
Key words:Rhizoma Panacis Majoris; structure characterization; anti-complementary activity
中图分类号:Q 539
文献标识码:A
DOI:10.3969/j.issn.2095-7386.2016.01.006
文章编号:2095-7386(2016)01-0026-04
基金项目:国家自然科学基金(81274023).
作者简介:杨涛(1990-),男 硕士研究生,E-mail:shuangfentao@iCloud.com.通信作者:陈平(1958-),女 教授,E-mail:chenpingvip24@163.com.
收稿日期:2015-12-08.
