Vogt-小柳原田综合征患者血浆中microRNA表达谱的初步研究
2016-04-25张新桥
张新桥,王 红
·实验论著·
Vogt-小柳原田综合征患者血浆中microRNA表达谱的初步研究
张新桥,王红
Preliminary research on plasma microRNA profiling in patients with Vogt-Koyanagi-Harada syndrome
Xin-Qiao Zhang, Hong Wang
Foundation item:Natural Science Foundation of Bejing (No.7122042)
Beijing Ophthalmology & Visual Sciences Key Lab,Beijing Tongren Eye Center,Beijing Tongren Hospital,Capital Medical University,Beijing 100730,China
Correspondence to:Hong Wang. Beijing Ophthalmology & Visual Sciences Key Lab,Beijing Tongren Eye Center,Beijing Tongren Hospital,Capital Medical University,Beijing 100730,China. wanghongyk@sina.com
Received:2016-01-12Accepted:2016-03-15
Abstract
•AIM:To explore the differences of expression pattern of microRNA(miRNA) in plasma from Vogt-Koyanagi-Harada(VKH) syndrome patients and normal controls, searching for diseases-relating biomarkers.
•METHODS:Blood samples from 10 cases of VKH patients and 10 cases of normal control were collected to extracted total RNA in plasma. The cDNA was synthesized by reverse transcription, and then underwent real time PCR in a 96 well plate from miRCURY LNATMUniversal RT microRNA PCR panels .Original Ct value was obtained. The Exiqon GenEx qPCR analysis software was used to analyse the original data and the differential miRNAs was obtained and analyzed by bioinformatics.
•RESULTS:The panels contained 179 miRNAs classes from human individuals. In comparison with the healthy controls,there were 20 differential miRNAs, in which 12 miRNAs were up regulated and 8 miRNA were down regulated(allP<0.05). These microRNAs participated in the regulation of various signaling pathways.
•CONCLUSION:The VKH patients and healthy controls have significantly different expression profiles of microRNA.The differential expression of microRNA may be involved in the pathogenesis of VKH.
KEYWORDS:•Vogt-Koyanagi-Harada sydrome;microRNA;plasma;profiling
Citation:Zhang XQ, Wang H.Preliminary research on plasma microRNA profiling in patients with Vogt-Koyanagi-Harada syndrome.GuojiYankeZazhi(IntEyeSci) 2016;16(4):625-629
摘要
关键词:Vogt-小柳原田综合征;microRNA;血浆;表达差异
引用:张新桥,王红.Vogt-小柳原田综合征患者血浆中microRNA表达谱的初步研究.国际眼科杂志2016;16(4):625-629
0引言
Vogt-小柳原田综合征(Vogt-Koyanagi-Harada,VKH)是一种累积全身多系统的自身免疫性疾病,主要以双侧肉芽肿性全葡萄膜炎为特征,常伴有听力障碍、脑膜刺激征、毛发变白或脱落、白癜风[1],是国内最常见的葡萄膜炎类型之一,其发病快、进展快、反复发作、致盲率高[2]。截至目前,有关VKH的病因与发病机制尚不完全清楚[3]。microRNA(简称miRNA)是一类新发现、短序列、非编码的小分子RNA,参与基因组转录后水平的调节。miRNA在转录后水平通过与mRNA不完全结合调控基因表达,从而在真核生物基因调控过程中起到重要的作用[4],截至目前有超过1 000个人类微小RNA调控人类约1/3的基因表达。miRNA参与固有和适应免疫应答,有越来越多的证据提示miRNA能够成为VKH患者新的生物标记物以及治疗的靶点,但miRNAs在VKH发生发展过程中的确切作用迄今尚不明确。因此本文应用miRNAs PCR芯片技术检测VKH患者与正常人群的miRNAs差异表达谱,从而探讨miRNAs在VKH发病中的意义。
1材料和方法
1.1材料
1.1.1主要试剂与设备miRCURY LNATMUniversal RT microRNA PCR芯片及配套试剂,丹麦Exiqon公司;miRNA抽提试剂The miRCURYTMRNA Isolation Kit提取总RNA,丹麦Exiqon公司。美国Bio-Rad iQ5 实时定量PCR仪。
1.1.2实验对象选取10例发病期Vogt-小柳原田综合征患者,排除其他免疫性疾病及全身其他系统疾病,VKH诊断标准采取国际公认诊断标准。对照组选取体检中心体检正常人群10例。所有人员均知情同意并签署知情同意书。
1.2方法
1.2.1血浆标本收集与miRNA提取应用EDTA-K2抗凝管采集静脉血8mL,3000r/min离心10min,将上层血浆分装至离心管中。 应用The miRCURYTMRNA Isolation Kit血浆miRNA抽提试剂,抽提总miRNA。
1.2.2 RNA质量检测为了确认RNA提取效果,RNA提取时加入MS2 RNA(Roche,10165948001,937.5ng),通过OD值测定计算回收率,根据检测结果选取回收率>50%样本。另外在RNA提取时加入RNA Spike-in kit(Exiqon,E23203)中的control RNA UniSp2、UniSp4、UniSp5 spike-in Template,在 microRNA QC PCR Panel(Exiqon,E203887)中检测提取质量。
1.2.3 PCR芯片检测与分析根据Exiqon公司提供的标准操作流程进行cDNA合成和实时定量PCR,利用配套软件Exiqon GenEx qPCR analysis software对VKH组与健康对照组miRNA进行差异分析,采用t检验取P<0.05及差异倍数>2或<0.5为差异有统计学意义。
1.2.4生物信息学分析通过搜索TargetScan,Miranda数据库得到差异miRNA调控的所有靶基因;随后通过对差异miRNA对应靶基因进行GO显著性功能分析,得到具有显著性、低误判率、靶向性的GO功能集以及对应的靶基因;同样为了进一步阐明异常表达的miRNA参与的信号通路,我们对差异miRNA对应的靶基因进行KEGG Pathway显著性分析,得到具有显著性、低误判率、靶向性的KEGG Pathway以及对应的靶基因;随后通过对靶基因的显著性GO功能集分析和显著性Pathway分析,将GO和Pathway所包含的靶基因取交集;最后根据以上步骤得到的靶基因构建差异miRNA与靶基因的调控网络,得到网络中起核心调控作用的miRNA和被miRNA调控的关键靶基因。
2结果
2.1分光光度计检测结果分光光度计检测样品液量为50μL,检测样品浓度11.8~18.5ng/μL不等,RNA总量为590~925ng不等,回收率59%~92.5%不等,均>50%,可取。
2.2 microRNA QC PCR Panel检测结果QC PCR Panel中包括多数组织中稳定表达的hsa-miR-103、hsa-miR-191、hsa-miR-23a;在红细胞中特异的hsa-miR-451(用于判定血浆样品的溶血情况);以及在RNA提取时添加的合成RNAUniSp2、UniSp4、UniSp5(用于判定RNA提取效率)。经检测所有样本hsa-miR-103、hsa-miR-191、hsa-miR-23a均稳定表达;各样品ΔCq(miR-23a~miR-451a)差异在7以内,符合样品无溶血的判定标准;各样品间UniSp2、UniSp4、UniSp5差异均在3以内,符合样品判定标准。
表1VKH患者血浆中差异表达的miRNA

miRNAP倍数上调miRNA Hsa-miR-424-5p0.0025.4 Hsa-miR-106b-3p0.0024.2 Hsa-miR-629-5p0.00034.5 Hsa-miR-133a-3p0.00045.2 Hsa-miR-130b-3p0.00045.2 Hsa-miR-200c-3p0.0016.2 Hsa-miR-376a-3p0.0054.9 Hsa-miR-376c-3p0.0078.1 Hsa-miR-374a-5p0.019.9 Hsa-miR-126-5p0.026.6 Hsa-miR-33a-5p0.033.4 Hsa-miR-10b-5p0.045.2下调miRNA Hsa-miR-324-3p0.0020.32 Hsa-miR-365a-3p0.0010.20 Hsa-miR-423-5p0.010.41 Hsa-miR-382-5p0.00050.34 Hsa-miR-584-5p0.0020.22 Hsa-miR-877-5p0.0070.19 Hsa-miR-93-5p0.020.49 Hsa-miR-146a-5p0.030.24
表220个异常表达的microRNA预测的靶基因数量

MicroRNA预测靶基因数模型hsa-miR-106b-3p174uphsa-miR-10b-5p261uphsa-miR-126-5p25uphsa-miR-130b-3p617uphsa-miR-133a-3p620uphsa-miR-200c-3p466uphsa-miR-33a-5p387uphsa-miR-374a-5p648uphsa-miR-376c-3p238uphsa-miR-424-5p1212uphsa-miR-629-5p184uphsa-miR-146a-5p213downhsa-miR-324-3p326downhsa-miR-365a-3p119downhsa-miR-382-5p206downhsa-miR-423-5p174downhsa-miR-584-5p142downhsa-miR-877-5p115downhsa-miR-93-5p1174down
2.3 VKH患者血浆差异表达的miRNA经检测发现VKH患者与正常对照相比有12个miRNA表达上调,有8个miRNA表达下调(表1)。
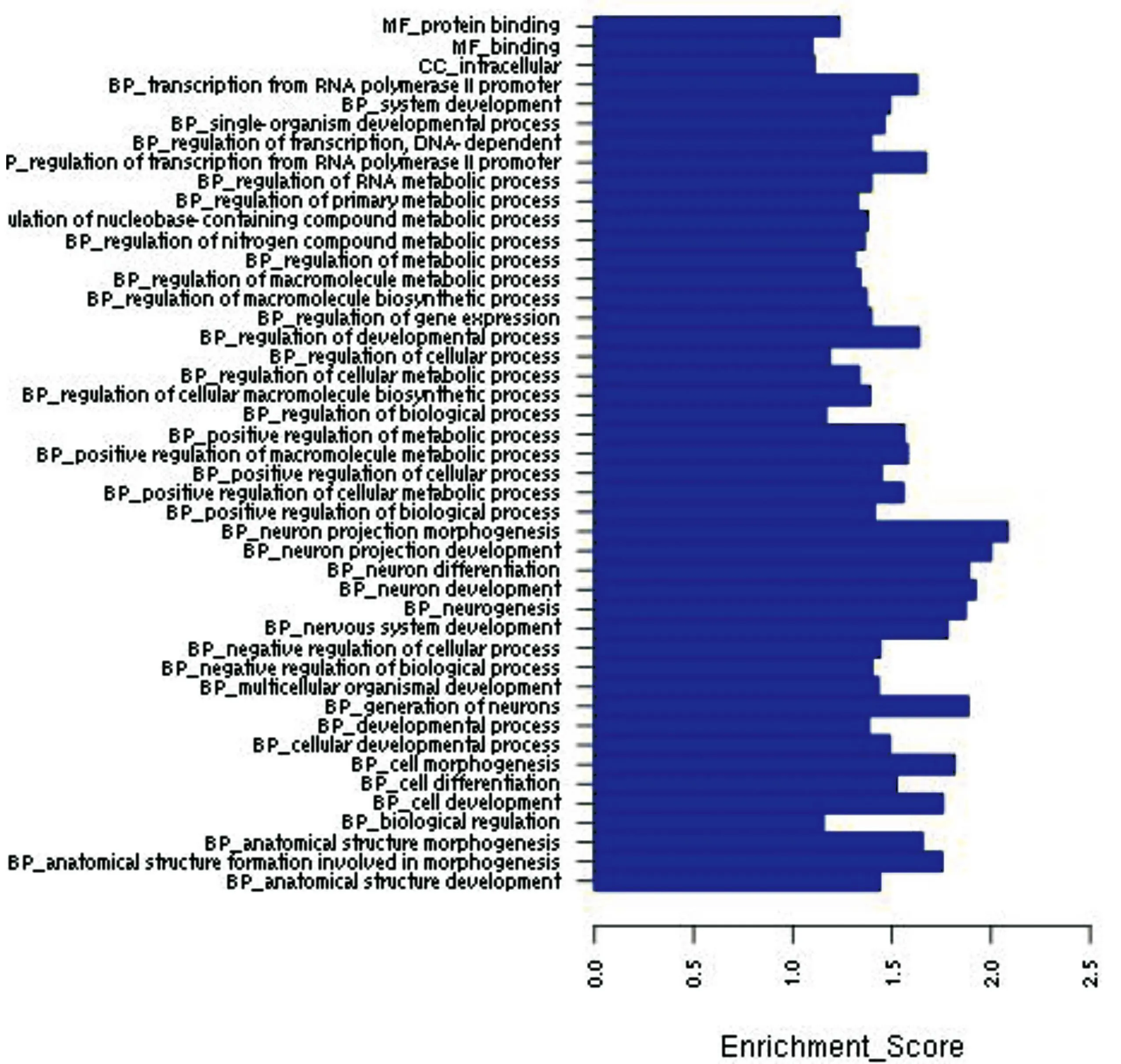
图1上调microRNA靶基因显著性的GO分析结果。
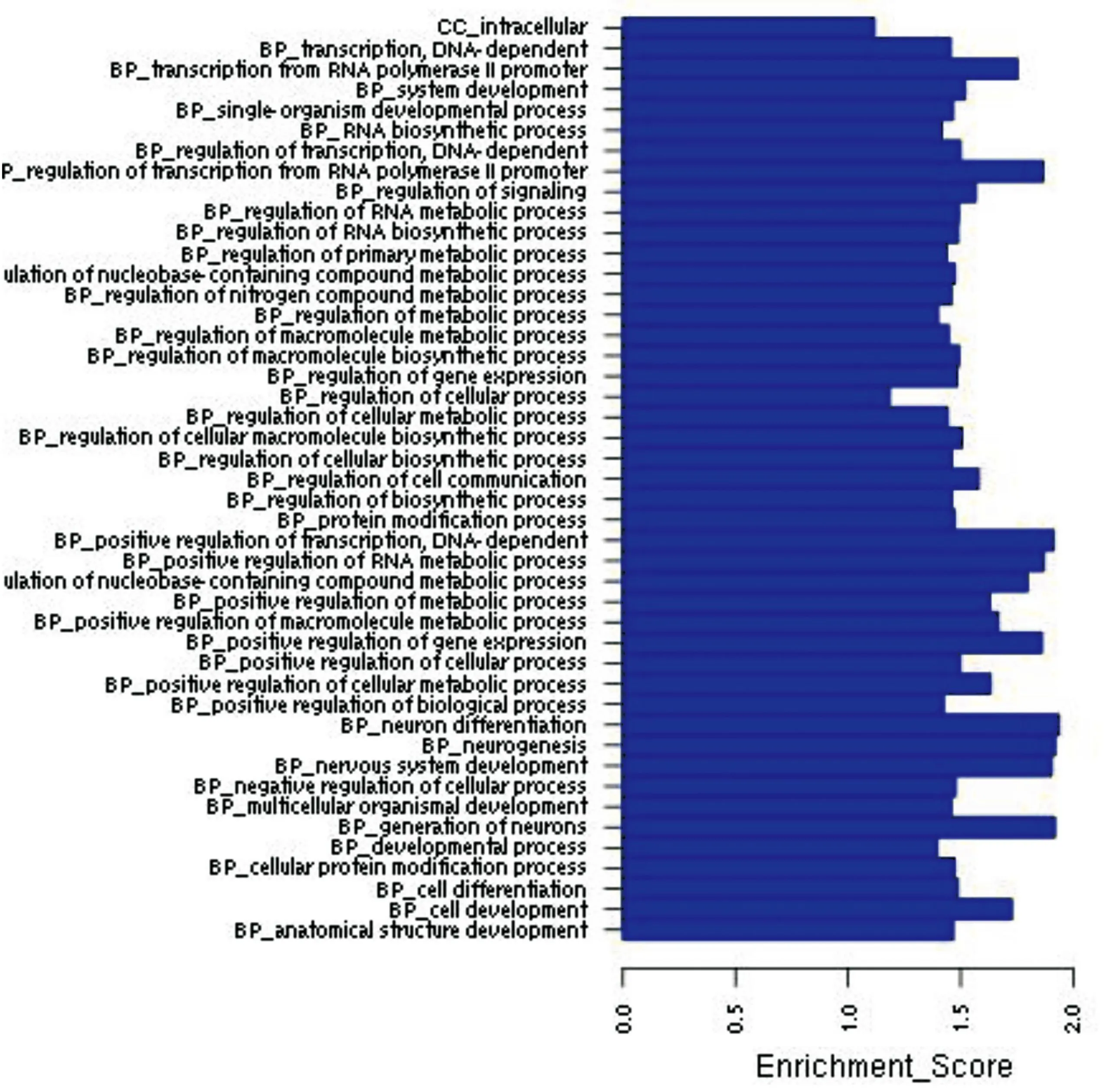
图2下调microRNA靶基因显著性的GO分析结果。
2.4差异表达的miRNA潜在靶基因生物信息学分析20个异常表达的microRNA在TargetScan,Miranda数据库中共同的预测靶基因共得到7 415个,其中表达上调microRNA中靶基因最多的为sa-miR-424-5p靶基因数量最多,靶基因预测数量最少的为hsa-miR-126-5p;表达下调的microRNA中靶基因预测数量最多的为hsa-miR-93-5p,最少的为hsa-miR-877-5p(表2)。
2.5差异表达的microRNA的GO及KEGG分析结果基于Gene Ontology数据库对差异表达microRNA进行GO显著性分析,得到具有显著性、低误判率、靶向性的GO功能集以及对应的靶基因;基于KEGG数据库对差异表达的microRNA进行KEGG Pathway显著性分析,筛选GO、KEGG显著性的标准是P<0.001,而假阳性率<0.05。
Vogt-小柳原田综合征是一种自身免疫性疾病,那么我们根据图1~2排除不相关的基因功能如神经发育、神经传导后发现,差异表达的miRNA的显著功能分析结果主要包括细胞分化、细胞周期、信号传导等。根据图3得出上调miRNA具有显著性的信号传导通路包括TGF-β通路、Wnt信号通路、MAPK信号通路、T细胞信号通路、P53信号通路等;如图4得出下调miRNA具有显著性的信号传导通路主要包括MAPK信号通路、TGF-β通路、mTOR信号通路、Wnt信号通路、TNF信号通路等。通过图5差异表达miRNA与靶基因调控网络图,可以得出处于核心位置的miRNA与靶基因,其中miR-106b、miR-130b等处于较为核心位置。
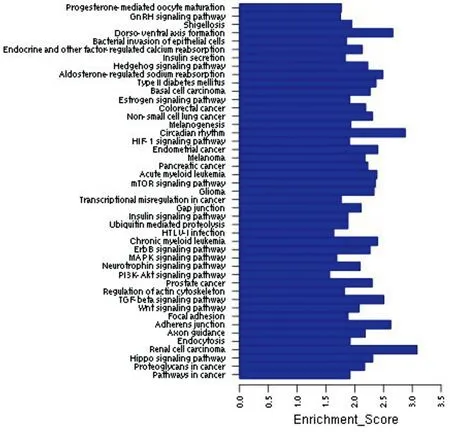
图3上调microRNA调控的显著性信号通路分析。
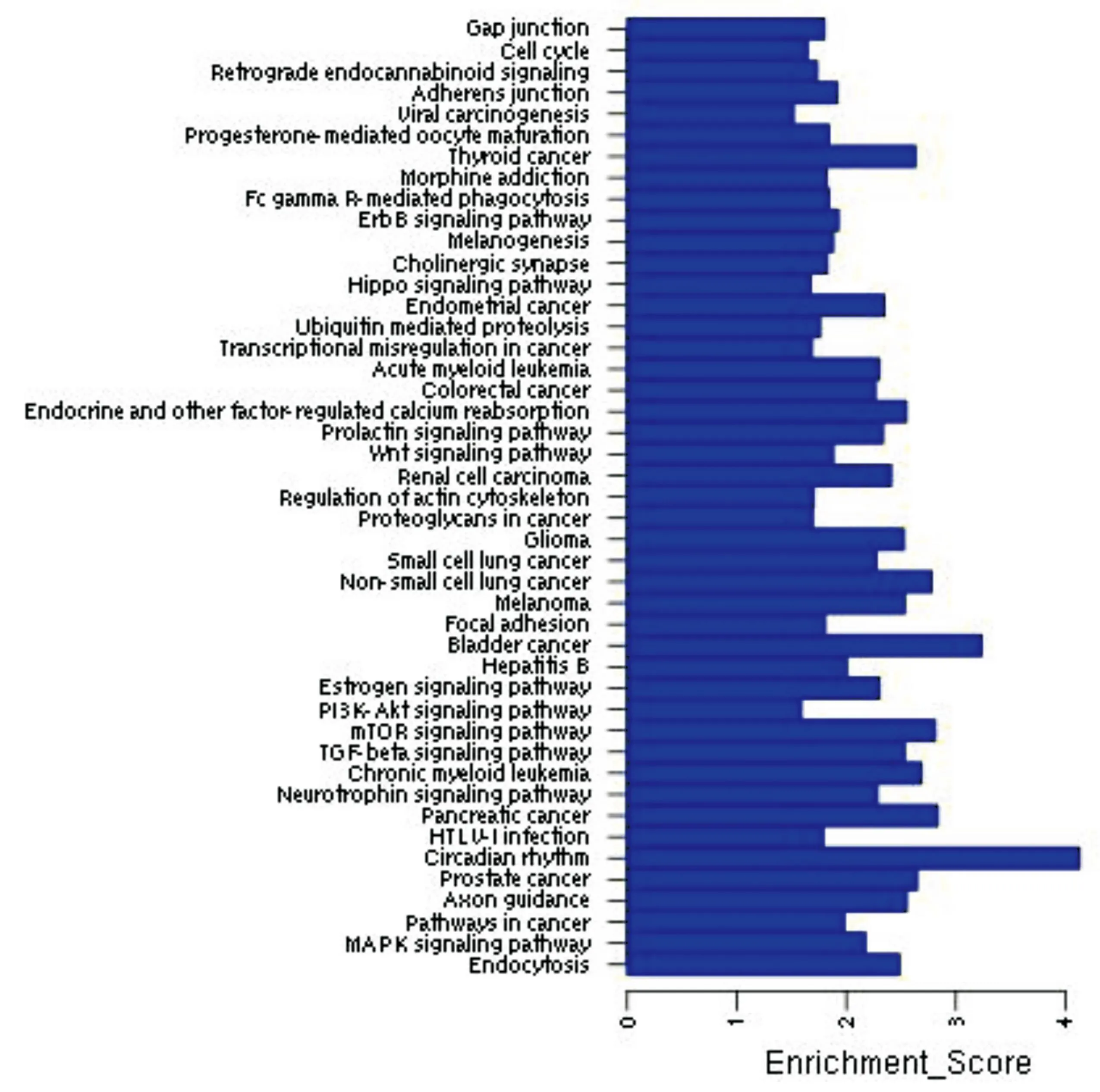
图4下调microRNA调控的显著性信号通路分析。
3讨论
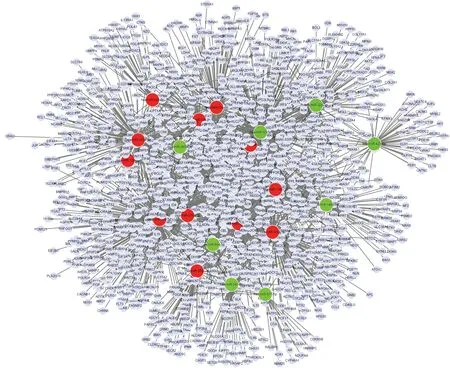
图5上调和下调microRNA与靶基因的调控网络。
microRNA是一类新发现的、约22个核苷酸长度的单链RNA,在动植物转录后水平参与基因表达调控,miRNA通过与靶分子mRNA碱基配对降解mRNA或阻碍其翻译[4]。有研究表明miRNA在免疫细胞中广泛表达,并影响免疫反应的各个阶段;miRNA在免疫系统性疾病发病中起重要作用[5]。一系列研究表明,miRNA在免疫系统中发挥着重要的调节作用,能调控多种免疫过程,包括粒细胞发育、T和B细胞的成熟与分化、抗原递呈过程、Toll样受体(Toll-like receptors,TLR)的信号级联、细胞因子的产生和T细胞受体信号等[6]。循环miRNA可丰富而稳定地存在于体液中,因此在疾病状态下,循环miRNA的表达谱有特征性的改变,因此循环中miRNA可作为一种无创伤性生物标志物,有助于疾病的预测、诊断和预后。研究表面特异表达的miRNA可能与自身免疫性葡萄膜炎的发病有关。Guo[7]应用微阵列芯片技术发现实验性自身免疫性葡萄膜炎小鼠与正常小鼠相比PBMCs有36个miRNAs上调、31个miRNAs下调,且应用生物信息分析发现这些miRNAs可能通过T细胞受体信号通路、B细胞信号通路、Toll受体信号通路等免疫信号通路参与发病。Qi[8]发现活动期Behcet病患者CD4+T细胞中miR-23b显著低表达,进一步研究发现转染了miR-23b的CD4+T中Notch受体胞内区(Notch intracellular domain,NICD)被抑制以及炎症因子IL-17、IFN-γ呈显著低表达,则Behcet病患者低表达的miR-23b能够激活Notch信号途径并进而促进Th17细胞分化。
本研究应用PCR芯片技术检测VKH患者血浆中miRNA表达谱,与正常对照相比有12个miRNAs上调,有8个miRNAs下调。有研究发现[9],miR-424-5p参与肝细胞癌的转移与发展。Jingushi[10]研究发现mi-629通过TGF-β信号通路加速肾细胞癌的发展,而本实验中上调和下调表达的miRNA均部分通过TGF-β信号通路影响VKH的发病。有研究表明[11],miR-106b通过影响上皮细胞自噬功能参与炎症性肠道疾病的发病。De Santis[12]发现miR-106b通过调控TGF-β信号通路参与多发性硬化的发病,而提示本研究中异常表达的miR-106b抑或通过某种途径调控TGF-β信号通路而影响VKH的发病。Wang[13]应用微阵列芯片等技术发现上调表达的miR-130b-3p与早期狼疮性肾炎的蛋白尿量与上皮间质转化有关,提示miR-130b-3p参与早期狼疮性肾炎患者的发病与发展,提示我们异常表达miR-130b-3p亦或通过某种途径参与VKH发病。miR-126通过核转录KappaB信号通路参与炎症性肠道疾病的发病[11],又有文章提示miR-126参与系统性红斑狼疮的发病[14],这亦提示我们miR-126参与多种自身免疫性疾病的发病,也就证实本文中VKH患者血浆中异常表达的miR-126通过某种途径参与其发病。miR-93通过抑制Th17细胞的分化参与多种自身免疫疾病的发生、发展,而Th17细胞已被证实参与小柳原田综合症的发病[15]。Watanabe[16]研究发现,自身免疫性葡萄膜视网膜炎小鼠模型的视网膜中阻止miR-146a表达水平升高,且与疾病的临床表现程度评分以及IL-1/MCP-1比例呈正相关,而本文miR-146a在VKH患者血浆中表达水平降低可能与miRNA的组织特异性以及发病机制不同有关;类风湿关节炎[17]、系统性红斑狼疮[18]患者miR-146a均有不同程度的表达水平降低,通过某种机制参与其发病。
Vogt-小柳原田综合征的具体发病机制尚不明确,miRNA与VKH发病的关系亦不清楚,miRNA已被证实参与多种疾病如癌症、自身免疫疾病的发病,本文应用Exiqon公司的PCR芯片筛选出VKH患者与健康人差异的miRNA表达谱,通过生物信息分析得出差异表达miRNAs可能通过TGF-β等通路参与发病。本研究为进一步研究VKH的发病提供了依据, 但差异表达 miRNA 的调控机制尚不明确,仍需进一步研究。
参考文献
1 Pan D,Hirose T.Vogt-Koyanagi-Harada syndrome:review of clinical features.SeminOphthalmol2011;26(4-5):312-315
2杨培增.关注我国葡萄膜炎的病因和类型的变化.中华眼科杂志 2008;44(10):865-866
3 Burkholder BM. Vogt-Koyanagi-Harada disease.CurrOpinOphthalmol2015;26(6):506-511
4 Bartel DP. MicroRNAs:genomics, biogenesis, mechanism, and function.Cell2004;116(2):281-297
5 O’Connell RM. Physiological and pathological roles for microRNAs in the immune system.NatRevImmunol2010;10(2):111-122
6 Pauley KM, Cha S, Chan EK. MicroRNA in autoimmunity and autoimmune diseases.JAutoimmun2009;32(3-4):189-194
7 Guo D. Characterization of microRNA expression profiling in peripheral blood lymphocytes in rats with experimental autoimmune uveitis.InflammRes2015;64(9):683-696
8 Qi J. Increased Notch pathway activation in Behcet’s disease.Rheumatology(Oxford) 2014;53(5):810-820
9 Zhang Y. MiR-424-5p reversed epithelial-mesenchymal transition of anchorage-independent HCC cells by directly targeting ICAT and suppressed HCC progression.SciRep2014;4:6248
10 Jingushi K. miR-629 Targets TRIM33 to Promote TGFbeta/Smad Signaling and Metastatic Phenotypes in ccRCC.MolCancerRes2015;13(3):565-574
11 Chen WX,Ren LH, Shi RH. Implication of miRNAs for inflammatory bowel disease treatment:Systematic review.WorldJGastrointestPathophysiol2014;5(2):63-70
12 De Santis G. Altered miRNA expression in T regulatory cells in course of multiple sclerosis.JNeuroimmunol2010;226(1-2):165-171
13 Wang W. Up-regulation of Serum MiR-130b-3p Level is Associated with Renal Damage in Early Lupus Nephritis.SciRep2015;5:12644
14 Jeffries MA,Sawalha AH. Epigenetics in systemic lupus erythematosus:leading the way for specific therapeutic agents.IntJClinRheumtol2011;6(4):423-439
15 Honardoost MA. Integrative computational mRNA-miRNA interaction analyses of the autoimmune-deregulated miRNAs and well-known Th17 differentiation regulators:An attempt to discover new potential miRNAs involved in Th17 differentiation.Gene2015;572(2):153-162
16 Watanabe T. MicroRNAs in retina during development of experimental autoimmune uveoretinitis in rats.BrJOphthalmol2016;100(3):425-431
17 Zhou Q. Decreased expression of miR-146a and miR-155 contributes to an abnormal Treg phenotype in patients with rheumatoid arthritis.AnnRheumDis2015;74(6):1265-1274
18 Wang G. Serum and urinary cell-free MiR-146a and MiR-155 in patients with systemic lupus erythematosus.JRheumatol2010;37(12):2516-2522
DOI:10.3980/j.issn.1672-5123.2016.4.09
收稿日期:2016-01-12 修回日期: 2016-03-15
通讯作者:王红,毕业于中山大学眼科中心,博士,主任医师,研究方向:葡萄膜炎学.wanghongyk@sina.com
作者简介:张新桥,在读硕士研究生,研究方向:眼科学。
基金项目:北京市自然科学基金(No.7122042)
作者单位:(100730)中国北京市,首都医科大学附属北京同仁医院 北京同仁眼科中心 北京市眼科学与视觉科学重点实验室
目的:检测Vogt-小柳原田综合征(VKH)患者和正常对照人群血浆中miRNAs差异表达谱,探讨miRNAs在VKH发病中的作用,寻找疾病相关的血浆生物标记物。
方法:采集10例VKH患者和10例正常对照组的血液样本,提取血浆中的总RNA,先进行RNA逆转录合成cDNA,然后在96孔板中利用miRNA实时定量PCR芯片进行Real-time PCR扩增和溶解曲线分析。获得原始的Ct值,应用Exiqon GenEx qPCR analysis software分析原始数据获得差异表达miRNA,并对差异表达miRNA进行生物信息学分析。
结果:miRCURY LNATMUniversal RT microRNA PCR芯片一共有179个人类来源的miRNAs,共筛选出20个差异表达的miRNAs,其中在VKH组中高表达者有12个,低表达者有8个。差异表达miRNAs参与多种信号通路。
结论:Vogt-小柳原田综合征患者血浆中存在多个microRNA异常表达,异常表达的miRNAs可能通过某种信号通路参与VKH的发病。
