蓝水生物技术——聚羟基脂肪酸酯的产业发展
2016-04-23尹进陈国强
尹进 陈国强
聚羟基脂肪酸酯是一类生物基塑料,可通过生物转化过程生产。然而生物转化过程存在灭菌过程耗能、发酵过程消耗淡水资源、底物成本较高等缺点致使其产品的成本居高不下,难以与化工产品相竞争。嗜盐微生物由于可在含有高浓度盐的环境(如海水)中生长,可应用于无灭菌的开放式连续发酵过程。结合分子和遗传等合成生物学手段对嗜盐微生物进行改造,这种新概念的生物技术——蓝水生物技术,有望大大降低生物转化过程的成本。
一、生物基塑料聚羟基脂肪酸酯(PHA)
1.聚羟基脂肪酸酯简介
聚羟基脂肪酸酯(polyhydroxyalkanoates,PHA)是一类高分子聚酯的统称,在现有的生物基塑料当中是唯一一种完全由微生物合成的生物材料[1]。PHA作为微生物在碳源过剩而其他营养物质限制条件下用于贮藏碳源和能源的物质,广泛存在于多种微生物的细胞当中,一般为胞内颗粒物[2]。
PHA的单体一般为3-羟基脂肪酸,单体的多样性造成了PHA种类的多样性[2]。PHA有多种分类方式,根据单体碳链长度可分为短链PHA、中长链PHA以及短链和中长链的共聚PHA;根据聚合方式可分为均聚物、随机共聚物和嵌段共聚物[3]。
PHA结构的多样化带来多种多样的性能,从坚硬质脆的硬塑料到柔软的弹性塑料、纤维等,再加上其生物可降解性、生物相容性和可再生资源合成的特点,在化工产品、医用植入材料、药物缓释载体、燃料等领域具有广泛的应用前景[1]。
2.聚羟基脂肪酸酯的产业化情况
PHA的产业化尝试在20世纪70年代就已经开展。目前实现商业化的PHA主要为聚3-羟基丁酸酯(PHB)、3-羟基丁酸酯和3-羟基戊酸酯的共聚物(PHBV)、3-羟基丁酸酯和3-羟基己酸酯的共聚物(PHBHHx)、聚3-羟基丁酸酯和4-羟基丁酸酯的共聚物(P3HB4HB)。然而PHA的生产成本过高,难以与石油基塑料竞争,因而也大大限制了PHA的大规模商业化。
包括PHA生产在内的生物转化过程的生产成本过高主要由以下几点造成:第一,底物(原材料)价格偏高,例如葡萄糖来源于淀粉水解,其价格增长迅速,且淀粉来源于粮食作物,大量使用于工业生产会造成“与人争粮”的问题;第二,生物转化过程通常需要消耗大量的淡水,这又会加重水资源问题,PHA的生产成本当中底物和淡水的成本就占了将近一半;第三,为了避免杂菌污染,整个生物反应体系包括发酵罐、管道以及底物培养基都需要进行高温高压蒸汽的灭菌处理,这一过程会消耗很多能量;第四,同样是为了避免杂菌污染,生物转化(发酵)过程是按批次不连续的,这虽然可以降低杂菌污染的几率但也降低了生产效率,而且每一批次的发酵过程都需要进行灭菌处理,这又增加了灭菌的次数及其所带来的能量消耗,这一能耗成本可占总成本的1/4左右;第五,为了耐受灭菌过程的高温高压蒸汽,发酵设备需要不锈钢等坚实材料制造,其价格不菲;最后,每一批次的发酵过程为了避免杂菌污染,操作复杂、耗时耗力,在一定程度上增加了人力成本[4,5]。
解决PHA产业化的问题有2种思路:一是改善和提高PHA的材料性能,赋予其优于石油基塑料的高附加值,寻找对应的应用领域;二是通过合适的手段大幅降低PHA的生产成本,使之接近甚至低于石油基塑料。
二、蓝水生物技术:基于嗜盐微生物的低成本生产技术
从上文所述的生物转化过程的成本因素可知,底物成本和灭菌能耗是造成高成本的主要因素。如能使用价格低廉的底物,减少淡水资源的使用,同时降低甚至取消灭菌过程带来的能耗,则有可能实现低成本的生产技术。而嗜盐微生物恰好能够满足低成本生产技术的这几点要求。
1.嗜盐微生物简介
嗜盐微生物(halophiles或halophilic microorganisms)是一类需要环境中存在较高浓度的氯化钠(NaCl)才能生长的微生物,广泛存在于古菌界、细菌界和真核生物界[6]。根据最适生长条件下的盐浓度,嗜盐微生物大致分类为中度嗜盐微生物和极端嗜盐微生物,前者的适宜生长的盐浓度范围为3%~15%,后者的最适生长盐浓度则在15%以上。
嗜盐微生物中存在2种机制防止过多的盐扩散进入细胞内从而能够在高盐环境中生存。第1种存在于好氧的极端嗜盐古菌和一些厌氧的嗜盐细菌,是在胞内积累一些矿物盐离子来平衡胞外的渗透压[7]。第2种存在于多数嗜盐细菌和嗜盐真核生物,在胞内积累小分子的水溶性有机化合物来维持胞内低的盐浓度的同时平衡胞外渗透压,这些有机化合物被称为亲和性溶质,四氢嘧啶是嗜盐微生物主要的亲和性溶质[6]。亲和性溶质是一种稳定剂,除了使细胞耐受高盐浓度,还可以耐受高温、干燥、寒冷甚至冰冻环境,因此可用于蛋白质、DNA和哺乳动物细胞的保护剂[8]。
一些嗜盐微生物的生存环境为生物量极少的盐碱环境,当有生物质(如腐烂植物或动物尸体)进入到该环境时,嗜盐微生物就要充分利用这些生物质,因此这些嗜盐微生物能够分泌各种水解酶,包括淀粉酶、脂肪酶、蛋白酶、木聚糖酶和纤维素酶等[8]。由于这些水解酶能够在高盐浓度的条件下发挥作用,因而被称为嗜盐水解酶。一些嗜盐水解酶还具有热稳定性和广范围的pH适应性,这些独特的性质使得嗜盐水解酶具有其特殊的应用价值。
2.基于嗜盐微生物的低成本生产技术
嗜盐微生物的生长环境为高盐浓度,且有些嗜盐微生物同时还喜欢在碱性条件下生长,在这种高盐高碱条件下普通的微生物难以生存,因此用于培养嗜盐微生物的培养基即便在没有灭菌的情况下也很难染杂菌。
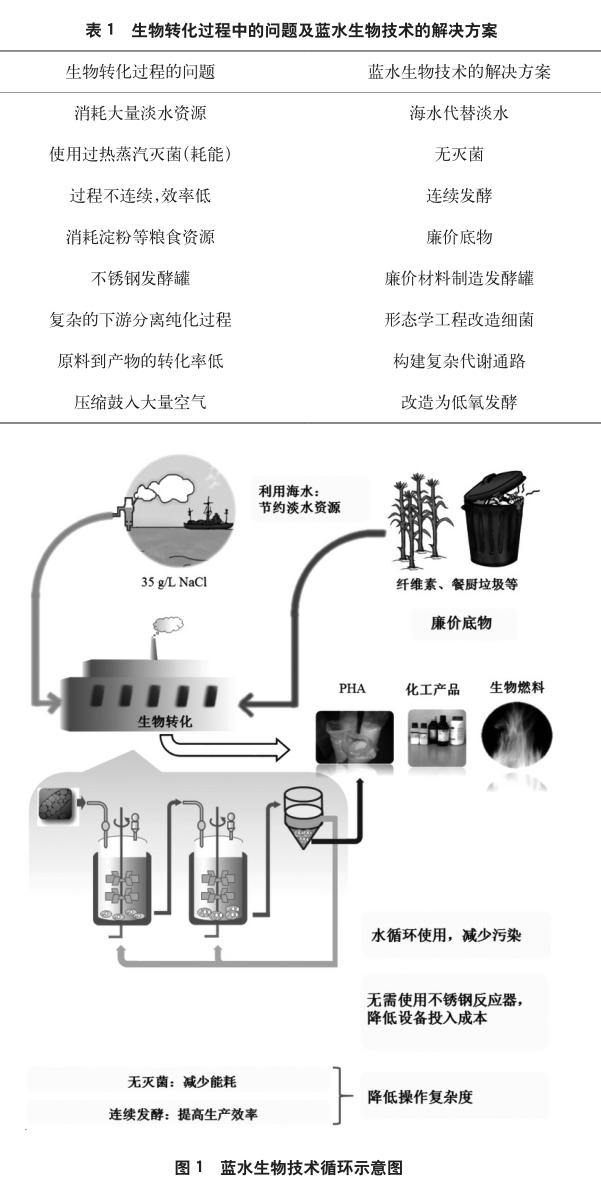
以嗜盐微生物作为工业生产菌株,就能够实现无灭菌开放式发酵(见表1),从而减少灭菌过程的能耗及其所带来的复杂操作和人力成本[6];同时无灭菌发酵可以实现连续式发酵,一方面减少了批次发酵过程中每一批次的灭菌和清洗等操作,另一方面连续发酵的生产效率高于批次发酵;无需灭菌还意味着生物反应器无需使用不锈钢材料来耐受高温高压蒸汽,使用塑料或陶瓷等材料可降低设备成本。培养嗜盐微生物需要含高浓度盐的底物培養基,这意味着可以使用海水来替代淡水资源,从而避免水资源问题[9,10]。如上文所述,一些嗜盐微生物能够分泌各种水解酶,则有可能使用廉价的混合底物,如含有淀粉、纤维素,甚至是富营养废水、餐厨垃圾、地沟油等。
综合以上几点,嗜盐微生物利用海水和廉价底物进行无灭菌开放连续式发酵,可大大降低发酵过程的生产成本。另外,一些嗜盐微生物受到低渗处理后细胞壁会出现破裂,对于PHA等胞内产物,可简化破裂细胞提取产物的复杂度和成本[6]。这种利用嗜盐微生物以海水为介质的低成本生产技术被称之为蓝水生物技术(图1)。
目前应用嗜盐微生物最成功的例子是利用嗜盐微藻杜氏盐藻Dunaliella合成-胡萝卜素和甘油,已实现了工业化规模的生产;在嗜盐古菌Halobacterium菌属种有一种独特的光驱动质子泵蛋白菌视紫红质,也实现了商业化生产[11]。
3.嗜盐微生物生产聚羟基脂肪酸酯
自从1972年第1次报道在嗜盐微生物中发现PHA以来,越来越多的嗜盐微生物被发现可以合成PHA。嗜盐古菌Haloferaxmediterranei能够积累占细胞干重46%(质量分数)的PHA,以葡萄糖或淀粉为碳源时合成的PHA种类为共聚物PHBV[12]。据报道利用Haloferaxmediterranei生产PHBV的成本比利用重组型大肠杆菌要低30%[13]。
合成PHA的嗜盐微生物的另一代表性菌株是玻利维亚盐单胞菌Halomonasboliviensis。该菌能够耐受的盐浓度范围为0~25%,可在0~45℃,pH6~11的环境中生长。该菌能够利用多种底物,包括葡萄糖、木糖、蔗糖等来生产PHB。在优化条件时,其合成的PHB的分子量能够达到
百万道尔顿[6]。
在一些情况下嗜盐微生物在合成PHA的同时还会合成亲和性溶质。Methylarcula marina和Methylarculaterricola两株嗜盐菌在6%~10%盐浓度的环境中合成四氢嘧啶和谷氨酸等亲和性溶质以及18%(质量分数)的PHB;盐单胞菌属Halomonascampaniensis在5.8%盐浓度下可以同时积累PHB和四氢嘧啶;还有报道利用盐单胞属的几种菌株实现40%(质量分数)的PHB和10%的四氢嘧啶的共产。研究证明PHB合成途径和四氢嘧啶合成途径均以乙酰辅酶A为前体,但是2条途径分别由营养限制和盐浓度压力2种不同的因素来启动。用两步法培养玻利维亚盐单胞菌,第1步在最适生长条件下培养细胞,第2步提高盐浓度来促进四氢嘧啶的合成,同时限制营养促使细胞积累PHB,最终得到占细胞干重13.2%的四氢嘧啶和68.5 %(质量分数)的PHB[14]。
笔者实验室从新疆盐湖土壤样品中分离筛选得到的2株嗜盐微生物,分别命名为盐单胞菌HalomonasTD01和盐单胞菌HalomonascampaniensisLS21,应用于无灭菌的开放式连续发酵,均表现出了优异的PHA合成能力。
盐单胞菌TD01为革兰氏阴性的中度嗜盐菌,耐受的盐浓度为10~250g/L,最适为60g/L;pH耐受范围为5~11,最适为9;可耐受0~45℃的温度,最适为37℃。野生型的盐单胞菌TD01能够以葡萄糖为唯一碳源合成80%(质量分数)以上的PHB。用2个发酵罐体系进行盐单胞菌TD01的无灭菌连续发酵,第1个发酵罐用于培养细菌,并将其中的细菌和培养基连续地泵入第2个发酵罐;第2个发酵罐的培养基含有葡萄糖且限制氮源以促使细菌进行PHB积累。最终在第1个发酵罐中细胞干重达到40g/L,PHB含量为60%(质量分数),葡萄糖到PHB的碳源转化率在20%~30%之间;而在第2个发酵罐中细胞干重较低,在20g/L左右,但PHB含量保持在70%(质量分数)以上,碳源转化率超过了50%。整个发酵过程持续了14天,没有发生杂菌污染[9]。利用该菌在山东鲁抗医药股份有限公司进行无灭菌发酵生产的中试,经粗略核算PHA的生产成本能够降低近一半[15]。
盐单胞菌LS21同样为一株中度嗜盐菌,生长最适盐浓度为40~60 g/L,pH耐受范围为8~11,最适为10,生长温度范围为25~55℃,最适为37~42℃,可在人工海水或天然海水为介质的培养基中生长。利用该菌及其重组菌进行的无灭菌连续发酵,其过程持续了65天,且无杂菌污染,细胞干重最高达到70g/L,PHB最高含量达到74%(质量分数)[10]。
这些结果均说明嗜盐微生物在利用低成本生产工艺的蓝水生物技术来生产PHA方面具有良好的应用前景。
三、应用合成生物学手段改良嗜盐微生物
嗜盐微生物作为一类具有工业生产应用前景的菌株,应当满足对其进行分子和遗传改造来改良特性,优化产量的需求。经过20多年的开发和发展,已经有多种适用于嗜盐微生物的分子生物学工具,如表达载体、启动子、基因突变、基因敲除技术等[16]。合成生物学的不断发展可以使研究者对野生菌株进行系统水平上的改造,构建性能优良的底盘微生物。
组学技术为揭示并系统解析细胞内的代谢调控网络及其变化机制提供了手段,使合成生物学改造底盘微生物更具有靶向性。近年来越来越多的嗜盐微生物有全基因组测序和分析信息,包括盐单胞菌TD01、LS21以及嗜盐古菌Haloferaxmediterranei、H. volcanii等,为定向改造这些嗜盐微生物提供了依据[5]。
例如,细菌只有一微米的维度,密度小,很难从高密度的发酵液中分离出来,高速离心等操作所带来的能耗也额外增加了成本。通过形态学工程改造细菌,可以使细菌体积增大,使之有利于分离。Tan等(2015)报道了在盐单胞菌TD01中过表达细胞分裂抑制蛋白MinCD,促使细胞纤长化达到近百微米,菌體之间相互缠绕形成网状结构,可以加快菌体自沉,简化下游处理步骤。同时细菌的纤长化还增加了胞内PHA的容纳空间,PHA的含量从野生型对照的69%(质量分数)提高到了82%(质量分数)[17]。
嗜鹽微生物以葡萄糖、淀粉等廉价底物为单一碳源时通常只会生产单一种类的PHA,另外细菌生长过程中还会产生各种次级代谢产物从而影响碳源到目的产物的转化率。通过遗传改造和代谢工程手段可以使嗜盐微生物生产其他种类的PHA,通过基因敲除可以阻止碳源被代谢为其他产物。例如,野生型盐单胞菌TD01以葡萄糖为单一碳源时生产的PHA种类为PHB,在其基因组上表达异源基因构建新的代谢通路可以使重组菌以葡萄糖为单一碳源生产PHBV[18]。在嗜盐古菌Haloferax中,在敲除pyrF基因(乳清酸核苷-5-磷酸脱羧酶)的基础上,以5-氟乳清酸和尿嘧啶作为选择压力,可大大提高双交换的效率,多次应用到了其他基因的敲除中,可用于次级代谢产物通路的敲除[19]。
嗜盐微生物多为好氧型,发酵过程需要压缩空气并鼓入发酵体系当中,而这一部分的能耗占发酵过程中所有能耗的近一半。因此若能够提高嗜盐微生物在微氧条件下的氧气利用率和PHA合成效率,则有可能降低压缩和鼓入空气的能耗和相应成本。Wu等(2014)在大肠杆菌中利用串联重复的微氧启动子来表达PHB合成通路的基因,提高了菌株微氧合成PHB的能力,在微氧条件下积累量最高可以达到90%[20]。若能将该技术应用到嗜盐微生物当中,有可能提高嗜盐微生物在发酵过程中氧气不足条件下的PHA合成能力。
四、结语
成本问题是造成聚羟基脂肪酸酯在内的生物基材料难以与石油基材料相竞争的主要原因。底物成本、灭菌能耗、下游处理等多个因素造成了生物基材料的成本过高。以嗜盐微生物为生产菌株的蓝水生物技术能够解决生物转化过程中的大部分问题:以海水代替淡水,使用廉价底物、无灭菌的连续开放式发酵降低了发酵过程的能耗和成本。利用这种低成本的生产工艺,结合合成生物学的改造手段,有望将生物基材料的高成本因素逐一克服,蓝水生物技术可能带来发酵工业的革命。
参考文献
[1] Chen Guoqiang.Patel Martin K.Plastics derived from biological sources:present and future:a technical and environmental review[J].Chem Rev,2012,112(4):2082-2099.
[2] Steinbüchel A,Valentin HE.Diversity of Bacterial Polyhydroxyalkanoic Acids[J].FEMS Microbiol Lett,1995,128(3):219-228.
[3] Chen Guoqiang.A microbial polyhydroxyalkanoates(PHA)based bio-and materials industry[J].Chem Soc Rev,2009, 38(8):2434-2446.
[4] WangYing,YinJin,Chen Guoqiang.Polyhydroxyalkanoates,challenges and opportunities[J].Curr Opin Biotechnol,2014, 30:59-65.
[5] Yin Jin,Chen Jinchun,Wu Qiong,et al.Halophiles,coming stars for industrial biotechnology[J].Biotechnol Adv, 2015(3):1433-1442.
[6] Jorge Quillaguamán,HectorGuzmán,Van-Thuoc D,et al.Synthesis and production of polyhydroxyalkanoates by halophiles:current potential and future prospects[J].Appl Microbiol Biotechnol,2010,85(6):1687-1696.
[7] Oren A.Diversity of halophilic microorganisms:environments,phylogeny,physiology,and applications[J].J Ind Microbiol Biotechnol,2002,28(1):56-63.
[8] DelgadoGarcía M,ValdiviaUrdiales B,Aguilar‐González CN,et al.Halophilic hydrolases as a new tool for the biotechnological industries[J].J Sci Food Agric,2012,92(13):2575-2580.
[9] Tan Dan,Xue Shengyuan,Gulsimay A,et al.Unsterile and continuous production of polyhydroxybutyrate by Halomonas TD01[J].Bioresour Technol,2011,102(17):8130-8136.
[10] Yue Haitao,LingChen,YangTao,et al.A seawater-based open and continuous process for polyhydroxyalkanoates production by recombinant Halomonas campaniensis LS21 grown in mixed substrates[J].Biotechnol Biofuels,2014,7:108.
[11] Ventosa A,Nieto JJ.Biotechnological applications and potentialities of halophilic microorganisms[J].World J Microb Biotechnol,1995,11(1):85-94.
[12] Chen C.Will,Don TrongMing,Yen Hsiao Feng.Enzymatic extruded starch as a carbon source for the production of poly(3-hydroxybutyrate-co-3-hydroxyvalerate)by Haloferax mediterranei[J].Process Biochem,2006,41(11):2289-2296.
[13] Koller Martin,Hesse Paula,Bona Rodolfo,et al.Potential of various archae and eubacterial strains as industrial polyhydroxyalkanoate producers from whey[J].Macromol Biosci,2007,7(2):218-226.
[14] Guzmán H,Van-Thuoc D,Martín J,et al.A process for the production of ectoine and poly(3-hydroxybutyrate) by Halomonas boliviensis[J].Appl Microbiol Biotechnol,2009,84(6):1069-1077.
[15] Li Teng,Chen Xiangbin,Chen Jinchun,et al.Open and continuous fermentation:products,conditions and bioprocess economy[J].Biotechnol J,2014,9:1503-1511.
[16] Argando a M,Vargas C,Reina-Bueno M,et al.An extended suite of genetic tools for use in bacteria of the Halomonadaceae:an overview[J].Methods Mol Biol,2012,824:167-201.
[17] Tan Dan,Wu Qiong,Chen Jinchun,et al.Engineering Halomonas TD01 for the low-cost production of polyhydroxyalkanoates[J].Metab Eng,2014,26:34-47.
[18] Yin Jin,Wang Huan,Fu Xiaozhi,et al.Effects of chromosomal gene copy number and locations on polyhydroxyalkanoate synthesis by Escherichia coli and Halomonas sp.[J].Appl Microbiol Biotechnol,2015,99:5523-5534.
[19] Liu Hailong,Han Jing,Liu Xiaoqing,et al.Development of pyrF-based gene knockout systems for genome-wide manipulation of the archaea Haloferax mediterranei and Haloarcula hispanica[J].J Genet Genomics,2011,38(6):261-269.
[20] WuHong,WangHuan,ChenJinchun,et al.Effects of cascaded vgb promoters on poly(hydroxybutyrate)(PHB) synthesis by recombinant Escherichia coli grown micro-aerobically[J].Applied Microbiology and Biotechnology,2014,98(24):10013-10021.
