黑曲霉降解人参皂苷Rb1制备稀有皂苷Compound K
2016-04-21周安东赵天蛟
高 娟, 周安东, 原 野, 赵天蛟
1.东北师范大学生命科学学院, 长春130024;
2.东北师范大学附属中学, 长春 130024
黑曲霉降解人参皂苷Rb1制备稀有皂苷Compound K
高娟1,周安东2,原野1,赵天蛟1
1.东北师范大学生命科学学院, 长春130024;
2.东北师范大学附属中学, 长春 130024
摘要:稀有人参皂苷Compound K(C-K)具有显著的生物学活性。从东北农耕土壤中分离出9株真菌,系统研究了其转化人参皂苷Rb1制备C-K的能力。其中,黑曲霉Aspergillus niger sp. J7能够高效转化人参皂苷Rb1生成C-K,转化途径为Rb1→Rd→F2→C-K。对黑曲霉J7转化Rb1制备C-K的条件进行优化,在最优条件下,Rb1可完全转化成C-K。将该转化体系扩大到200 mL,60 h内可将Rb1完全转化成C-K,转化率为74.7%。黑曲霉J7为人参皂苷Rb1高效水解为稀有人参皂苷C-K奠定了基础。
关键词:人参皂苷;黑曲霉;生物转化;β-葡萄糖苷酶
人参皂苷是人参的主要活性成分之一。药理学研究表明一些稀有人参皂苷如Compound K(C-K)具有显著的抗肿瘤活性[1~4]。然而,人参皂苷C-K在天然人参中并不存在,这限制了C-K的临床应用。因此,如何制备稀有人参皂苷C-K成为目前研究的热点。对比人参皂苷的结构可知,稀有人参皂苷C-K与其他高含量的人参皂苷,如Rb1相比,其皂苷元结构相同,只是侧链上糖基的数目和种类不同[5]。因此,理论上可以通过选择性水解人参皂苷Rb1的糖基来制备稀有皂苷C-K[6~8]。目前,制备稀有人参皂苷的方法主要包括化学法和生物转化法[9,10]。化学法包括加热、部分酸水解和碱水解等,具有副产物多、产率低、污染环境等缺点,不利于其应用。基于糖苷水解酶催化的微生物转化法具有反应条件温和、专一性高、环境相容性强等优点,具有极大的应用潜力[11~13]。因此,筛选高效转化人参皂苷制备稀有人参皂苷C-K的菌株具有广阔的研究和应用前景[14~16]。本研究从东北农耕土壤中筛选出能高效转化人参皂苷Rb1制备C-K的真菌,并优化其转化条件,通过TLC、HPLC和13C-NMR进行定量分析和结构鉴定[17~19],以期为C-K的制备奠定基础。
1材料与方法
1.1材料
本试验所用土壤采集自吉林省梨树县的农耕土壤。转化底物人参皂苷Rb1由实验室制得并经HPLC和13C-NMR鉴定。人参皂苷标准品购自成都曼思特生物科技有限公司。对硝基苯酚-β-D-葡萄糖苷(pNPG)购自Sigma-Aldrich公司。分子克隆相关试剂如Taq酶、dNTPs、琼脂糖凝胶回收试剂盒等均购自上海生工公司。其他试剂均为分析纯或色谱纯。引物合成由上海生工公司完成。
1.2实验方法
1.2.1土壤中人参皂苷转化菌种的筛选称取5 g土样加入50 mL灭菌水,充分搅拌后静置,上清涂布于PDA固体培养基,28℃倒置培养72 h后,将平板上长出的菌落分别划线至新的PDA固体培养基上,28℃培养72 h。所得的真菌再经一次划线培养,得到9种形态不同的真菌,分别命名为J1~J9,4℃保存备用。
1.2.29种土壤真菌对人参皂苷的降解将分离得到的9种土壤真菌分别接种在V8汁液体培养基(1 L培养基含有 200 mL V8果汁上清、2 g CaCO3)中,28℃、150 r/min振荡培养72 h。加入灭菌的玻璃珠,200 r/min振荡10 min,用无菌纱布过滤,收集滤液,用25 mmol/L醋酸盐缓冲液(pH 5.0)稀释至孢子浓度为1.0×106个/mL。向上述菌液中加入底物人参皂苷Rb1(溶于ddH2O,用0.22 μm滤膜过滤除菌),使其终浓度为0.5 mg/mL。28℃、150 r/min振荡培养。在不同的时间点取样,加入等量的正丁醇萃取,上层正丁醇相减压蒸干,重新溶于甲醇,用TLC法和HPLC法检测转化结果。
1.2.3真菌J7鉴定将待鉴定的真菌J7接种到 PDA固体培养基平板上,将灭菌的盖玻片斜插于平板上,于28℃恒温箱中暗培养。观察菌落的颜色和形态。待菌丝长到盖玻片上时,于显微镜下观察分生孢子梗、分生孢子及菌丝的大小和形态,并与《真菌鉴定手册》进行比对。
将真菌J7接种于V8汁液体培养基中,28℃、150 r/min振荡培养3 d。过滤收集菌丝体,液氮研磨,提取真菌J7的基因组DNA。采用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)扩增真菌J7的ITS片段。PCR扩增体系为:10×Buffer 2.5 μL,dNTPs(10 μmol/L)0.5 μL,引物ITS1和ITS4(10 μmol/L)各0.5 μL,Taq酶0.2 μL,基因组DNA 0.5 μL,ddH2O补足体积至25 μL。扩增条件为:94℃ 5 min;94℃ 30 s,55℃ 35 s,72℃ 1 min,循环35次;72℃ 8 min。PCR扩增结束后,用1.0%琼脂糖凝胶电泳分析PCR产物,对产物进行切胶回收,送至上海生工生物技术公司进行测序。将序列上传至GenBank,并与11株真菌的ITS序列进行比对,应用MEGA 4.0软件构建系统发育树。
1.2.4黑曲霉J7发酵液中β-葡萄糖苷酶活性测定以对硝基苯酚-β-D-葡萄糖苷(pNPG)为底物测定黑曲霉J7发酵液中β-葡萄糖苷酶活性,具体方法如下:取pNPG(5 mmol/L)30 μL、发酵液上清70 μL,用醋酸缓冲液(25 mmol/L,pH 5.0)补足体积至500 μL。反应混合物在37℃下避光反应30 min,然后加入2.5 mL NaOH(0.25 mol/L)终止反应。以无pNPG底物的反应体系作为对照,检测405 nm的吸光值。根据对硝基苯酚标准曲线计算发酵液中β-葡萄糖苷酶的酶活。以每分钟释放1 nmol对硝基苯酚所需要的酶量定义为1个酶活性单位。
1.2.5转化产物的检测与鉴定TLC检测:采用硅胶G60板。展开剂为氯仿:甲醇:水=65∶35∶10(V/V/V,下层)。显色剂:5%硫酸-乙醇溶液,105℃加热5 min显色。展开方式:上行展开。
HPLC检测:采用日本岛津HPLC系统,Shim-pack PREP-ODS (H)反相分析柱(4.6 mm×250 mm,5 μm)。以乙腈-水溶液进行如下程序的梯度洗脱:0~12 min,37.5%乙腈;12~32 min,37.5%~70%乙腈;32~42 min,70%乙腈;42~50 min,100%乙腈。流速:0.9 mL/min;柱温:30℃,检测波长:203 nm。
13C-NMR检测:采用Bruker Av-600 NMR核磁共振仪,氘代甲醇(MeOD)作为溶剂,四甲基硅烷(TMS)作为内标。
1.2.6黑曲霉J7转化人参皂苷Rb1制备C-K的条件优化对黑曲霉J7转化人参皂苷Rb1制备C-K的条件进行优化。转化pH分别选取4.0、5.0、6.0、7.0;反应温度为28℃、37℃、45℃;底物浓度为0.25 mg/mL、0.5 mg/mL、1 mg/mL、2 mg/mL。转化过程中定时取样,用等量正丁醇萃取,正丁醇相用TLC法和HPLC法检测转化效率,以0 h作为空白对照。
1.2.7转化体系的扩大将黑曲霉J7转化人参皂苷Rb1的体系放大至200 mL,在优化后的最适条件下进行反应:底物浓度:1 mg/mL;转化温度:28℃;转化pH 5.0。转化60 h后离心结束反应,收集上清用等量正丁醇萃取2次,合并正丁醇相50℃水浴蒸干后,复溶于甲醇中,TLC和HPLC分析转化结果。将样品冷冻干燥后,称重计算终产物C-K的收率。
2结果与分析
2.1菌种筛选与鉴定
从吉林省梨树县农耕土壤中分离纯化得到9株真菌,分别命名为J1~J9。对这9种真菌转化人参皂苷Rb1的能力进行了研究。结果表明除J6不转化外,其他8种真菌均能不同程度地转化人参皂苷Rb1。如表1所示,J2、J5、J8和J9能将底物人参皂苷Rb1转化为唯一产物Rd,Rd不能被继续水解。J1、J3、J4、J7能转化Rb1至稀有人参皂苷C-K。但J3和J4的转化途径更为复杂,产物C-K将会被进一步水解,造成C-K产率降低。而J1的转化效率较低。综合比较,J7能将人参皂苷Rb1转化为C-K,且转化途径清晰,转化效率高。因此,接下来对J7进行形态学和分子生物学鉴定,并对其水解人参皂苷Rb1的能力进行系统研究。
2.2真菌J7的鉴定
如图1所示,真菌J7的菌落形状为圆形或椭圆形,生长初期菌落呈白色,逐渐变成黄色最后为黑色,厚绒毛状;孢子为黑褐色,菌丝由白色变为浅黄色。倒置显微镜进行观察,发现菌株J7的菌丝较发达,壁厚、无隔、光滑;孢子为球形,壁光滑,呈褐色;顶部有球形顶囊,其上长有球状的分生孢子,呈黑褐色。通过比对《真菌鉴定手册》,菌株J7符合黑曲霉的形态学特征。将562 bp的ITS序列上传到NCBI中进行比对(GenBank登录号KF059971),比对结果(图2)显示真菌J7与黑曲霉有着高度同源性。据此可以鉴定菌株J7为曲霉属(Aspergillus)黑曲霉菌,命名为黑曲霉Aspergillusnigersp. J7。

表1 9种土壤真菌对人参皂苷Rb1的转化
注: “+”检测表示有产物产生,“-”表示无产物产生。

图1 菌株J7的电镜形态图Fig.1 Microscopic images of strain J7.1:分生孢子梗和顶囊(10×10倍);2:孢子(10×40倍);3:菌丝(10×40倍)
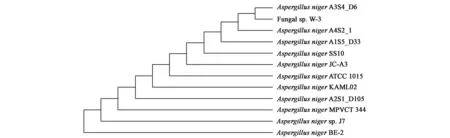
图2 根据ITS序列绘制的黑曲霉J7进化树Fig.2 The phyligenetic tree of ITS sequence of A. niger sp. J7.
2.3黑曲霉J7转化人参皂苷Rb1的途径研究
对黑曲霉J7转化人参皂苷Rb1的能力进行了系统研究。TLC方法检测结果表明(图3),在12 h内,底物Rb1出现了3个水解产物,其相对迁移率分别与人参皂苷标样Rd、F2、C-K一致。初步推测Rb1的水解途径为Rb1→Rd→F2→C-K。为验证这一结果,使用HPLC-C18反相柱层析对Rb1的转化过程进行检测。与标样(图4)相比,底物Rb1经黑曲霉J7水解后生成3种产物,分别与人参皂苷标样Rd、F2、C-K的保留时间一致(图5)。因此,确定Rb1的水解途径为Rb1→Rd→F2→C-K。由这一转化途径可知,黑曲霉对人参皂苷Rb1的C-3和C-20位糖基的水解能力不同。黑曲霉优先水解Rb1的C-20位外侧葡萄糖基,形成第一个中间产物Rd。接着,Rd的C-3位外侧葡萄糖基被切除,形成第二个中间产物F2。最后,F2 C-3位的内侧葡萄糖基被水解,形成终产物C-K。延长转化时间C-K也不能被继续水解,说明黑曲霉不能水解C-K的C-20位内侧葡萄糖基。
对终产物C-K的结构进行13C-NMR鉴定,结果如图6所示。在糖基异头碳存在的区域,只有唯一的化学位移δ98.62。与已有研究[14]对比,该位置为二醇型皂苷C-20位内侧的葡萄糖残基的异头碳(C-1)。因此,可以确定该产物为人参皂苷C-K。
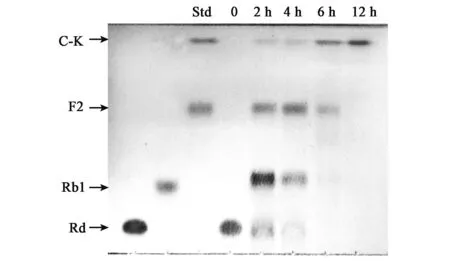
图3 TLC分析黑曲霉J7转化人参皂苷Rb1过程Fig.3 TLC analysis of the biotransformation process of ginsenoside Rb1 by A. niger sp. J7.

图4 人参皂苷标准品的HPLC图谱Fig.4 HPLC analysis of the ginsenoside standard.注:Rb1、Rd、F2、C-K的保留时间分别为5.085 min、10.872 min、24.872 min和37.775 min

图5 HPLC分析黑曲霉J7对人参皂苷Rb1的转化过程Fig.5 HPLC analysis of the biotransformation process of ginsenoside Rb1 by A. niger sp.

图6 转化终产物C-K的13C-NMR图谱及结构Fig.6 13C-NMR spectrum and structure of transformed products C-K.
2.4转化条件优化
2.4.1最适发酵时间黑曲霉J7在V8汁液体培养基中,28℃、150 r/min条件下培养。分别测定不同时间点的发酵液中的β-葡萄糖苷酶酶活。由图7可知,黑曲霉J7在36~48 h时酶活快速增加,72 h时酶活达到最高值。继续培养酶活开始下降。因此确定最适发酵时间为72 h。

图7 黑曲霉J7发酵过程中胞外β-糖苷水解酶的酶活曲线Fig.7 The enzymatic activity of glycosidase from A. niger sp. J7.
2.4.2最适转化pH将72 h的菌液离心,收集菌丝体和孢子,用缓冲液制备成转化液,加入人参皂苷Rb1后,分别置于不同的条件下培养,HPLC法计算不同条件下的C-K产率,结果如图8A所示。pH 5.0时,12 h后黑曲霉J7可将人参皂苷Rb1完全转化成C-K,速度快且几乎没有中间副产物,当pH达到7.0时几乎没有C-K生成。因此最适转化pH确定为5.0。
2.4.3最适转化温度由图8B可知,在28℃时,黑曲霉J7可将人参皂苷Rb1完全转化成C-K,速度快且几乎没有中间副产物。37℃时C-K产率降低,45℃时几乎没有C-K生成。因此最适转化温度确定为28℃。
2.4.4最适底物浓度由图8C可知,将转化液中底物人参皂苷Rb1的浓度分别调节为0.25 mg/mL、0.5 mg/mL、1 mg/mL、2 mg/mL。结果表明,当浓度达到2 mg/mL时,24 h内Rb1不能实现完全转化,当浓度小于1 mg/mL时,12 h内Rb1即可完全转化为C-K,且没有其他产物生成。考虑到反应速率,因此最适底物浓度确定为1 mg/mL。
经过一系列单因素实验研究得出黑曲霉J7培养72 h后配制成的转化缓冲液转化人参皂苷Rb1最优条件如下:转化缓冲液pH 5.0,转化温度28℃,底物浓度1 mg/mL,在150 r/min条件下振荡培养12 h。
2.5转化体系的扩大
在最适条件下,将黑曲霉J7转化人参皂苷制

图8 黑曲霉J7转化人参皂苷Rb1制备C-K的条件优化Fig.8 Optimization of the conditions for preparation of C-K from ginsenoside Rb1 by A. niger sp. J7.A:不同pH下的C-K产率;B:不同转化温度下的C-K产率;C:不同底物Rb1浓度下的C-K产率
备C-K的体系放大至200 mL。60 h内黑曲霉J7可将200 mg人参皂苷Rb1全部转化为稀有人参皂苷C-K,转化率为74.7%。
3讨论
早先,研究者选用肠道菌群转化人参皂苷制备抗肿瘤活性分子C-K。但肠道菌是厌氧菌,培养困难且成本较高,不利于生物转化的放大,所以人们开始寻找其他适合的微生物来转化人参皂苷制备C-K。前期研究结果表明,曲霉属、根霉属、毛霉属、红曲霉菌属等霉菌具有降解人参皂苷的能力[20],这些菌株被用于稀有人参皂苷C-K的转化制备。崔宇等[21]从人参种植土壤中筛选得到一株镰刀霉菌,利用该菌株转化人参果总皂苷以制备C-K,确定了该菌的最佳生长条件和最佳转化条件,为 C-K 的制备提供了一种可行的方法。侯耀达等[22]发现霉菌GS1-33能将人参根总皂苷转化为人参稀有皂苷C-K及Rh1,C-K的最大产率为14%,Rh1的最大产率为25%。由于这些研究多以混合皂苷作为底物,导致产物中除C-K外,还混有其他皂苷成分,给C-K的纯化带来困难。因此,筛选出成本低、安全性高、专一性好的转化菌株是目前制备人参皂苷 C-K 的首要任务。本研究从土壤中筛选到一株高效降解人参皂苷Rb1的黑曲霉,该菌向发酵液中分泌β-葡萄糖苷酶,能够高效转化人参皂苷Rb1生成稀有人参皂苷C-K。经过条件优化和转化体系扩大后,在60 h内,200 mg人参皂苷Rb1全部转化为单一产物,通过13C-NMR分析,确定终产物为稀有人参皂苷C-K。这说明黑曲霉J7分泌的胞外水解酶依次水解人参皂苷Rb1的C-20位外侧葡萄糖基、C-3位的外侧葡萄糖基和C-3位的内侧葡萄糖基,中间产物分别为人参皂苷Rd和F2,转化终产物为人参皂苷C-K。在这个过程中,黑曲霉J7不能进一步水解C-K中C-20位葡萄糖基而形成人参二醇型皂苷元,因此该菌的这一选择性使其适用于C-K的制备。这一转化过程中不涉及其余皂苷产物的生成,使产物C-K的纯化相对简便。此法适用于工业化制备,对稀有人参皂苷C-K的工业化制备具有重要意义。
参考文献
[1]王铁生. 中国人参[M]. 天津: 天津科学技术出版社, 2001, 87-125.
[2]Choi K, Kim M, Ryu J,etal.. Ginsenosides compound K and Rh2 inhibit tumor necrosis factor-α-induced activation of the NF-κB and JNK pathways in human astroglial cells[J]. Neurosci. Lett., 2007, 42: 37-41.
[3]Lee H U, Bae E A, Han M J,etal.. Hepatoprotective effect of ginsenoside Rb1 and compound K on tert-butyl hydroperoxide-induced liver injury[J]. Liver Int., 2005, 25: 1069-1073.
[4]黎 阳, 张铁军, 刘素香, 等. 人参化学成分和药理研究进展[J]. 中草药, 2009, 40(1): 164-172.
[5]吴立军.天然药物化学[M]. 北京: 人民卫生出版社, 2007.
[6]Chen Y, Nose M, Ogihara Y. Alkaline cleavage of ginsenosides[J]. Chem. Pharm. Bull., 1987, 35: 1653-1655.
[7]张怡轩, 陈晓莹, 赵文倩. 人参皂苷生物转化的研究进展[J]. 沈阳药科大学学报, 2008, 05: 419-422.
[8]张天杨, 刘春莹, 鱼红闪, 等. 一种霉菌产的人参皂苷酶水解Rb1和Rb2皂苷糖基的机理[J]. 大连工业大学学报, 2015, 03: 160-162.
[9]Han B H, Park M H, Han Y N. Degradation of ginseng saponins under mild acidic conditions[J]. Planta Med., 1982, 44: 146-149.
[10]Cheng L Q, Kim M K, Lee J W,etal.. Conversion of major ginsenoside Rb1 to ginsenoside F2 byCaulobacterleidyia[J]. Biotechnol. Lett., 2006, 28: 1121-1127.
[11]Han Y, Sun B, Hu X,etal.. Transformation of bioactive compounds byFusariumsaccharifungus isolated from the soil-cultivated ginseng[J]. J. Agric. Food Chem., 2007, 55(23): 9373-9379.
[12]Yuan Y, Hu Y, Hu C,etal.. Overexpression and characterization of a glycoside hydrolase family 1 enzyme fromCellulosimicrobiumcellulanssp. 21 and its application for minor ginsenosides production[J]. J. Mol. Catal. B: Enzym., 2015, 120: 60-67.
[13]赵雪淞, 孟 月, 陈星星. 稀有人参皂苷Compound K转化菌株的筛选及转化条件优化[J].食品工业科技, 2013, 11: 160-164.
[14]周 伟. 稀有人参皂苷compound K的制备和活性研究[D]. 上海:复旦大学,博士学位论文, 2008.
[15]李 学, 臧 埔, 张连学, 等. 微生物转化法制备人参皂苷Compound K的研究进展[J]. 食品科学, 2012, 11: 323-327.
[16]于 雷, 李成龙, 于珊珊. 人参皂苷CK的研究进展[J]. 生物技术通报, 2013, 01: 31-35.
[17]Kang A L, Sun J W, Tang S Y,etal.. TLCS determination of ingiberensis new saponin and dioscin inDioscoreazingiberensis[J]. Chin. J. Pharm. Anal., 2003,23(1): 59-60.
[18]Hubert J, Berger M, Dayde J,etal.. Use of a simplified HPLC-UV analysis for soyasapenin B determination: study of saponin and isoflavonevarlabillit in soybean cuhivars and soy-based health food products[J]. Food Chem., 2005, 53: 3923-3930.
[19]Rong W T, Hai Z L, Jiang T C,etal.. Complete assignment of1H and13C NMR data for nine protopanaxatriol glycosides[J]. Magn. Reson. Chem., 2002, 40: 483-488.
[20]崔玉娜, 张怡轩, 赵余庆. 利用生物转化法制备稀有人参皂苷的研究进展[J]. 中草药, 2009, 40: 676-680.
[21]崔 宇, 姜彬慧, 韩 颖, 等. 微生物对人参果总皂苷中人参皂苷化合物 K 的转化作用[J]. 中草药, 2007, 38: 189-193.
[22]侯耀达, 费丽坤, 尹成日. 微生物转化人参根总皂苷为稀有皂苷C-K和Rh1[J]. 延边大学农学学报,2011,02:108-111.
Enzymatic Degradation of Ginsenoside Rb1 for Preparation of Compound K byAspergillusnigersp. J7
GAO Juan1, ZHOU An-dong2, YUAN Ye1, ZHAO Tian-jiao1
1.SchoolofLifeSciences,NortheastNormalUniversity,Changchun130024,China;2.HighSchoolAttachedtoNortheastNormalUniversity,Changchun130024,China
Abstract:Minor ginsenoside Compound K (C-K) exhibited remarkable biological activities. In this study, nine fungi were isolated from soil, and their abilities of transform ginsenoside Rb1 for preparation of C-K were studied. A highly efficient ginsenoside Rb1-hydrolyzing fungus Aspergillus niger sp. J7 was screened. The strain converted ginsenoside Rb1 to C-K with the pathway of Rb1→Rd→F2→C-K. The conversion conditions of A. niger sp. J7 was optimized. Under the optimal conditions, ginsenoside Rb1 was converted to C-K completely. The transformation system was enlarged to 200 mL, in which ginsenoside Rb1 was completely converted into C-K after 60 h and the conversion rate was 74.7%. This fungus was expected to be the basis in bioactive C-K preparation.
Key words:ginsenoside; Aspergillus niger; biotransformation;β-glucosidase
DOI:10.3969/j.issn.2095-2341.2016.02.04
作者简介:高娟,讲师,主要从事糖类化合物生物转化研究。E-mail:gaoj199@nenu.edu.cn
基金项目:国家自然科学基金(31400299)资助。
收稿日期:2015-12-15; 接受日期:2016-01-06
