玉米秸秆水解残渣厌氧消化的产气性能
2016-04-21陈世平汤晓玉肖泽仪王文国尹小波VENKATESHBalan胡启春
陈世平,汤晓玉,肖泽仪*,王文国,尹小波,VENKATESHBalan,吴 波,胡启春
(1.四川大学化学工程学院,成都610065;2.农业部沼气科学研究所,成都610041;3.密歇根州立大学材料科学与化学工程系,美国兰辛48910)
玉米秸秆水解残渣厌氧消化的产气性能
陈世平1,汤晓玉2*,肖泽仪1*,王文国2,尹小波2,VENKATESHBalan3,吴波2,胡启春2
(1.四川大学化学工程学院,成都610065;2.农业部沼气科学研究所,成都610041;3.密歇根州立大学材料科学与化学工程系,美国兰辛48910)
摘要:为了考察玉米秸秆水解残渣(Unhydrolyzed solid,UHS)的厌氧消化产甲烷潜力,研究了接种物类型、接种比例以及发酵温度对UHS产气性能的影响。结果表明,餐厨垃圾厌氧消化液作为接种物时,UHS具有较高的产气能力,累积甲烷产量达到208.06 mL· g(-1)VS;UHS的累积甲烷产量与接种物对底物的比值(Inoculum to substrate ratios, R(I/S))有关,其值随着接种比例的减小而逐渐降低,当接种比例R(I/S)为0.1:1~3:1时,累积甲烷产量为111.20~224.48 mL·g(-1)VS,UHS的生物降解率为27.89%~56.29%,其降解能力随着底物浓度的升高而降低;在高温发酵(55℃)和中温发酵(35℃)条件下,相同接种比例的对照组中,UHS累积甲烷产量较为接近,但高温发酵的产气速率明显高于中温发酵。
关键词:玉米秸秆;水解残渣;厌氧;甲烷;发酵
陈世平,汤晓玉,肖泽仪,等.玉米秸秆水解残渣厌氧消化的产气性能[J].农业环境科学学报, 2016, 35(3):584-589.
CHEN Shi-ping, TANG Xiao-yu, XIAO Ze-yi, et al. Biogas production of unhydrolyzed solid from corn stover hydrolysate by anaerobic digestion[J]. Journal of Agro-Environment Science, 2016, 35(3): 584-589.
纤维素乙醇以其原料来源广泛、储量丰富、可持续利用以及非粮食性等特点,成为最有希望替代化石燃料的可再生能源之一[1-2]。然而通过生物化学途径(预处理、酶水解、发酵等)将木质纤维素转化为乙醇的过程中会产生大量的水解残渣,可占到原料的25%~35%[3]。实际上这些水解残渣含有大量未被利用的糖类和木质素,其潜在的热能和含碳量分别为原料的36%和40%[4]。因此,回收并利用这部分碳源对减少废弃物的排放和提高过程收益具有重要意义。
目前大多数木质纤维素生物炼制厂将这部分废弃物直接燃烧用于发电和供热,利用价值不高[5]。部分生物炼制工艺考虑从中提取木质素,用于生产高附加值的化工产品,而木质素高值化利用技术要求其纯度高且不含共价结合的糖类,同时提取过程对木质素的化学修饰程度低。常用的各类提取木质素的化学方法(如强酸、强碱处理等)会不同程度地影响原木质素的链接键和化学结构。而有机溶剂萃取又面临着回收成本高、溶剂具有毒性等问题[6-7]。为此,本研究采用反应条件温和且环境友好的生物方法,即通过厌氧消化将水解残渣中的残糖转化为能量物质(沼气),同时使其中的木质素得以富集并进行后续的高值化利用。本文重点探讨了接种物类型、接种比例以及发酵温度等参数对水解残渣产气潜力的影响。本研究结果将为后续的木质素分离及纤维素乙醇的过程废弃物利用奠定基础。
1 材料与方法
1.1实验材料
实验采用的玉米秸秆水解残渣(UHS)由美国密歇根州立大学生物质转化实验室提供。其制备方法如下:首先将玉米秸秆在120℃条件下采用氨纤维爆破预处理1 h[8],然后利用复合纤维素酶进行水解168 h,通过离心分离去除水解液得到固体残渣,再用去离子水洗两次(去除残留在固体残渣中的可溶性糖),最后得到的固体残渣在80℃下烘干过夜并保存备用。
实验采用的接种物餐厨垃圾厌氧消化液、制药废水厌氧消化液和污水厂的厌氧消化污泥均来自农业部沼气科学研究所微生物研究中心。先用80目筛子过滤接种物以去除其中的大颗粒物质,然后放入恒温培养箱进行发酵,直至不再产气为止。各接种物的主要特性如表1所示。
1.2实验方法
实验采用批次厌氧消化的方法,用118 mL的血清瓶作为厌氧发酵瓶,发酵体积为60 mL,通过恒温培养箱控制发酵温度。采用不添加底物的接种物作为对照,每个实验样品设置两个平行样。UHS的净产气量为实验组(UHS+接种物)产气量减去对照组(接种物)产气量。接种后将发酵液pH值调节到7.0±0.1,然后加塞密封并通入氮气5 min,排出顶空气体,以保证瓶内的厌氧环境。
1.2.1接种物对UHS产气潜力的影响
分别以餐厨垃圾厌氧消化液、制药废水厌氧消化液和污水厂的厌氧消化污泥作为厌氧发酵接种物。接种物与底物比值RI/S为3:1[基于挥发性固体(VS)计算],发酵温度为35℃。定期取样测量产甲烷体积和甲烷含量。
1.2.2接种比例对UHS产气潜力的影响
以餐厨垃圾厌氧消化液为接种物,实验时保持接种物的添加量不变,通过改变底物的添加量将RI/S分别设置为3:1、2:1、1:1、0.5:1、0.25:1、0.1:1、0.05:1,不同接种比例条件下的底物和接种物添加量如表2所示,发酵温度为35℃。定期取样测量甲烷产量、甲烷含量及挥发性脂肪酸(VFA)浓度。
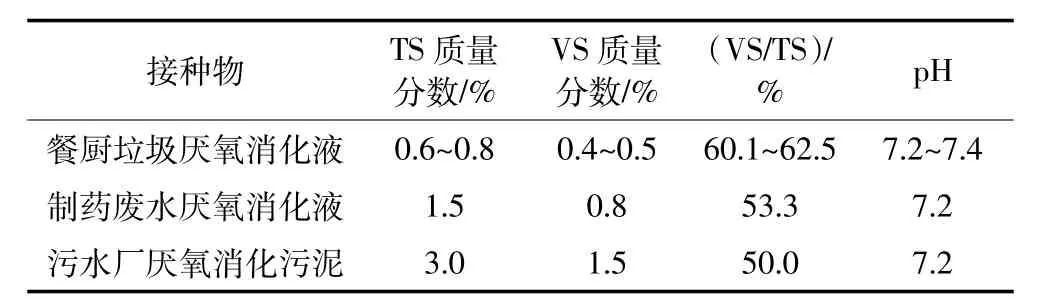
表1 接种物的特性Table 1 Characteristics of inoculums
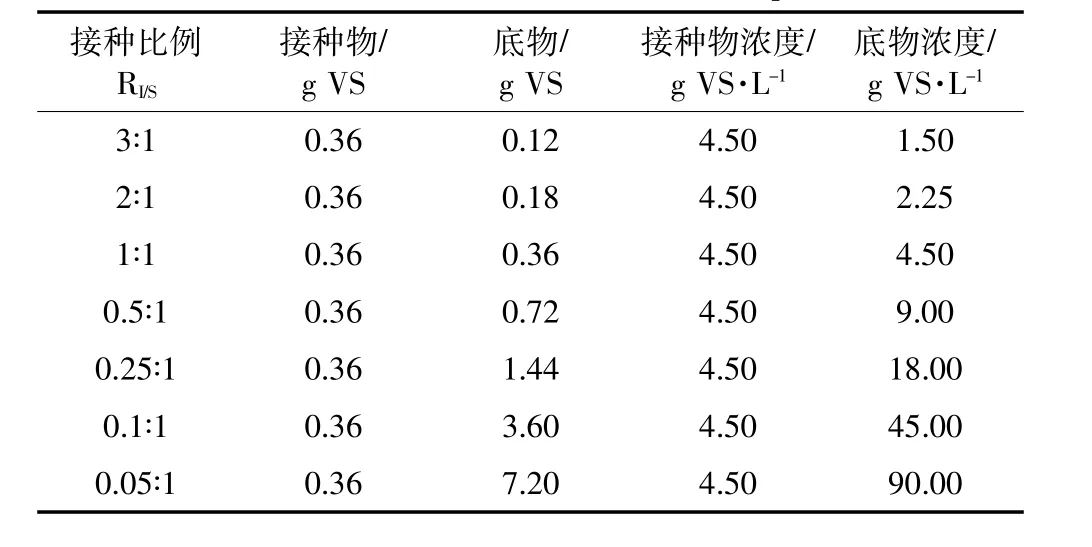
表2 接种比例实验设计Table 2 Inoculum to substrate ratios in experiment
1.2.3温度对UHS产气潜力的影响
以餐厨垃圾厌氧消化液为接种物,根据接种比例对UHS发酵性能影响的实验结果,优化选取RI/S为3:1、2:1、1:1、0.5:1、0.25:1五个接种比例,发酵温度分别为35℃和55℃。定期取样测量甲烷产量、甲烷含量和VFA浓度。
1.3分析方法
总固体(TS)、挥发性固体(VS)和灰分的含量测定采用烘干法。
沼气产量通过集气法进行测量。气体含量采用气相色谱仪(GC122)分析,色谱柱为碳分子筛TDX-01 (2 m×2 mm),采用TCD检测器,色谱条件如下:柱温120℃,进样器温度120℃,检测器温度150℃,载气为H2,进样量100 μL。
VFA采用气相色谱仪(GC112)分析,色谱柱为填充柱(3 mm×1.5 mm),采用FID检测器,色谱条件如下:柱温160℃,进样器温度210℃,检测器温度230℃,载气为Ar,气体压力0.17 MPa,进样量2 μL。
UHS的成分分析按照美国国家可再生能源实验室的标准方法[9]进行,其中葡聚糖、木聚糖和阿拉伯糖采用高效液相色谱仪(Agilent LC1200)分析,色谱柱为Aminex HPX-87X,采用RID检测器,色谱条件如下:柱温35℃,流动相5 mmol·L-1H2SO4溶液,流速0.6 mL·min-1,进样量10 μL。
1.4生物降解率计算
UHS的经验分子式为CaHbOcNd,其中a=1,b= 1.32,c=0.80,d=0.23(以UHS各元素质量百分数作为计算依据,各元素含量分别为C=44.60%、H=4.92%、O=47.50%、N=2.94%)。假设UHS的全部化学计量转化为CH4和CO2,采用Buswell's方程[10]计算得到理论甲烷产量为389.77 mL·g-1VS。生物降解率(B0-Thatc)可以通过实际甲烷产量和理论甲烷产量的比值得到:
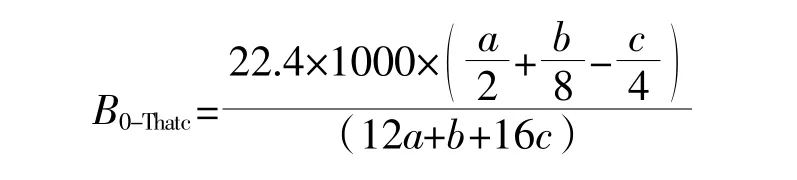
2 结果与讨论
2.1UHS的成分分析
UHS的主要成分如表3所示。从表中数据看出,其主要含有未水解的聚糖和木质素,含量分别为20.74%和52.49%,其中聚糖主要包括葡聚糖、木聚糖和阿拉伯聚糖。存在较高聚糖的主要原因,可能是由于玉米秸秆在酶水解过程采用的真菌酶复合制剂中,缺少某些能断裂这些聚糖链接键的酶活,使其不能被完全降解[11-12]。此外,氨纤维爆破预处理过程不能将木质素溶解并去除,因此木质素含量较高[13-14]。
2.2接种物对UHS产气潜力的影响
将UHS添加到三种不同的接种物中进行厌氧发酵,对照组及实验组累积甲烷产量和甲烷浓度变化如图1所示,整个发酵过程持续40 d。将实验组产气量减去对照组产气量为UHS的净产气量。由图1可以看出,三种接种物都能不同程度地厌氧降解UHS产生沼气。通过计算发现在相同的接种比例以及发酵时间里,以餐厨垃圾消化液为接种物时,累积甲烷产量明显高于其他两种接种物。发酵结束时,UHS的累积甲烷产量为208.06 mL·g-1VS,较其他两种接种物分别高出36.5%和36.8%。从甲烷浓度变化曲线来看,餐厨垃圾消化液作为接种物时,甲烷浓度能很快达到稳定,并保持在59%左右,高于其他两种接种物在发酵稳定时的甲烷浓度。餐厨垃圾厌氧消化液作为接种物时,UHS具有较好的产气能力,通过紫外显微镜观察,其厌氧消化液中微生物种类和数量较多、活性较强。

表3 UHS主要成分Table 3 Main composition of UHS
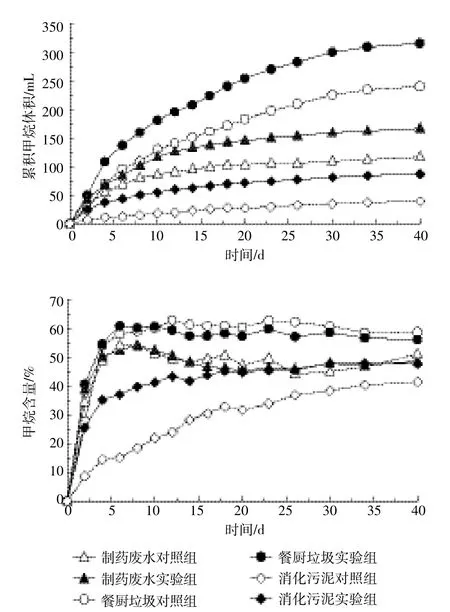
图1 不同接种物下UHS厌氧消化的累积甲烷产量和甲烷含量Figure 1 Cumulative methane production and methane content during UHS anaerobic digestion at different inoculums
2.3接种比例对UHS产气潜力的影响
2.3.1不同接种比例下UHS的产气潜力
餐厨垃圾消化液对UHS有更好的降解能力,因此选其作为接种物开展后续实验。不同接种比例下UHS厌氧消化过程的累积甲烷产量如图2所示。当接种比例RI/S>0.1:1时(此时底物浓度小于45 g VS· L-1),各组实验都能正常产气。总体上累积甲烷产量随着接种比例减小而逐渐降低,与Li等[15]研究藻渣的厌氧消化性能,以及Alzate等[16]研究微藻产甲烷潜力时的变化规律一致。这是由于接种比例高,在接种物浓度不变的情况下,底物浓度降低,接种物与底物接触充分,对其降解更为彻底;随着接种比例降低,其对应的底物浓度逐渐增大,而VFA累积浓度随着底物浓度增大而增大,过高的VFA会对甲烷菌生长产生一定的抑制作用。当接种比例RI/S为0.05:1时,底物浓度达到90.00 g VS·L-1,此时由于VFA累积浓度过高,使得产酸与产甲烷过程失去平衡,导致发酵失败。6个不同接种比例下UHS的最终累积甲烷产量变化范围为111.20~224.48 mL·g-1VS。本实验结果值低于付善飞等[17]用玉米秸秆做厌氧发酵时的累积甲烷产量299.80 mL·g-1VS,而与Raposo等[18]用玉米秸秆为原料时的累积甲烷产量196.00~233.00 mL·g-1VS较为接近。这可能与采用的接种物不同有关,同时也说明UHS的产气潜力与传统物料接近。
2.3.2发酵过程中VFA变化情况
VFA是厌氧发酵过程中有机物水解的产物,同时也是产甲烷菌利用的底物,主要有乙酸、丙酸、丁酸等。VFA浓度是评价水解酸化和产甲烷平衡的重要指标[19]。实验过程中不同接种比例下总挥发性脂肪酸(TVFA,为乙酸、丙酸、丁酸浓度的总和)变化情况如图3所示。在正常产气的实验组中,TVFA总体上表现为先上升后下降,最后趋于平缓接近于零。这是因为产酸菌代谢速率明显高于产甲烷菌,在发酵初期有机物在产酸菌的作用下快速降解,产酸速率大于消耗速率,所以TVFA快速累积,随着发酵的进行,累积的TVFA逐渐被甲烷菌消耗,TVFA浓度下降。正常产气的实验组在发酵第4 d左右TVFA达到最大值,且最大累积量均在4000 mg·L-1以下,低于Raposo等[18]用玉米秸秆为原料厌氧消化时的累积浓度5604 mg·L-1。王晓娇等[20]研究则发现,TVFA浓度小于4125 mg·L-1时对厌氧发酵的影响较小。当接种比例RI/S为0.05:1时,底物浓度为90.00 g VS·L-1,TVFA浓度变化如图3所示。在发酵第8 d时TVFA达到6929 mg·L-1,pH值降低到5.5,发酵液严重酸化,对甲烷菌的生长产生了抑制作用,导致产气过程失败。发酵40 d时TVFA浓度接近10 000 mg·L-1。

图2 不同接种比例下UHS厌氧消化过程中的累积甲烷产量Figure 2 Cumulative methane production during UHS anaerobic digestion at different RI/S
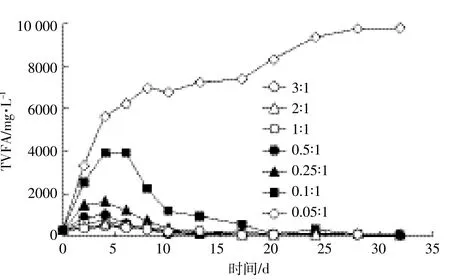
图3 UHS厌氧发酵过程中TVFA浓度变化Figure 3 Changes of TVFA during UHS anaerobic digestion process
2.4温度对UHS产气潜力的影响
不同发酵温度下UHS的甲烷累积产量和TVFA变化情况如图4所示。总体上,UHS在高温条件下有较高的产气速率。厌氧发酵进行到16 d时,各接种比例下UHS的甲烷累积产量基本达到最终甲烷产量的80%以上,而达到相同的产量,中温发酵时需要28 d以上。这是由于温度与微生物细胞内蛋白质的稳定性和活性有关,温度的改变可以明显影响厌氧消化过程微生物的活性,从而影响厌氧消化过程[21]。高温环境使得微生物体内酶活性较高,从而加快了代谢速率。从图4中TVFA的变化情况可以看出,高温时微生物的产酸速率和消耗酸的速率明显高于中温发酵组,特别是在较高的底物浓度条件下,高温条件可以显著提高厌氧发酵的产气速率。
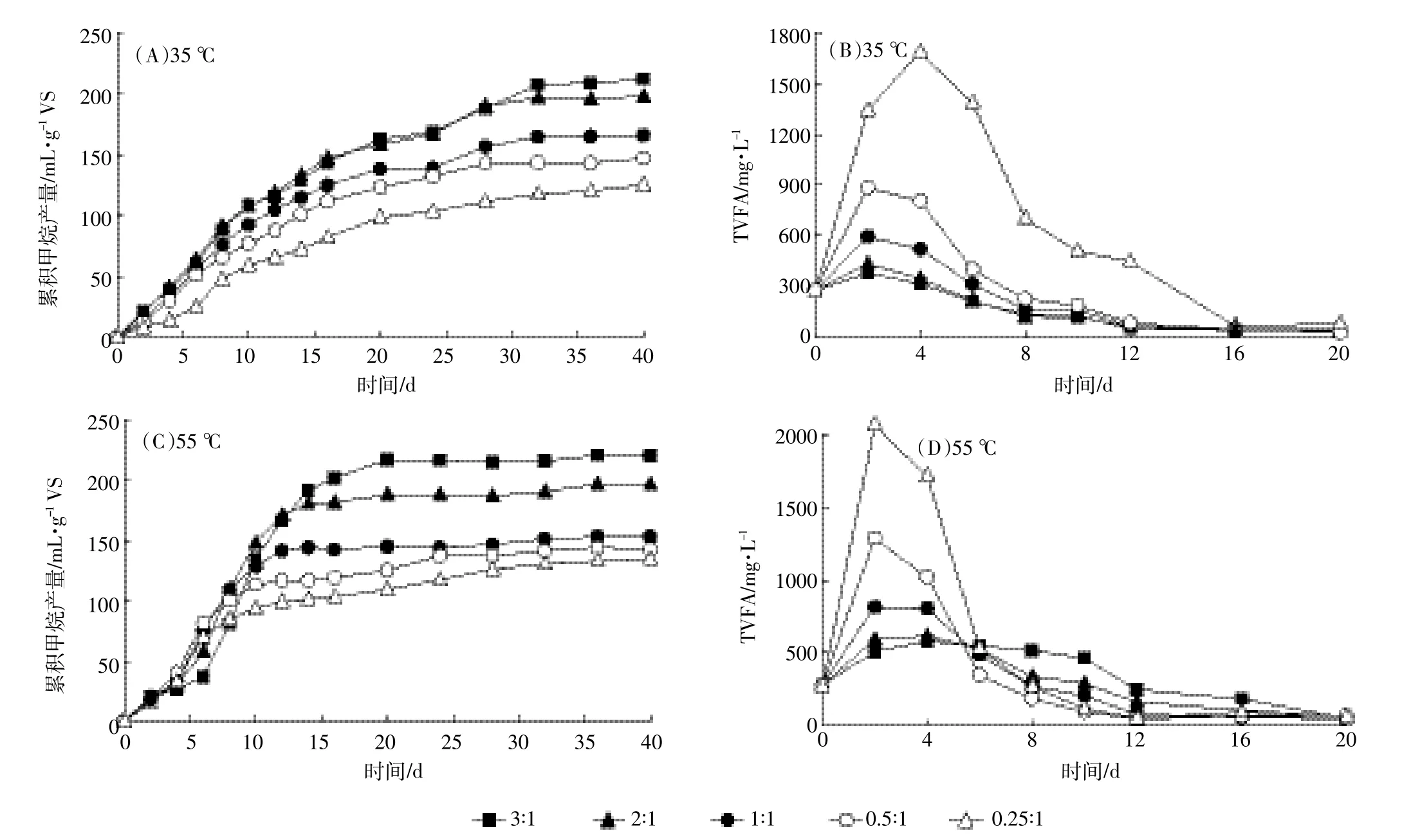
图4 不同温度下UHS累积甲烷产量及TVFA浓度变化Figure 4 Cumulative CH4production and TVFA changes at different temperatures
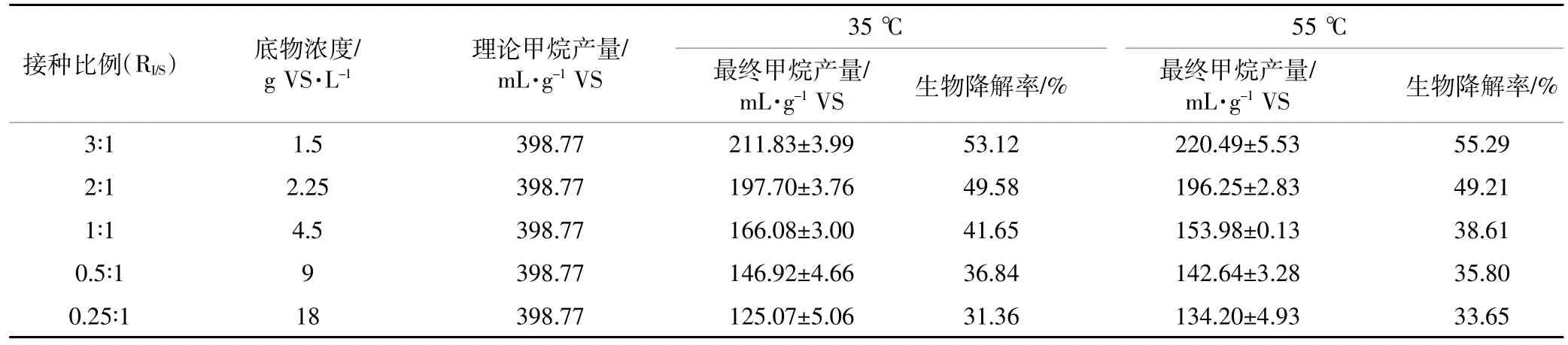
表4 不同温度下UHS的降解性能Table 4 UHS biodegradability at different temperatures
表4给出了不同温度、不同接种比例下UHS的累积甲烷产量和生物降解率。由表4可以看出,35℃和55℃时不同接种比例下累积甲烷产量分别为125.07~211.83 mL·g-1VS,134.20~220.49 mL·g-1VS,UHS的生物降解率分别为31.36%~53.12%、33.65%~55.29%。UHS中含有大量的木质素(高达50%)和部分残糖,经过厌氧消化后,其生物降解率最高可以达到55%,我们认为,在此实验条件下除了残糖被转化为沼气外,木质素也可能发生了一定程度的降解。这是由于UHS是秸秆经过氨纤维爆破预处理和酶水解后的残余物。氨纤维爆破预处理会对植物细胞结构进行一定程度的修饰,除了能够破坏纤维素和木质素之间的链接键外,也会使木质素间复杂链接断裂及CO-C键断裂,形成木质素低聚物。而木质素在厌氧条件下的降解难易程度主要受木质素片段大小的影响,木质素单体和低聚物容易被代谢,因此UHS的生物降解率偏高可能是由于部分木质素降解造成的[21-22]。相同接种比例下,高温和中温厌氧发酵组对应的UHS累积甲烷产量较为接近,标准偏差不大于6.40mL·g-1VS。从温度对UHS厌氧消化性能的影响来看,虽然两种温度下UHS的最终累积甲烷产量较为接近,但高温条件下有着较高的产气速率,能够更快地启动厌氧发酵过程。在实际工程运用中应综合考虑发酵速率和发酵能耗之间的关系,择优选择发酵温度。
3 结论
(1)用玉米秸秆的水解残渣进行厌氧发酵生产沼气是可行的。在实验采用的三种接种物中,餐厨垃圾消化液对UHS有较好的产气能力,比其他两种接种物分别高出36.5%和36.8%。
(2)UHS的累积甲烷产量与接种物和底物的比值RI/S有关,其值随着接种比例减小而逐渐降低,当接种比例RI/S从0.1:1~3:1时,累积甲烷产量为111.20~224.48 mL·g-1VS,UHS的生物降解率为27.89%~56.29%。但当接种比例RI/S为0.05:1时,底物浓度过高,发酵液酸化,产气过程失败。
(3)高温发酵和中温发酵下UHS的累积甲烷产量较为接近,但高温发酵产气速率明显高于中温发酵。
参考文献:
[1] Guo M, Song W, Buhain J. Bioenergy and biofuels:History, status, and perspective[J]. Renewable and Sustainable Energy Reviews, 2015, 42:712-725.
[2] Balat M. Production of bioethanol from lignocellulosic materials via the biochemical pathway:A review[J]. Energy Conversion and Management, 2011, 52(2):858-875.
[3] Dwivedi P, Alavalapati J R R, Lal P. Cellulosic ethanol production in the United States:Conversion technologies, current production status, economics, and emerging developments[J]. Energy for Sustainable Development, 2009, 13(3):174-182.
[4] Jin M T, Sven G S, Henrik B M, et al. A new algorithm to characterize biodegradability of biomass during anaerobic digestion:Influence of lignin concentration on methane production potential[J]. Bioresource Technology, 2011, 102:9395-9402.
[5] Li Y Q, Zhang R H, Chen C, et al. Biogas production from co-digestion of corn stover and chicken manure under anaerobic wet, hemi-solid, and solid state conditions[J]. Bioresource Technology, 2013, 149:406-412.
[6] Rabelo S C, Carrere H, Filho R M, et al. Production of bioethanol, methane and heat from sugarcane bagasse in a biorefinery concept[J]. Bioresource Technology, 2011, 102(17):7887-7895.
[7] Mosiera N, Wyman C, Dale B, et al. Features of promising technologies for pretreatment of lignocellulosic biomass[J]. Bioresource Technology, 2005, 96(6):673-686.
[8] Chundawat S P S, Vismeh R, Sharma L N, et al. Multifaceted characterization of cell wall decomposition products formed during ammonia fiber expansion(AFEX)and dilute acid based pretreatments[J]. Bioresource Technology, 2010, 101:8429-8438.
[9] National Renewable Energy Laboratory, Inc. Standard procedures for biomass compositional analysis[EB/OL].[2015-7-11]. http://www. nrel. gov/biomass/analytical_procedures. html.
[10] Raposo F, Fernández C V, Rubia M A, et al. Biochemical methane potential(BMP)of solid organic substrates:Evaluation of anaerobic biodegradability using data from an international interlaboratory study [J]. Journal of Chemical Technology & Biotechnology, 2011, 86(8):1088-1098.
[11] Yue Z B, Li W W, Yu H Q. Application of rumen microorganisms for anaerobicbioconversionoflignocellulosicbiomass[J].Bioresource Technology, 2013, 128:738-744.
[12] Michael F P, Pascale C, Michael F C, et al. A biorefinery processing perspective:Treatment of lignocellulosic materials for the production of value-added products[J]. Bioresource Technology, 2010, 101:8915-8922.
[13] Amber N, Hoover J S T, Farzaneh T. Effect of pelleting process variables on physical properties and sugar yields of ammonia fiber expansion pretreated corn stover[J]. Bioresource Technology, 2014, 164:128-135.
[14] Liu Z G, Padmanabhan S, Cheng K, et al. Aqueous-ammonia delignification of miscanthus followed by enzymatic hydrolysis to sugars[J]. Bioresource Technology, 2013, 135:23-29.
[15] Li Y, Hua D L, Zhang J, et al. Influence of inoculums to substrate ratios (ISRs)on the performance of anaerobic digestion of algal residues[J]. Annals of Microbiology, 2014, 64:955-960.
[16] Alzate M E, Munoz R, Rogalla F, et al. Biochemical methane potential of microalgae:Influence of substrate to inoculums ratio, biomass concentration and pretreatment[J]. Bioresource Technology, 2012, 123:488-494.
[17]付善飞,许晓晖,师晓爽,等.厌氧发酵起始阶段通氧对玉米秸秆产甲烷特性的影响[J].化工学报, 2015, 66(3):1111-1117. FU Shan-fei, XU Xiao-hui, SHI Xiao-shuang, et al. Effect of oxygen supply at initial stage of anaerobic digestion on biogas production from corn straw[J]. CIESC Journal, 2015, 66(3):1111-1117.
[18] Raposo F, Banks C J, Siegert I, et al. Influence of inoculum to substrate ratio on the biochemical methane potential of maize in batch tests[J]. Process Biochemistry, 2006, 41:1444-1450.
[19] Wang Y Y, Zhang Y L, Wang J B, et al. Effects of volatile fatty acid concentrations on methane yield and methanogenic bacteria[J]. Biomass and Bioenergy, 2009, 33:848-853.
[20]王晓娇,杨改河,冯永忠,等.牲畜粪便与秸秆混合的厌氧发酵效果及影响因素分析[J].农业环境科学学报, 2011, 30(12):2594-2601. WANG Xiao-jiao, YANG Gai-he, FENG Yong-zhong, et al. Anaerobic co-digestion effects of manure and straw and analysis of influencing factors[J]. Journal of Agro-Environment Science, 2011, 30(12):2594-2601.
[21]杨盛如,丁长河,王罗琳,等.氨纤维爆破法预处理木质纤维生物质原料[J].酿酒, 2010, 37(5):16-19. YANG Sheng-ru, DING Chang-he, WANG Luo-lin, et al. Research on lignocellulosic biomass pretreatment using AFEX[J]. Liquor Making, 2010, 37(5):16-19.
[22] Tartakovsky B, Cimpoia R, Petti L, et al. Biodegradation of spent pulping liquor lignins under mesophilic and thermophilic anaerobic conditions[J]. Tappi Journal, 2003, 2(4):26-32.
Biogas production of unhydrolyzed solid from corn stover hydrolysate by anaerobic digestion
CHEN Shi-ping1, TANG Xiao-yu2*, XIAO Ze-yi1*, WANG Wen-guo2, YIN Xiao-bo2, VENKATESH Balan3, WU Bo2, HU Qi-chun2
(1.School of Chemical Engineering, Sichuan University, Chengdu 610065, China; 2.Biogas Institute of Ministry of Agriculture, Chengdu 610041, China; 3.Department of Materials Science and Chemical Engineering, Michigan State University, Lansing 48910, USA)
Abstract:Biochemical conversion in lignocellulosic biorefineries generates large amount of solid residues(Unhydrolyzed solids, UHS). The UHS mainly contains carbohydrates and lignin. Anaerobic digestion could be applied to convert those carbohydrates into CH4and to naturally enrich lignin for further utilization, thus improving the economics of the whole biorefinery process. Here the methane production potential of UHS derived from corn stover biorefinery was investigated under different types of inoculum, diverse inoculum to substrate ratios(R(I/S))and various fermentation temperatures. Results indicated that the biogas productivity of UHS was higher when using kitchen waste AD slurry as inoculum, and the cumulative methane production was up to 208.06 mL·g(-1)VS. The cumulative methane production decreased with decrease in R(I/S). When R(I/S)was in range of 0.1:1 to 3:1, the cumulative methane production was between 111.20 to 224.48 mL·g(-1)VS and the UHS biodegradability ranged from 27.89% to 56.29%. The biodegradability of UHS decreased as substrate concentration increased. The cumulative methane production was similar at both 55℃and 35℃at the same R(I/S), but the biogas production rate was much higher at 55℃.
Keywords:corn stover; unhydrolyzed solild; anaerobic; methane; fermentation
*通信作者:汤晓玉E-mail:tangxiaoyu@caas.cn;肖泽仪E-mail:mgch@scu.edu.cn
作者简介:陈世平(1991—),男,贵州人,硕士研究生,从事生物质能源转化方面的研究。E-mail:chenshiping2010@163.com
基金项目:四川省科技计划项目(NO.2014HH0018);中国农业科学院科技创新工程(CAAS-ASTIP-2015-BIOMA)
收稿日期:2015-09-09
中图分类号:X712
文献标志码:A
文章编号:1672-2043(2016)03-0584-06
doi:10.11654/jaes.2016.03.023
