微波辐射法合成MIL-100Fe及提高其产率的研究
2016-04-21李雪梅广东省化学纤维研究所广东广州5045华南理工大学化学与化工学院广东广州50640
李雪梅,王 莎(.广东省化学纤维研究所,广东广州5045;.华南理工大学化学与化工学院,广东广州50640)
微波辐射法合成MIL-100Fe及提高其产率的研究
李雪梅1,王莎2
(1.广东省化学纤维研究所,广东广州510245;2.华南理工大学化学与化工学院,广东广州510640)
摘要:MIL-100Fe是金属骨架材料MOFs中一种,它具有环境友好、部分金属位不饱和等优势。目前文献对MIL-100Fe的报道多集中于其对气体分子的吸附和分离,而对其合成产率的关注则相对缺乏。对此,本文采用微波合成法,分别考察了微波反应时间、温度、不同原料的加入对其产率的影响,实验表明:当微波反应时间为90 ~ 120 min、微波反应温度为150 ~ 160℃时,都能反应得到MIL-100Fe晶体,其中120 min、160℃为最优;用与HF等摩尔量的NaF和硝酸代替氢氟酸加入到原料中进行反应,有助于大大提高MIL-100Fe晶体的产率,当原料中硝酸的摩尔比为2.4 ~ 3.2时,MIL-100Fe晶体的产率范围为45.13% ~ 55.03%,其中当硝酸摩尔比为2.6时最优,此时产率最高为55.03%,所得晶体结晶状态也最好。
金属有机骨架材料MOFs (Metal Organic Frameworks)是由过渡金属离子与有机连接体所形成的网状配位聚合物,是纳米多孔材料中的一类[1],如MOF-5是由Zn2+和对苯二甲酸聚合而成[2]、MOF-199 (HKUST-1)是由Cu2+和均苯三酸组装形成[3]、IRMOF-3则由Zn2+和2-氨基对苯二酸配位形成[4]。对比于传统多孔材料,如活性炭、沸石、分子筛等,MOFs材料一般具有比表面积大、吸附容量高、孔结构规整、热稳定性好、表面性质和孔结构可修饰等优势[5],因而具有广泛的应用价值,已成为近年来材料学研究的热点[6]。在众多的MOFs材料中,有一类MIL (materials of institute Lavoisier frameworks)系列材料,是由法国凡尔赛大学的Férey教授首先合成,其代表是具有分层孔结构的MIL-100 (由Cr3+和均苯三酸所连接生成,具有三种笼结构)[7],以及具有超高比表面积的MIL-101 (由Cr3+和对苯二酸配位而成,Langmuir比表面积可达5 900 m2/g)[8]。在MIL系列材料中有一种环境友好材料MIL-100Fe是由MIL-100衍生而来。由于其在合成时创造性地用Fe3+代替Cr3+,因而不含有有毒金属元素,对环境及人体的危害大大减少[9];而且人们通过研究发现,MIL-100Fe晶体中含有不饱和的金属位(CUS),可在孔中起到类似于路易斯酸的作用,因而对不饱和气体如一氧化碳、丙烯的选择性吸附具有很好的应用前景[10]。
MOFs材料的设计和合成,一直是纳米多孔材料领域面临的挑战之一,而MOFs材料合成产率的提高,则是其实际应用及工业化所急待解决的问题。针对MIL-100Fe,目前文献报道的合成方法主要有溶剂热合成法[8]和微波辐射合成法两种[9]。法国Férey教授实验组的Patricia H.等人采用溶剂热法合成MIL-100Fe,将原料按比例(Fe∶BTC∶H2O∶HF∶HNO3=1 : 0.66 : 280∶2∶1.2)加入聚四氟乙烯反应釜中后,要在150℃下反应6天才能得到MIL-100Fe晶体,因而反应时间过长,效率太低,不利于快速制得大量的MIL-100Fe晶体,而且对该条件下所合成的MIL-100Fe晶体的产率也缺乏报道[11];中国荆钰等人也用溶剂热法合成MIL-100Fe,所用的原料比率为Fe : BTC : H2O : HF: HNO3= 1 : 0.67 : 277 : 2 : 0.6,虽然在Patricia H.等人的基础上做了改进(温度提高为160℃),将反应时间缩短至8 h,但反应时间仍然很长,并且对MIL-100Fe晶体的产率也缺乏关注[12];韩国的Zubair H.等人采用微波辐射法合成MIL-100Fe晶体,所用的原料比率为Fe : BTC : H2O : HF : HNO3= 1 : 0.66 : 280 : 2 : 1.2,反应温度为180℃,反应时间为2 h,相对于Patricia H.和荆钰等人来说反应时间缩短了很多,但对晶体的产率依然缺乏报道[9]。
为了弥补MOFs研究领域对提高MIL-100Fe晶体产率的研究,针对未来MIL-100Fe实际应用的需要,本文采用微波合成法,分别考察了不同微波合成时间、温度以及不同种类原料的加入对MIL-100Fe产率的影响,并寻找出快速合成高产率MIL-100Fe晶体的办法。
1 实验部分
本实验中所用的主要化学试剂有:还原铁粉(≥98.0%),天津市科密欧化学试剂有限公司产品;均苯三酸(≥98.0%),美国Alfa Aesar公司产品;氟化钠(≥98.0%),天津富宇精细化工产品;氢氟酸(≥40.0%),广州化学试剂厂产品;硝酸(≥65.0%),江苏强盛化工产品;N’N-二甲基甲酰胺(≥99.5%),广东光华科技产品;无水乙醇(≥99.7%),天津富宇精细化工产品;氟化铵(≥96%),天津富宇精细化工产品;去离子水(100%),实验室自制。
1.2主要实验仪器
微波发生器(MARS5,美国CEM公司);电子天平(BP121S,德国Sartorius公司);高压反应釜(100 mL,巩义市予华仪器厂);定温干燥箱(EYEL4,东京理化器械株式会社);离心沉淀器(800型,上海手术器械厂);X射线衍射仪(Bruker D8,德国布鲁克公司);快速比表面积和孔径分布分析仪(美国Micromeritics公司)。
1.3MIL-100Fe的合成与纯化
采用控制变量法,通过实验分别考察微波反应时间、温度、加入原料种类和不同配比对MIL-100Fe晶体产率的影响。
SIN ROM把频率和相位寄存器的相位信息转换成幅度信息,从而在输出端产生正弦波信号。当mode(D1)bit清 0 和 OPBITEN(D5)bit清 0 的时候,VOUT引脚提供正弦波输出。
1.3.1微波反应时间对MIL-100Fe产率的影响
分别称取还原铁粉0.336 g,均苯三酸0.84 g,置于一干燥洁净的50 mL烧杯内;量取去离子水30 mL,倒入烧杯并将其置于50℃水浴中搅拌20 min;量取氟化氢0.53 mL,硝酸0.18 mL,逐滴加入。实验原料加入完后再在50℃水浴中搅拌10 min使原料充分溶解,实验中所用原料的摩尔比为Fe : H3BTC : H2O : HF : HNO3= 1 : 0.67 : 278 : 2 : 0.4[9-11]。将溶液转移至MARS5微波发生器100 mL反应釜中,密闭后放入微波发生器中进行反应。所采用的反应程序为:600 W 100%功率进行升温,升温速率50℃/min,由室温升温至150℃;保持150℃分别反应60 min,90 min,120 min,150 min,180 min(编号分别为1-1 #,1-2 #,1-3 #,1-4 #,1-5 #);采用300 W 100%功率进行降温,降温速率1℃/min,由150℃降至室温。
反应完成后,将产物转移至G1大孔沙星漏斗进行抽滤。取抽滤后的液体置于离心机中,以6 000 r / min离心20 min。倒掉离心后的上层液体,取下层橘黄色固体放入150 mL锥形瓶内,加入100 mL无水乙醇在60℃水浴条件下搅拌24 h,然后再进行离心。将离心后所得固体置于烘箱内干燥12 h,冷却至室温后转入100 mL高压反应釜内,加入适量30 mmol/L氟化铵水溶液,将反应釜密封后置于60℃条件下保持10 h,然后取出,冷却至室温并倒掉上层清液。将所得固体在150℃条件下干燥24 h,50℃条件下真空干燥10 h,然后冷却至室温并称量所得晶体的质量,计算其回收率,最后将所得晶体密封备用。
1.3.2微波反应温度对MIL-100Fe产率的影响
采用同1.3.1相同的方法将原料配成混合液,转移至MARS5微波发生器中进行反应,采用相同的功率和升温速率由室温分别升至140℃,150℃,160℃,170℃,180℃,190℃,200℃(编号分别为2-1 #,2-2 #,2-3 #,2-4 #,2-5 #,2-6 #,2-7 #)并保持反应120 min,采用相同的降温功率和速率降至室温。然后采用相同的纯化步骤进行纯化干燥,并称量所得晶体的质量,计算比较其回收率,最后所得晶体进行密封备用。
1.3.3原料加入种类和配比对MIL-100Fe产率的影响
采用同1.3.1相同的方法依次称取原料配比分别为Fe : H3BTC : H2O : HF : HNO3= 1 : 0.67 : 278 : 2 : ( 0.4,0.6,1.2 )(编号3-1#,3-2#,3-3#);Fe : H3BTC : H2O : NaF : HNO3= 1: 0.67 : 278 : 2 : ( 0.4,0.6,1.2,1.6,2,2.4,2.6,3.2,3.6,4,4.4,4.8)(编号分别为4-1#至4-12#号)的原料配成混合溶液,转移至MARS5微波发生器中进行反应,采用相同的升温方法升至160℃保持120 min,采用相同方法进行降温和纯化,然后称量不同硝酸和NaF配比条件下所得晶体质量,计算比较其回收率,所得晶体进行密封备用。
1.3.4产率的计算
本文中以铁的转换率来计算MIL-100Fe晶体的产率,计算公式如式(1):

其中,mMIL-100Fe表示实验中所得的MIL-100Fe晶体的质量;nFe表示原料中所加入的Fe的摩尔量;MMIL-100Fe表示MIL-100Fe的相对分子质量,MIL-100Fe的分子式为{Fe3O(H2O)2F}{C6H3(COO)3}2·14.5H2O[9,11],相对分子质量为914 g/mol。
2 实验结果与讨论
2.1微波反应时间对MIL-100Fe产率的影响

图1 不同微波反应时间下合成的MIL-100Fe 的XRD图比较
图1为微波反应不同时间下所得到的MIL-100Fe晶体的XRD图。由图1可以看出,随着微波时间的增加晶体的特征峰高度随之增加然后减小,微波反应时间为90 ~ 150 min时,都能得到较完美的MIL-100Fe晶体,其中在微波时间为120 min时晶体的4个特征峰(位置分别为3.4°,4.1°,10.3°,11°)最完美,说明此微波时间下晶体的结晶状态最好。
表1为5种不同的微波反应时间对MIL-100Fe晶体产率的影响。由表1我们可以看出从90 min到180 min随着微波时间的增加,反应所得到的晶体的质量也随之变化,相对应的产率也有增有减,在微波时间为120 min时所得晶体产率为13.68%,高于其相邻的90 min和150 min微波时间所得晶体的产率。
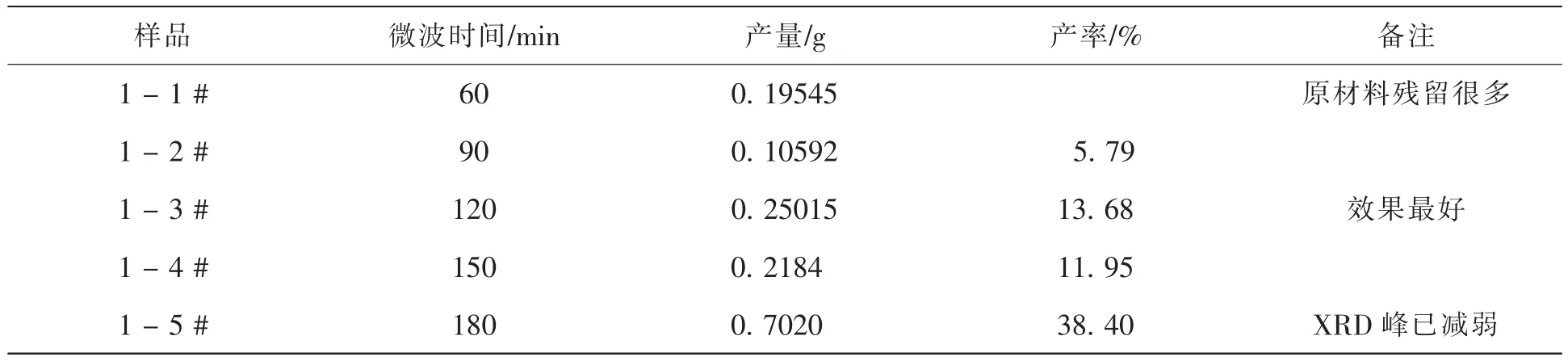
表1 不同微波时间下合成的MIL-100Fe晶体回收率比较
综合图1和表1我们可以得出结论:微波反应时间为90 ~ 150 min时都能得到较完美的MIL-100Fe晶体,产物产率先增后减,其中微波反应时间为120 min时所得到的晶体最完美,并且此时产物的产率最高。
2.2微波反应温度对MIL-100Fe产率的影响
图2为不同微波反应温度下所得到的MIL-100Fe晶体的XRD图。由图2可以看出,微波反应温度的不同,所得到的MIL-100Fe晶体的特征峰的高度也有所不同,并且在150 ~ 200℃温度范围内都能得到MIL-100Fe晶体,其中当微波反应温度为160℃时所得特征峰最优,说明此温度下晶体的结晶效果最好。
表2为7种不同的微波反应温度对MIL-100Fe晶体产率的影响。由表2我们可以看出,随着微波温度的上升,晶体产率也增加,160℃时产率为23.54%。但是当微波温度大于170℃时,所得的晶体产物中有铁被高温氧化后的黑色固体残留,不利于纯净晶体的回收。
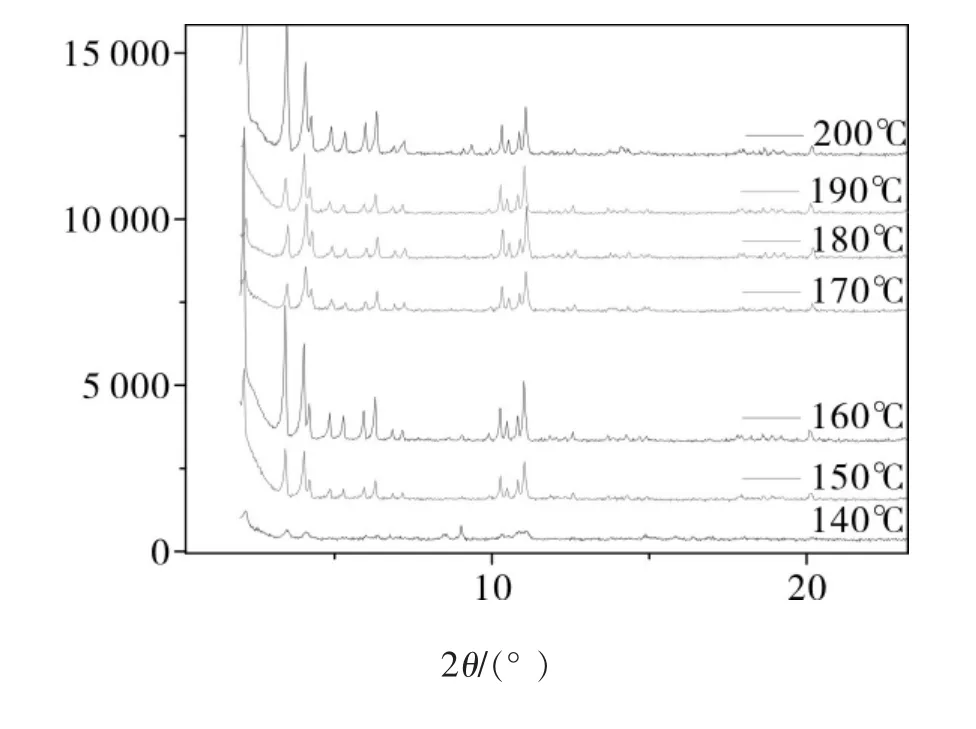
图2 不同微波反应温度下合成的MIL-100Fe的XRD图比较

表2 不同微波条件下合成的MIL-100Fe回收率比较
综合图2和表2我们可以得出结论:微波反应温度为150 ~ 200℃时都能得到MIL-100Fe晶体,但当微波反应温度大于160℃时会有黑色固体残留,不利于得到纯净的晶体;当微波反应温度为160℃时所得到的晶体最完美,并且此时晶体的产率最优。
2.3原料加入种类和配比对MIL-100Fe产率的影响
2.3.1硝酸的加入量对MIL-100Fe产率的影响。
图3为原料中加入不同摩尔配比的硝酸进行反应所得到晶体的XRD图。由图3可以看出,加入硝酸的摩尔比为0.4、0.6和1.2时都能得到MIL-100Fe晶体。

图3 不同HNO3摩尔配比下合成的MIL-100Fe 的XRD
表3为原料中加入不同摩尔配比的硝酸进行反应所得到的MIL-100Fe晶体的产率。由表3我们可以看出,硝酸加入量的增加有利于MIL-100Fe晶体产率的提高,这是因为硝酸加入量的增加有利于铁粉的溶解,从而有利于MIL-100Fe一级结构的形成[13]。

表3 不同HNO3摩尔配比下合成的MIL-100Fe回收率比较
2.3.2氟化钠的加入对MIL-100Fe晶体产率的影响

图4 用NaF时不同HNO3配比下合成的MIL-100Fe 的XRD
图4为用NaF代替HF溶液作为原料进行合成时,加入不同摩尔配比的硝酸进行反应所得到晶体的XRD图。由图我们可以看出,随着硝酸加入量的持续增加,所得到的MIL-100Fe晶体的特征峰的高度先增后减;当硝酸摩尔比为2.4 ~ 3.2时都能得到较好的MIL-100Fe晶体;当Fe : H3BTC : H2O : NaF : HNO3= 1 : 0.67 : 278 : 2 : 2.6时,MIL-100Fe的四个特征峰最优,此时晶体的结晶状态最好。
表4为用NaF代替HF溶液作为原料进行合成时,加入不同摩尔配比的硝酸进行反应所得到的MIL-100Fe晶体的产率。由表4我们可以看出,硝酸加入量的增加有利于MIL-100Fe晶体产率的提高,但当硝酸加入量过多时产率反而下降;当硝酸加入的摩尔比为2.4,2.6和3.2时,反应所得到的MIL-100Fe晶体的产率都较大,分别为45.13%,55.03%和54.38%,其中当Fe : H3BTC : H2O : NaF : HNO3= 1 : 0.67 : 278 : 2 : 2.6时,所得晶体的产率最大为55.03%。

表4 用NaF代替HF时不同HNO3配比下合成的MIL-100Fe回收率比较
2.3.3氟化氢和氟化钠分别作原料进行合成的比较
图5、图6为分别用HF和NaF做原料时,所得到的MIL-100Fe晶体的XRD图。从图5可以看出,当采用HF作为原料,并且原料中Fe : H3BTC : H2O : HF : HNO3= 1 : 0.67 : 278 : 2 : 1.2时,XRD图中的峰形较好,微波合成所得到的MIL-100Fe晶体生长完全;当采用NaF做原料时,并且原料中Fe : H3BTC : H2O : NaF : HNO3= 1 : 0.67 : 278 : 2 : 1.2时,XRD图中的特征峰没有出现,说明此时晶体生长不完全;当加入Fe : H3BTC : H2O : NaF : HNO3= 1 : 0.67 : 278 : 2 : 3.2时,则XRD图中的特征峰再次出现,说明此时生成了MIL-100Fe晶体。图6也证明了将HF换算成相等摩尔量的NaF进行反应时,多加入一定量的硝酸有利于MIL-100Fe晶体的生成。

图5 用HF和NaF时相同HNO3配比下合成的MIL-100Fe的XRD
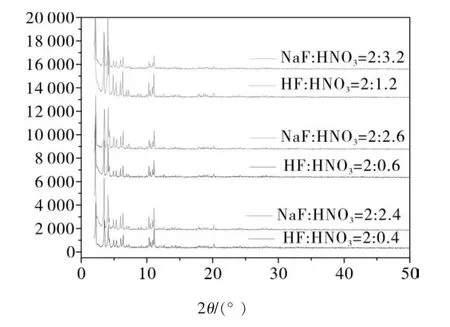
图6 用HF和NaF时对应HNO3配比下合成的MIL-100Fe的XRD
表5为分别用HF和NaF做原料时,反应所得到的MIL-100Fe晶体的产率。从表5中我们可以看出,当Fe : H3BTC : H2O : HF : HNO3= 1 : 0.67 : 278 : 2 : 1.2时,产率为47.05%,大于Fe : H3BTC : H2O : NaF : HNO3= 1 : 0.67 : 278 : 2 : 1.2时的产率24.07%,小于Fe : H3BTC : H2O : NaF : HNO3= 1 : 0.67 : 278 : 2 : 3.2时的产率54.38%;当Fe : H3BTC : H2O : HF : HNO3= 1 : 0.67 : 278 : 2 : 0.6时,产率为37.2%,大于Fe : H3BTC : H2O : NaF : HNO3= 1 : 0.67 : 278 : 2 : 0.6时的产率0,明显小于Fe : H3BTC : H2O : NaF : HNO3= 1 : 0.67 : 278 : 2 : 2.6时的产率55.03%;此规律同样适用于Fe : H3BTC : H2O : HF : HNO3= 1 : 0.67 : 278 : 2 : 0.4时的情况。
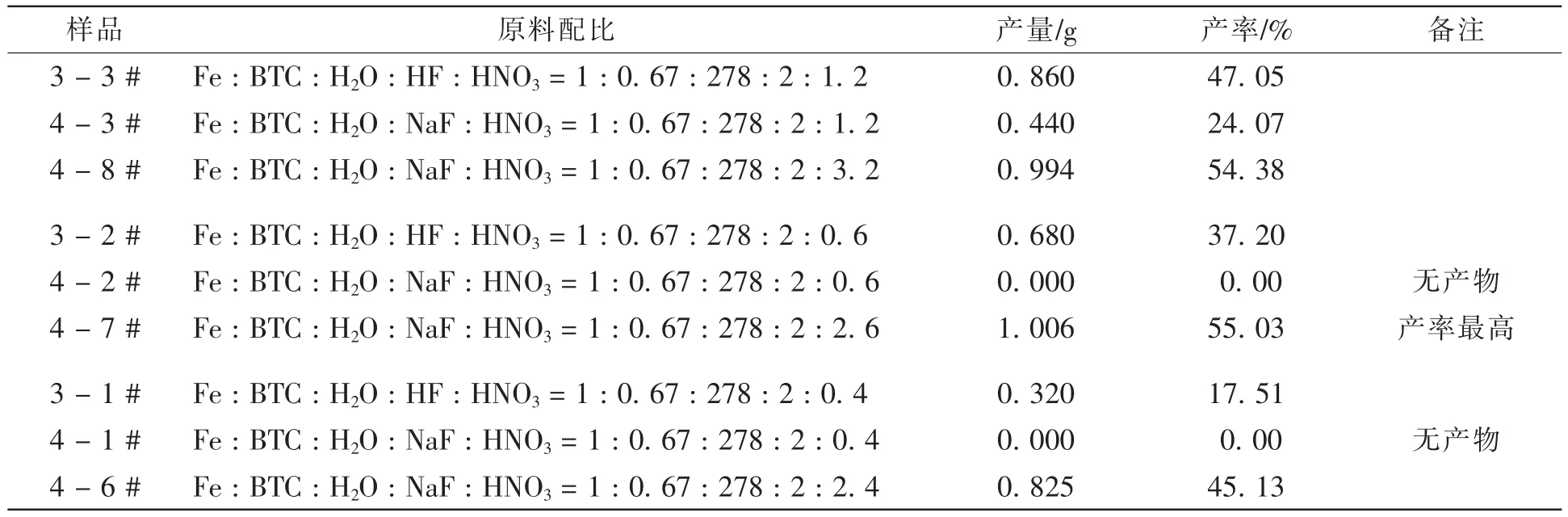
表5 用HF和NaF时不同HNO3配比下合成的MIL-100Fe回收率比较
由以上分析我们可以得出:只是将原料中的HF换算成相等摩尔量的NaF进行反应,而其他原料对应的摩尔量不变时,并不能有效提高MIL-100Fe晶体的产率,反而会不利于晶体的完全生长;将原料中的HF换算成相等摩尔量的NaF和硝酸来加入原料中进行反应时,则可以保证MIL-100Fe晶体在完全生长的同时,其产率也得到有效地提高。这是因为:NaF是一种可溶性的盐,将HF换算成相等摩尔量的NaF添加到原料中,相比较于HF溶液,可提供更充足的F-,从而促进了MIL-100Fe晶体一级结构的形成;将HF中的H换算成相等摩尔量的硝酸添加反应原料中,一方面消除了溶液中NaF的碱性,另一方面硝酸量的增加也确保了铁粉的充分反应溶解,也有利于MIL-100Fe一级结构的生成[13]。
3 结论
能够微波合成MIL-100Fe的反应时间范围为90 ~ 150 min,其中120 min为最优,此时得到的MIL-100Fe晶体结晶状态良好;微波反应的温度范围为150 ~ 160℃,其中160℃为最佳反应温度,此温度下晶体生长完美并且无黑色固体残留;原料的摩尔比范围为Fe : BTC : H2O : NaF : HNO3= 1 : 0.67 : 278 : 2 : (2.4 ~ 3.2),其中最佳原料配比为Fe : BTC : H2O : NaF : HNO3= 1 : 0.67 : 278 : 2 : 2.6,此时得到的MIL-100Fe晶体生长良好、产率最高,为55.03%;当微波反应时间为120 min,反应温度为160℃时,以上原料比率范围所得到的MIL-100Fe晶体的产率范围为45.13% ~ 55.03%。
实验中在加入原来硝酸量的基础上,用与HF相等摩尔量的NaF和硝酸代替氢氟酸加入到原料中,可以大大提高微波反应所得到的MIL-100Fe晶体的产率。这是因为一方面NaF的加入为MIL-100Fe晶体的形成提供了充足的F-,另一方面额外适量硝酸的加入在中和了NaF的碱性的同时,也有利于原料中铁粉的反应溶解,这也有利于MIL-100Fe晶体的生成。
参考文献
[1] O.M.Yaghi M O K,N.Ockwig,H.K.Chae,M.Eddaoudi,J.Kim.Reticular Synthesis and the Design of New Materials [J] .Nature,2003,42 (3): 705-714.
[2] N.Rosi M E,D.Vodak,J.Eckert,M.O'Keeffe,O.M.Yaghi.Hydrogen Storage in Microporous Metal-Organic Framewor ks [J] .Science,2003 (30): 1127-1129.
[3] Thomas K M,Xiao B,Wheatley P S,et al.Highcapacity hydrogen and nitric oxide adsorption and storage in a metal-organic framework [J] .J Am Chem Soc,2007,129(5): 1203-1209.
[4] William Morris R E T,C.Dybowski,Omar M.Yaghi,Miguel A.Garcia-Garibay.Framework mobility in the metal–organic framework crystal IRMOF-3: Evidence for aromatic ring and amine rotation [J].J Mol Struct,2011,1004(3): 94-101.
[5] Zhenxia Zhao X L,Sisi Huang,Qibin Xia,and Zhong Li.Adsorption and Diffusion of Benzene on Chromium-Based Metal Organic Framework MIL-101 Synthesized by Microwave Irradiation [J].Ind Eng Chem Res,2011(50): 2254-2261.
[6] Jinyu W W F J K H H.Synthesis and Applications for Materials of Metallorganic Frameworks [J] .Prog Chem,2005,17(6): 1110-1115.
[7] Férey G S,C.; Mellot-Draznieks,C.; Millange,F.; Surblé,S.; Dutour,J.; Margiolaki,I.A Hybrid Solid with Giant Pores Prepared by a Combination of Targeted Chemistry,Simulation,and Powder Diffraction [J] .Angew Chem Intl Ed,2004,43 (46): 6296-6301.
[8] G.Ferey C M-D,C.Serre,et al.A Chromium Terephthalate–Based Solid with Unusually Large Pore Volumes and Surface Area [J] .Science,2005,309 (5743) : 2040-2042.
[9] Hasan Z,Jeon J,Jhung S H.Adsorptive removal of naproxen and clofibric acid from water using metalorganic frameworks [J] .J Hazard Mater,2012,209(21): 151-157.
[10] Leclerc H,Vimont A,Lavalley J-C,et al.Infrared study of the influence of reducible iron (iii) metal sites on the adsorption of CO,CO2,propane,propene and propyne in the mesoporous metal–organic framework MIL-100 [J] .Phys Chem Chem Phys,2011,13(24): 1174-1178.
[11] Horcajada P,Surbl S,Serre C,et al.Synthesisand catalytic properties of MIL-100 (Fe),an iron ( iii) carboxylate with large pores [J] .Chem Commun,2007,27(27): 2820-2822.
[12]荆钰,郭金涛,王重庆,马正飞.金属有机骨架材料MIL-100Fe的一氧化碳吸附性能[J].天然气化工,2011,36(5): 33-36.
国外动态
[13] Vimont A,Goupil J M,Lavalley J C,et al.Investigation of acid sites in a zeotypic giant pores chromium (III) carboxylate [J] .J Am Chem Soc,2006,128(10): 3218-3227.
YIELD IMPROVEMENT OF MIL-100Fe,AN IRON-BASED METAL ORGANIC FRAMEWORK SYNTHESIZED BY MICROWAVE IRRADIATION
LI Xue-mei1,WANG Sha2
(1.Guangdong Chemical Fiber Institute,Guangzhou 510245,China; 2.School of Chemistry and Chemical Engineering,South China University of Technology,Guangzhou 510641,China)
Abstract:MIL-100Fe,featured by its environmental friendship and accessible partial unsaturated metal sites,is one of the most eye-catching nanomaterials among MOFs.The present researches about MIL-100Fe are mainly focused on the adsorption and separation of gas molecules,and studies concerning the yield are relatively insufficient.In this article,the impacts of microwave time,temperature and feedstock proportion on yield have been investigated.The result illustrates that,the suitable time and temperature ranges for microwave synthesis are 90 ~ 120 min,150 ~ 160℃respectively,among which 120 min and 160℃are optimal; the substitution of hydrogen fluoride by isometric sodium fluoride and nitric acid can contribute to the improvement of yield percentage.When the molar ratio of nitric acid ranges from 2.4 to 3.2,MIL-100Fe yields 45.13% ~ 55.03%.When the ratio equals to 2.6,the highest yield percentage and best crystalline state of MIL-100Fe can be got.
Keywords:MIL-100Fe,microwave synthesis,yield,MOFs
作者简介:李雪梅(1987-),女,四川简阳人,硕士,从事功能性材料的研究工作。
文章编号:1672-500X (2016) 01-0009-08
中图分类号:O647.31
文献标志码:A
doi:10.3969/j.issn.1672-500x.2016.01.003
关键字:金属有机骨架材料;产率;微波合成
投稿日期:2015-12-28
