PPARγ激活物对缺氧缺血性脑损伤大鼠神经行为学功能的影响
2016-04-21张焕新
李 萌 张 靖 张焕新
(南阳市中心医院,河南 南阳 473000)
PPARγ激活物对缺氧缺血性脑损伤大鼠神经行为学功能的影响
李萌张靖张焕新
(南阳市中心医院,河南南阳473000)
〔摘要〕目的探讨激活过氧化物酶体增殖物激活受体(PPAR)γ对缺氧缺血性脑损伤(HIBI)大鼠神经行为学功能的影响。方法80只成年SD大鼠随机分为假手术组、HIBI组、曲格列酮(TGZ,PPARγ激动剂)组和GW9662(PPARγ抑制剂)组。采用RICE法制备HIBI模型后,TGZ组和GW9662组分别于HIBI后腹腔注射20 mg/kg TGZ或10 mg/kg GW9662。采用早期神经反射分析术后2、4、7 d的悬崖调转、阴性趋地性反射和步态时间,步迹分析术后14 d手术同侧、对侧的步长和趾间距,Morris水迷宫分析术后21 d的游泳距离和逃避潜伏期,干湿质量法测定术后2、4、7 d的脑组织含水量,免疫组化检测术后28 d损伤脑组织中脑神经相关生长蛋白(GAP)-43表达。结果与假手术组比较,HIBI组早期神经反射相关时间指标均延长,手术对侧步长和趾间距及Morris水迷宫的游泳距离、逃避潜伏期和站台所在象限停留时间均缩小,脑组织含水量升高,且GAP-43阳性细胞减少(P<0.05)。TGZ可改善HIBI大鼠的以上异常指标(P<0.05),但与假手术组仍有显著差异(P<0.05);HIBI大鼠以上异常指标经GW9662处理后进一步恶化。结论激活PPARγ可改善HIBI导致的大鼠神经行为学功能异常,减轻脑水肿并促进损伤脑细胞的恢复。
〔关键词〕过氧化物酶体增殖物激活受体γ;缺氧缺血性脑损伤;神经行为学
缺氧缺血性脑病(HIE)目前尚无特效方法治疗,神经系统损伤的主要特征为神经元损害,而常用药物及低温疗法对于损伤神经结构的功能恢复较为局限,故急需探讨新治疗手段。过氧化物酶体增殖物激活受体(PPAR)是一组配体激活的转录因子受体,包括3种不同的亚型,其中PPARγ已证实具有较好的神经保护作用〔1~3〕,因此推测PPARγ激活剂对于HIE引起的神经损伤有一定保护作用。本研究拟采用PPARγ经典激活剂曲格列酮(TGZ)处理缺氧缺血性脑损伤(HIBI)大鼠,观察对其神经行为学功能的影响。
1材料与方法
1.1动物分组80只成年Sprague-Dawley雄性大鼠(体重180~250 g)购自购自上海斯莱克实验动物中心,适应性饲养3 d后随机分为假手术组、HIBI组、TGZ(PPARγ激动剂)组和GW9662(PPARγ抑制剂)组各20只。采用RICE法制备HIBI模型6 h后,TGZ组和GW9662组分别于HIBI后腹腔注射20 mg/kg TGZ或10 mg/kg GW9662,1次/d,连续给药7 d。所有大鼠均采用国家标准啮齿类动物饲料饲养,人工控制光照(光照时间为09:00~21:00),环境温度22℃~26℃,相对湿度45%~55%,可自由进食进水。
1.2HIBI动物模型制备采用RICE法制备HIBI模型〔4〕,操作步骤简述如下:乙醚吸入麻醉1~2 min后仰卧,切开颈部正中皮肤,行左颈总动脉分离,用5号灭菌双道线结扎后切断,术后恢复2 h后置于缺氧箱中,吸入8%氧与92%氮气的混合体90 min(气体流量为5 L/min)。假手术组仅分离左侧颈总动脉,不行结扎且不吸入氮氧混合气体。
1.3神经反射分析每组随机取8只大鼠均于术后2、4、7 d评估发育神经反射情况。 (1)悬崖调转反射:大鼠前爪从木板边缘退回或调转头部所需的时间;(2)阴性趋地性:将大鼠的头面朝向下方,放置在倾斜角为45°的平整木板上(长30 cm),记录大鼠倒转 180°所需时间;(3)步态:将大鼠放置在直径为13 cm的白色圆纸中央,记录两侧前爪爬出圆纸的时间。以上时间均以秒(s)为计时单位,时间越长评分越差。
1.4步迹分析每组随机取8只大鼠于术后14 d进行足迹分析。将大鼠脚爪连续染色,当其沿被抬高的跳板行走时,足迹印在纸上。对纸上每一个印记进行测量分析,将手术同侧或对侧后爪第1个脚趾和第5个脚趾之间的距离计为趾间距,将每个爪之间的距离计为步长。
1.5Morris水迷宫实验每组随机取8只大鼠于术后21 d进行Morris水迷宫实验,Morris 水迷宫由圆形水池(直径110 cm、高度60 cm、水深35 cm)、摄像头及分析系统组成,将水池分为1、2、3、4共四个象限,任选一象限正中放置平台(水面必须高于站台2 cm),训练时随机选取一个象限入水点处面向池壁将大鼠放入水中,每个时间段从 4个不同的入水点入水,记录大鼠从入水点入水至爬上水下平台的时间(逃避潜伏期),同时记录游泳距离和站台所在象限停留时间。
1.6干湿质量法采用干湿质量法测定脑组织含水量,每组取12只于术后2、4、7 d断头处死大鼠(每个时间点取4只),在冰盘上迅速开颅取脑,剔除嗅球、小脑和低位脑干,称取大脑湿重,于110℃恒温干燥箱内干燥24 h至恒重,称干重后按Elliot公式计算脑含水量:脑含水量=(脑湿重-脑干重)/脑湿重×100%。
1.7免疫组化每组取8只大鼠应用免疫组化检测术后28 d损伤脑组织中脑神经相关生长蛋白-43(GAP-43)表达。将大鼠处死后,开颅取脑,依次经4%多聚甲醛固定、脱水、石蜡包埋、冠状切片(厚约3 μm),采用GAP-43一抗进行免疫组化染色。每个样本选取5个高倍视野,计数GAP-43的阳性细胞数,GAP-43阳性信号表现为点状或颗粒样棕褐色免疫反应产物。
1.8统计学处理采用SPSS16.0软件进行单因素方差分析、SNK-q检验。
2结果
2.1激活PPARγ对HIBI大鼠早期神经反射的影响
2.1.1悬崖调转时间与假手术组相比,HIBI组术后2、4、7 d的悬崖调转时间均延长(P<0.05),PPARγ激活剂TGZ可缩短HIBI大鼠的悬崖调转时间,但经PPARγ抑制剂GW9662处理后进一步延长,与HIBI组的差异均有统计学意义(P<0.05)。见图1A。
2.1.2 阴性趋地性反射时间4组术后2 d阴性趋地性反射时间的差异均无统计学意义(P>0.05)。与假手术组相比,HIBI组术后4、7 d的阴性趋地性反射时间均延长,差异有统计学意义(P<0.05),PPARγ激活剂TGZ可缩短HIBI大鼠的阴性趋地性反射时间,但经PPARγ抑制剂GW9662处理后进一步延长,与HIBI组的差异均有统计学意义(P<0.05)。见图1B。
2.1.3步态时间HIBI组、TGZ组术后2 d的步态时间与假手术组的差异无统计学意义(P>0.05)。与假手术组相比,HIBI组术后4、7 d的步态时间均延长(P<0.05),PPARγ激活剂TGZ可缩短HIBI大鼠的步态时间,但经PPARγ抑制剂GW9662处理后进一步延长,与HIBI组的差异均有统计学意义(P<0.05)。见图1C。
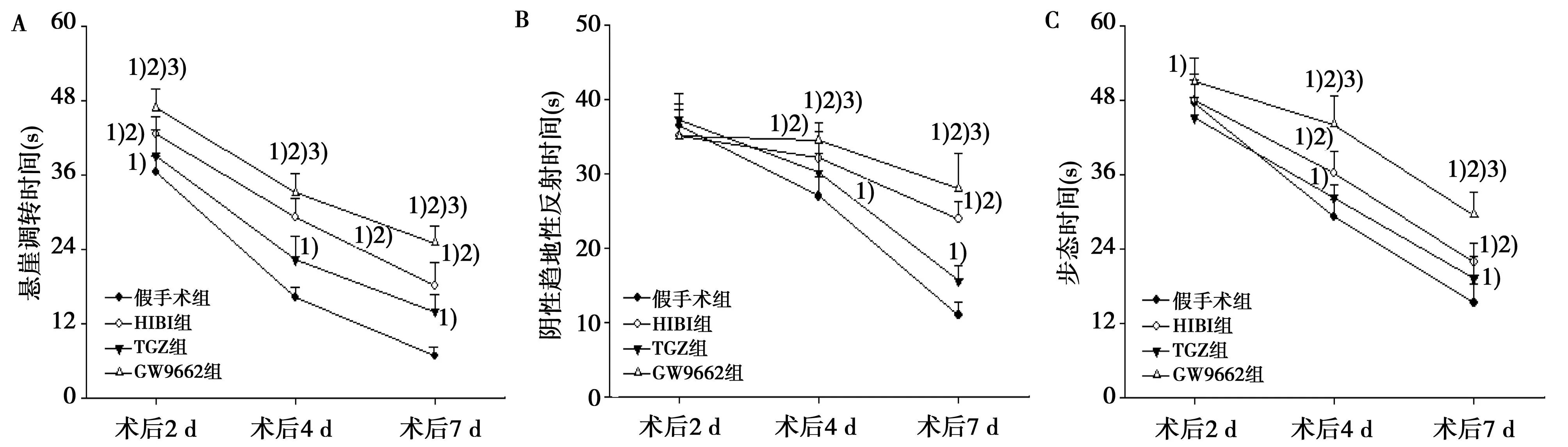
与假手术组比较:1)P<0.05;与HIBI组比较:2)P<0.05;与TGZ组比较:3)P<0.05图1 激活PPARγ对HIBI大鼠早期神经反射的影响
2.2激活PPARγ对HIBI大鼠步迹的影响4组手术同侧步长和趾间距的差异均无统计学意义(P>0.05)。与假手术组相比,HIBI组手术对侧步长和趾间距均缩小(P<0.05),PPARγ激活剂TGZ可增加HIBI大鼠的手术对侧步长和趾间距,但PPARγ抑制剂GW9662可进一步缩小手术对侧步长和趾间距,与HIBI组的差异均有统计学意义(P<0.05)。见表1。
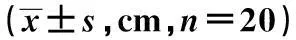
表1 激活PPARγ对HIBI大鼠步长和趾间距的
与假手术组比较:1)P<0.05;与HIBI组比较:2)P<0.05;与TGZ组比较:3)P<0.05,下表同
2.3激活PPARγ对HIBI大鼠空间运动记忆的影响与假手术组相比,HIBI组的站台所在象限停留时间缩小(P<0.05),PPARγ激活剂TGZ可增加HIBI大鼠的上述指标,但PPARγ抑制剂GW9662可进一步缩小上述指标,与HIBI组的差异均有统计学意义(P<0.05)。见表2。
2.4激活PPARγ对HIBI大鼠脑组织水肿程度的影响与假手术组相比,HIBI组术后脑组织的含水量均升高(P<0.05),PPARγ激活剂TGZ可降低HIBI大鼠的脑组织含水量,但经PPARγ抑制剂GW9662处理后进一步增加,与HIBI组的差异均有统计学意义(P<0.05)。见表3。
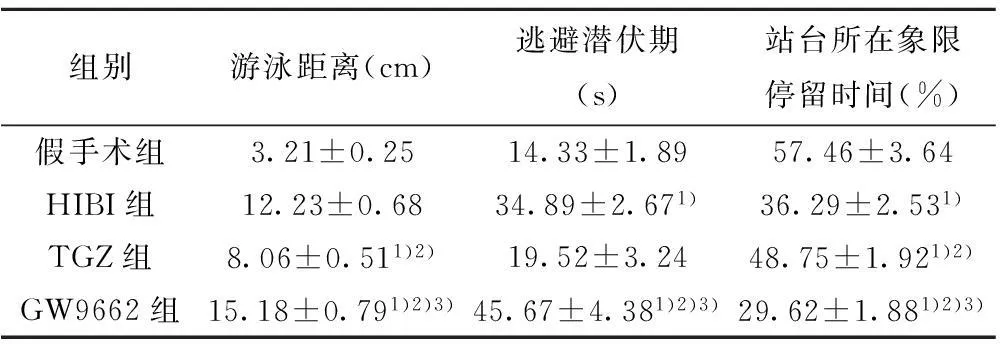
表2 激活PPARγ对HIBI大鼠空间运动记忆的影响

表3 激活PPARγ对HIBI大鼠脑组织含水量的
2.5激活PPARγ对HIBI大鼠脑组织GAP-43表达的影响HIBI组、TGZ组和GW9662组的GAP-43阳性细胞数分别为(20.1±1.2)、(28.3±2.0)和(12.6±1.7)个/cm2,均低于假手术组的(36.2±2.5)个/cm2(P<0.05);与HIBI组相比,TGZ组的GAP-43阳性细胞数升高,而GW9662组的降低(P<0.05)。见图2。
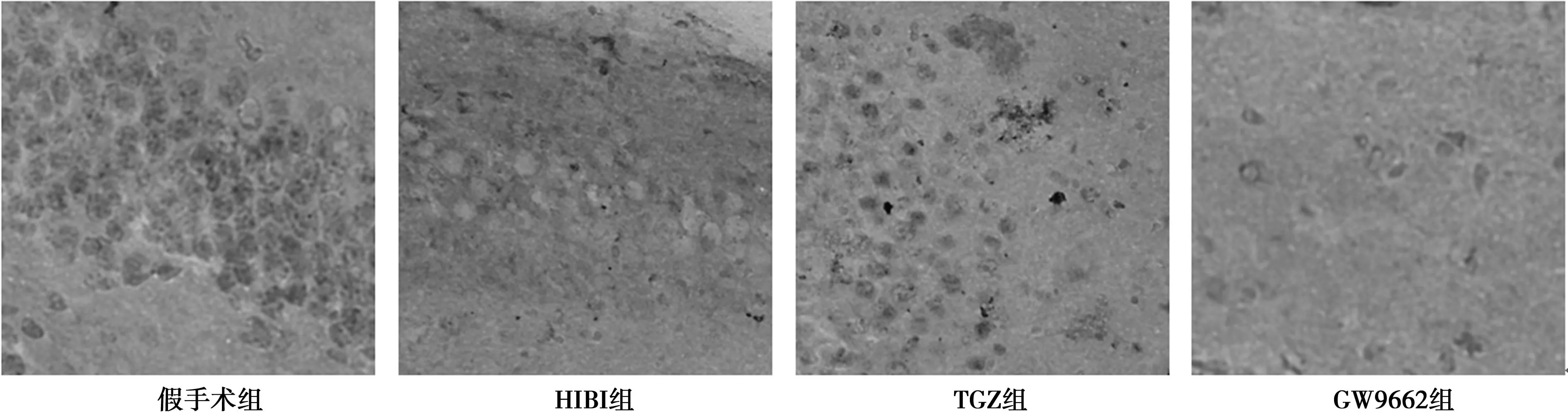
图2 各组大鼠脑组织GAP-43表达的免疫组化染色(SP ×400)
3讨论
神经行为是一个极其复杂的过程,由神经网络精密调控,此过程的强弱与准确受中枢神经系统的调控〔5〕。HIE是新生儿高发疾病,致死率高,严重影响了患儿的生活质量,如患儿常遗留运动发育异常、智力低下及脑瘫等后遗症。目前HIE治疗的重点是促进受损神经元的功能恢复,但疗效较为局限,仅能局部改善症状。PPARγ目前已证实具有神经保护作用,可促进神经元存活,如去除PPARγ后神经元对缺血的耐受降低〔6〕,而采用TGZ激活PPARγ可提高大鼠运动神经元的存活率,减少大脑中动脉梗阻脑缺血模型的梗死面积,阻止神经元的凋亡和氧化应激〔7〕。鉴于促进神经元新生及功能恢复是HIE治疗的关键,本研究推测激活PPARγ对HIBI大鼠神经行为学功能可能发挥保护作用。神经行为学缺陷是HIE后遗症的常见表现,如对侧肢体痉挛性偏瘫和缩短的步距〔8〕。本研究提示HIBI大鼠出现明显的学习记忆能力损伤。此外,HIBI大鼠右侧肢体出现明显的偏瘫症状。TGZ组治疗后的偏瘫表现及记忆功能较HIBI组大鼠明显改善,表明激活PPARγ可对HIBI术后的偏瘫表现及记忆功能损伤有较好改善效果,而给予GW9662处理后HIBI大鼠的以上指标出现明显恶化趋势,进一步验证了PPARγ在改善HIBI所致神经行为学缺陷的重要意义,但潜在机制尚不清楚,多项研究认为可能通过多种途径减轻了神经元本身损伤所致的有害效应。以上机制可能包含如下途径:(1)PPARγ激活可稳定线粒体活性,改善了缺血缺氧导致的氧化应激,同时激活PPARγ可上调抗凋亡蛋白表达,利于阻止神经元凋亡,促进了神经元存活〔7,9〕;(2)缺血缺氧可引起中枢神经元损伤,而神经轴索的再生能力有限,PPARγ激活可增强和刺激轴索生长,进一步促进了神经功能的恢复〔10〕;(3)胶质细胞属于高反应性细胞,而缺血缺氧可刺激其释放损伤因子并介导炎症反应,PPARγ激活可抑制胶质细胞的功能,为神经元再生及存活提供良好环境〔11,12〕。
Morris水迷宫是评估啮齿类动物学习记忆功能的重要工具〔13〕。本研究提示HIBI大鼠出现了学习记忆功能障碍。采用TGZ 激活PPARγ后,HIBI大鼠的相关指标获显著改善,表明激活PPARγ对于缓解缺血缺氧导致的学习记忆功能障碍亦有较好的保护作用,可能是多种机制共同参与的结果。本研究同时发现TGZ 处理后HIBI大鼠的脑水肿症状及脑组织GAP-43表达获改善,从多方面证实了激活PPARγ在缺氧缺血性脑损伤中的保护效果。
4参考文献
1肖智勇.脑损伤大鼠周围血肿形态组织学特征及其 PPARα的表达〔J〕.中国老年学杂志,2015;35(1):187-9.
2周杰,杨晓亮,荔志云,等.PPAR激活物对颅脑损伤的神经保护作用研究进展〔J〕.中华神经医学杂志,2014;13(9):965-8.
3Fuenzalida K,Quintanilla R,Ramos P,etal.Peroxisome proliferator-activated receptor gamma up-regulates the Bcl-2 anti-apoptotic protein in neurons and induces mitochondrial stabilization and protection against oxidative stress and apoptosis〔J〕.J Biol Chem,2007;282(51):37006-15.
4黄会芝,温晓红,刘惠,等.人脐血单核细胞移植对缺氧缺血性脑损伤新生大鼠远期神经行为学功能发育的影响〔J〕.中华儿科杂志,2013;51(6):460-6.
5Zhang W,Liu J,Hu X,etal.n-3 Polyunsaturated fatty acids reduce neonatal hypoxic/ischemic brain injury by promoting phosphatidylserine formation and Akt signaling〔J〕.Stroke,2015;46(10):2943-50.
6Han J,Sun L,Xu Y,etal.Activation of PPARγ by 12/15-lipoxygenase during cerebral ischemia-reperfusion injury〔J〕.Int J Mol Med,2015;35(1):195-201.
7Luo Y,He Q,Kuang G,etal.PPAR-alpha and PPAR-beta expression changes in the hippocampus of rats undergoing global cerebral ischemia/reperfusion due to PPAR-gamma status〔J〕.Behav Brain Funct,2014;10(1):21.
8Douglas-Escobar MV,Heaton SC,Bennett J,etal.UCH-L1 and GFAP serum levels in neonates with hypoxic-ischemic encephalopathy:A Single Center Pilot Study〔J〕.Front Neurol,2014;5:273.
9Dentesano G,Serratosa J,Tusell JM,etal.CD200R1 and CD200 expression are regulated by PPAR-γ in activated glial cells〔J〕.Glia,2014;62(6):982-98.
10边立忠,张冬梅,柳梅,等.兔脑缺血再灌注后PPARγ表达对神经元凋亡的影响〔J〕.临床医学工程,2012;19(9):1472-4.
11Khoo NK,Hebbar S,Zhao W,etal.Differential activation of catalase expression and activity by PPAR agonists:implications for astrocyte protection in anti-glioma therapy〔J〕.Redox Biol,2013;1:70-9.
12田中秋.PPARγ激动剂TGZ通过JNK通路促进海马神经元轴突生长机制研究〔D〕.承德医学院,2014.
13赵莉,刘德山,李旭阳,等.脑神康对糖尿病大鼠脑功能减退的预防作用〔J〕.中国老年学杂志,2013;33(24):6193-5.
〔2015-11-10修回〕
(编辑滕欣航)
〔中图分类号〕R74
〔文献标识码〕A
〔文章编号〕1005-9202(2016)07-1582-03;
doi:10.3969/j.issn.1005-9202.2016.07.020
第一作者:李萌(1985-),女,护师,主要从事新生儿临床研究。
