草鱼不同混养模式的上覆水、间隙水及沉积物中各形态碳的分布特征*
2016-04-20熊莹槐董双林
熊莹槐, 王 芳**, 陈 燕, 董双林, 刘 峰
(1. 中国海洋大学教育部海水养殖重点实验室, 山东 青岛 266003; 2. 山东省淡水渔业研究院, 山东 济南 250000 )
草鱼不同混养模式的上覆水、间隙水及沉积物中各形态碳的分布特征*
熊莹槐1, 王芳1**, 陈燕1, 董双林1, 刘峰2
(1. 中国海洋大学教育部海水养殖重点实验室, 山东 青岛 266003; 2. 山东省淡水渔业研究院, 山东 济南 250000 )
摘要:设定3种草鱼(Ctenopharyngodon idellus)混养模式:草鱼、鲢和鳙混养(GSB),草鱼、鲢、鳙和凡纳滨对虾混养(GSBL),草鱼、鲢、鳙和鲤混养(GSBC)。于2013年4—9月采集不同混养池塘的上覆水和底泥样品,分析上覆水、表层间隙水及沉积物中各形态碳的含量及相关关系。研究显示:(1)不同混养池塘表层间隙水中DOC和DIC含量显著高于上覆水(P<0.05),DOC和DIC含量在GSB、GSBC组中于8月出现最大值,而在GSBL组中于7月出现最大值;上覆水DOC和DIC含量在不同模式中的变化规律与表层间隙水基本一致。(2)上覆水和表层间隙水中DOC含量整体均表现为GSBC>GSBL>GSB, DIC含量整体均表现为GSBC>GSB>GSBL,各组间的DOC和DIC含量在8月的差异显著(P<0.05);表层沉积物TOC和TIC含量则整体均表现为GSB>GSBL>GSBC,在8、9月各组间TOC差异显著(P<0.05),而6、7月GSB组的TIC显著高于其它2组(P<0.05)。(3)间隙水DOC、DIC和沉积物TOC、TIC垂直分布规律与养殖模式关系密切:总体而言,GSB、GSBL组仅在0~2cm变化明显;GSBC组在0~2和2~4cm均有明显变化,且2层含量在养殖中后期较接近。(4)上覆水DOC 和DIC含量之间呈极显著正相关关系(P<0.01);上覆水DOC与表层间隙水DOC呈极显著正相关关系(P<0.01),与表层沉积物TOC也呈正相关关系,但相关性不显著;上覆水DIC与表层间隙水DIC呈显著正相关关系(P<0.01),而与表层沉积物TIC呈显著负相关关系(P<0.01)。间隙水及底泥中各形态碳含量的垂直分布特征主要受生物扰动作用的影响,其次是扩散作用。GSBC模式中间隙水及底泥中各形态碳含量受生物扰动作用影响最明显,GSBL模式次之。
关键词:主养草鱼池塘; 上覆水; 间隙水; 沉积物; DOC; DIC; TOC; TIC
XIONG Ying-Huai, WANG Fang, CHEN Yan, et al. Study on distribution of different carbon forms in overlying and sediment interstitial waters in different grass carp polyculture models [J].Periodical of Ocean University of China, 2016, 46(3): 22-30.
人类排放CO2等温室气体导致全球气温的升高[1-2],这已经成为人类面临的主要挑战。因此,研究各生态系统碳循环过程和转化机理已成为全球变化和区域可持续发展研究中的热点,同时也是当前大型国际合作科学研究计划的核心内容[3-4]。目前,国内外学者已对海洋碳库、大气碳库以及森林生态系统、草原生态系统等碳库进行了大量研究[5-11]。尽管淡水水域面积仅占陆地面积的2%,但其在全球碳循环中的地位极其重要[12-13]。然而,有关养殖池塘碳循环方面的研究鲜有报道。
沉积物-水界面存在的自养和异养微生物影响着营养物质的短暂储存和释放[14],是池塘水体物质物理、化学和生物作用藕合的主要场所[15]。另外,沉积物有机质富集是养殖池塘的重要特征,有机质的分解将驱动营养物质的释放,其主要机制在于自身的矿化与底层厌氧状态的形成[16],而一定程度的生物扰动作用可以充分改变沉积物的物理、化学和生物特性,影响池塘底部生物群落的结构和演化[17-20],进而影响整个水体和沉积物间的物质平衡。因此,开展养殖池塘沉积物-水界面碳分布特征的研究,探讨上覆水与表层间隙水、沉积物中各形态碳的变化规律,对于了解池塘养殖系统的碳循环过程有着十分重要的意义。
草鱼(Ctenopharyngodonidellus)为典型的草食性鱼类,是中国淡水养殖规模最大的品种,具有饲养技术简单、适应力强等特点。目前,山东省内陆池塘草鱼的养殖模式除了传统的草鱼、鲢(Hypophthalmichthysmolitrix)、鱅(Aristichthysnobilis)、鲤(Cyprinuscarpio)等大宗淡水鱼类混养外,近几年还出现了草、鲢、鱅和凡纳滨对虾(Litopenaeusvannamei)混养模式[21]。但有关这些混养模式下沉积物-水界面各形态碳的分布特征研究尚未见报道。为了更好地了解中国淡水池塘生态系统碳循环过程及养殖生物对碳循环的影响,本文研究了以草鱼为主养品种,3种混养模式下上覆水、表层间隙水及沉积物中各形态碳含量随养殖时间的变化规律,探讨上覆水与表层间隙水、沉积物中碳含量的相关关系,以期为未来深入开展淡水池塘碳循环过程的研究奠定基础,为更全面的评价养殖结构提供参考。
1材料与方法
1.1 实验池塘与设计
实验于2013年4—9月在山东省淄博市高青县水产局示范场进行。池塘规格基本一致,面积为0.25hm2,深度为(1.8±0.5) m。
实验样品取自草鱼3种养殖模式:草鱼、鲢和鳙(GSB),草鱼、鲢、鳙和凡纳滨对虾(GSBL),草鱼、鲢、鳙和鲤(GSBC)混养。每种养殖模式分别在3口池塘中进行,养殖生物的放养情况见表1,草鱼、鲢、鳙和鲤于2013年4月中旬放入池塘,凡纳滨对虾于6月中旬放入。
1.2 实验方法
整个实验过程中,共采集6次样品,每30天为一个采样周期。于3种混养模式采集直径5cm,高度在10~15cm的带有上覆水的无扰动沉积物样品(采用王友绍等[22]设计的无扰动沉积物采集器,D=5 cm,H=33cm),采样点为池塘一条对角线上的3个点,每次采样点固定不变。
将最表层高度7cm的底泥分为3层:0~2, 2~4及4~7cm。上覆水用Whatman滤膜过滤,上清液加入HgCl2固定,保存于30mL白色玻璃瓶中,在-20℃下冷冻保存待分析。分离后的底泥样品进行恒温离心(5 000r/min,15min),间隙水上清液加入HgCl2固定,保存于10mL冷存管中,在-20℃下冷冻保存待分析。实验结束时的底泥经风干、研磨,过100目筛后干燥保存。
水样中可溶性无机碳(DIC)和可溶性有机碳(DOC)使用TOC分析仪测定,泥样中总有机碳(TOC)和总无机碳(TIC)使用元素分析仪(Vario ELⅢ,德国)测定。

表1 不同养殖模式下养殖生物放养情况(平均值±标准差)
注: 字母 G、S、B、L、C依次代表草鱼、鲢、鳙、凡纳滨对虾和鲤。
Note: The letters G, S, B, L and C represent grass carp, silver carp, big head,L.vannameiand carp, respectively.
①Breed; ②Ctenopharyngodonidellus; ③Density; ④Individual weight; ⑤Hypophthalmichthysmolitrix; ⑥Aristichthysnobilis; ⑦Litopenaeusvannamei; ⑧Cyprinuscarpio
1.3数据处理
采用SPSS 19.0软件进行数据统计分析,不同养殖模式上覆水与表层间隙水、沉积物各形态碳含量做单因素方差分析(One-way ANOVA),通过Duncan比对以比较单月内不同养殖模式间的差异,方差分析前先进行方差齐性检验。以P<0.05作为差异显著水平。用Pearson相关分析法,得到各月上覆水与表层间隙水、沉积物各形态碳含量之间的相关系数,以P<0.01作为极显著相关,P<0.05作为显著相关。
2结果
2.1上覆水与间隙水DOC的分布特征
上覆水DOC分布规律(见图1):整体而言,随着养殖时间的推移,各组DOC浓度在5—8月呈上升的趋势,9月有所下降。养殖初始DOC浓度差异较小,而8月各模式下DOC浓度增加了2~3倍(4月DOC含量为1.58~3.39mg/L,8月DOC含量为4.25~9.33mg/L)。就养殖模式而言,GSB组随时间变化趋势较为平缓,而GSBL、GSBC组在7、8月上升明显,且GSBL组于7月出现最大值5.53 mg/L,显著高于GSB组(P<0.05);而GSB、GSBC组在8月出现最大值,分别为4.76和9.33mg/L,GSBC组显著高于其余2组(P<0.05)。
间隙水DOC分布规律(见图2):表层间隙水中DOC浓度均显著高于上覆水中浓度(P<0.05);8月各模式中表层间隙水DOC浓度为上覆水的2倍以上,远高于上覆水,最高浓度可达25.68mg/L,而8月各模式中上覆水DOC浓度最高值仅为9.33mg/L。而间隙水中DOC浓度4月最低,8月浓度最高,随深度增加变化明显,且远高于其余月份。表层间隙水中DOC含量整体均表现为GSBC>GSBL>GSB,且在8月各组间差异显著(P<0.05)。GSB组的DOC浓度在0~2cm随养殖时间而不断升高,于8月出现最大值10.09mg/L;在2~4cm的变化呈锯齿状,随着时间先降低后升高;在4~7cm于8月出现最大值13.37mg/L。GSBL组的DOC浓度在0~2cm随养殖时间而不断升高,于7月出现最大值15.31mg/L;在2~4cm于7月出现最大值10.58mg/L;在4~7cm变化呈锯齿状,随着时间先升高后降低。GSBC组的DOC浓度在0~2cm随养殖时间而不断升高,在8月出现最大值25.68mg/L;在2~4cm也于8月出现最大值26.62mg/L,此层6、7、8月的浓度与0~2cm非常接近;在4~7cm于4、5月的浓度较接近,到6月有所下降,而从7月起呈上升趋势,到9月出现最大值20.13mg/L。

(字母GSB,GSBL和GSBC分别代表草鱼、鲢、鳙模式,草鱼、鲢、鳙、凡纳滨对虾模式和草鱼、鲢、鳙、鲤模式,下同;DOC和DIC数值用平均值±标准差表示(n=3)。The letters GSB, GSBL and GSBC represent grass carp, silver carp, big head model, grass carp, silver carp, big head,Litopenaeusvannameimodel and grass carp, silver carp, big head, carp model respectively, the same below. Values of DOC and DIC are given as means ± SD (n=3).)
图1不同养殖模式下上覆水中DOC和DIC的分布
Fig.1The dissolved organic and inorganic carbon concentration of the overlying water in different culture models

图2 不同养殖模式下间隙水中DOC和DIC的分布
2.2 上覆水与间隙水DIC的分布特征
上覆水DIC分布规律(见图1):整体而言,随着养殖时间的推移,各组DIC浓度在5—8月呈上升的趋势,9月浓度有所下降。养殖初始DIC浓度差异较小,而到8月份各模式下DIC浓度增加了1~2倍(4月DIC含量为38.03~51.90mg/L,8月DIC含量为82.43~104.49mg/L)。就养殖模式而言,GSB、GSBC组随时间变动趋势相似,均在8月出现最大值,分别为95.71和104.49mg/L,GSBC组显著高于其余2组(P<0.05);而GSBL组在7月出现最大值91.05mg/L。
间隙水DIC分布规律(见图2):表层间隙水中DIC浓度均明显高于上覆水中浓度;8月,各模式中表层间隙水DIC浓度与上覆水最接近,8月各模式中上覆水DIC浓度最高值达到104.49mg/L。此外,间隙水中DIC浓度4月最低,随深度增加大致呈下降趋势;8月浓度最高,随深度增加变化明显。表层间隙水中DIC含量整体表现为GSBC>GSB>GSBL,且在8月各组间差异显著(P<0.05)。GSB组的DIC浓度在0~2cm随养殖时间而不断升高,于8月出现最大值122.72mg/L;在2~4cm的随养殖时间而不断升高,于9月出现最大值99.38mg/L;在4~7cm与2~4cm的变化规律一致,同样于9月出现最大值71.20mg/L。GSBL组的DIC浓度在0~2cm于7月出现最大值125.01mg/L;而在2~4和4~7cm分别于8、9月出现最大值90.82和 66.50mg/L。GSBC组的DIC浓度在0~2和2~4cm随养殖时间而不断升高,分别于8月出现最大值136.02和121.76mg/L,且2层各月份的浓度非常接近,尤其在8月;在4~7cm随养殖时间而不断升高,于9月出现最大值94.51mg/L。
2.3 沉积物TOC的分布特征
沉积物TOC分布规律(见图3):各模式表层沉积物TOC含量4月最低,范围在3.04~5.60mg/g;9月含量最高,范围在10.97~16.60mg/g,含量增加了2倍左右。表层沉积物TOC含量整体均表现为GSB>GSBL>GSBC,且在8、9月差异显著(P<0.05)。GSB组的TOC含量在0~2cm随养殖时间而不断升高,于9月出现最大值16.60mg/g;在2~4cm各月间无明显变化,范围在5.02~6.02mg/g;在4~7cm各月间含量接近,范围在3.25~4.21mg/g。GSBL组的TOC含量在0~2cm随养殖时间而不断升高,于9月出现最大值11.27mg/g;在2~4cm层各月间无明显变化,范围在2.14~3.18mg/g;在4~7cm各月间含量接近,范围在1.85~2.47mg/g。GSBC组的TOC含量在0~2和2~4cm随养殖时间而不断升高,分别于9月出现最大值10.97 和9.65mg/g,且2层各月份的含量非常接近;在4~7cm于5、6月均呈下降趋势,到7月有所上升,于8月出现最大值5.99 mg/g。

图3 不同养殖模式下沉积物中TOC和TIC的分布
2.4 沉积物TIC的分布特征
沉积物TIC分布规律(见图3):实验期间不同养殖模式下表层沉积物TIC含量变化范围为9.56~22.10mg/g。表层沉积物TIC含量整体均表现为GSB>GSBL>GSBC,且GSB组在6、7月显著高于其余2组(P<0.05)。GSB组的TIC含量在0~2cm随养殖时间而不断下降,于8月达到最小值14.89mg/g;在2~4cm变化规律与0~2cm一致,于8月出现最小值14.81mg/g;在4~7cm于4、5月含量接近,在6月呈下降趋势,到9月出现最小值15.24mg/g。GSBL组的TIC含量在0~2cm随养殖时间而不断下降,于7月出现最小值11.16mg/g;在2~4cm前期无明显变化,而在8月明显下降,出现最小值13.04mg/g;在4~7cm于4月出现最大值19.49mg/g,5、6月呈下降趋势,在6月出现最小值14.37mg/g,到7、8月呈上升趋势,而在9月又有所下降。GSBC组的TIC含量在0~2和2~4cm随养殖时间而不断下降,分别于8月出现最小值9.56 和10.91mg/g,且2层在养殖中后期的含量较接近;在4~7cm与0~2cm的变化规律也基本一致,于8月出现最小值14.41mg/g。
2.5上覆水与表层间隙水、沉积物各形态碳含量的相关性
各月份上覆水与表层间隙水、沉积物各形态碳含量之间的相关分析结果见表2。
从表2可以看出,上覆水DOC 和DIC含量之间呈极显著正相关关系;上覆水DOC与表层间隙水DOC呈极显著正相关关系,与表层沉积物TOC也呈正相关关系,但相关性不显著;上覆水DIC与表层间隙水DIC呈极显著正相关关系,而与表层沉积物TIC则呈极显著负相关关系。

表2 Pearson相关系数
注: *P<0.05显著相关,**P<0.01极显著相关。*P<0.05 significant correlation,**P<0.01 extremely significant correlation.
①Correlation coefficient;②DOC of the overlying water; ③DIC of the overlying water; ④DOC of the interstitial water; ⑤TOC of the sediments; ⑥DIC of the interstitial water; ⑦TIC of the sediments ; ⑧DIC of the overlying water
3讨论
3.1 上覆水、表层间隙水和沉积物中各形态碳含量的变化分析
本实验中,草鱼3种养殖模式表层沉积物TOC均在9月达到最高,为10.97~16.60mg/g,与已有的报道一致[23],说明草鱼投饵养殖池塘,残饵、粪便等有机碎屑的富集导致TOC含量的增加。而9月上覆水和表层间隙水中DOC含量较小,在水温较高的7、8月(32~34℃)出现较大值,这是因为DOC基本由腐殖质和棕黄酸组成[24],主要是由水生生物分解、分泌生成,除了受有机碳分解的影响外,还受水体中浮游植物的浓度及生长变化的影响[25],而较高的水温有利于微生物的活动、藻类的分解和生产,在夏季会有一个增加的过程[26]。
7、8月表层沉积物中的TIC含量较低,达到9.56~15.53mg/g,而上覆水和表层间隙水中DIC含量较高,范围分别为82.33~104.49和96.76~136.02mg/L。上覆水DIC含量与表层间隙水DIC呈极显著正相关关系,与表层沉积物TIC则呈极显著负相关关系。这种各形态碳含量的变化可能是表层沉积物分解及环境理化因子改变的结果。据李学刚等[27]报道,TIC的主要成分为碳酸盐, 可划分为5种形态,其中NaCl相结合能力最弱,NH3·H2O相和NaOH相在碱性环境中能被溶出的无机碳。由此推测,在养殖池塘弱碱性的环境下,TIC含量的降低主要是NaCl相和NH3·H2O相无机碳的溶出,尤其在7、8月,随着水温升高(在8月出现最大值34℃),pH不断下降(在8月出现最小值,范围在7.96~8.13)以及DO范围在3.26~4.05mg/L,均促进了TIC的溶出。
而9月表层沉积物中的TIC含量又有所回升,达到12.02~18.99 mg/g。这可能与钙质生物碎屑的沉降积累有关[28]。另外,TIC含量的上升与本实验中TN含量(数据待发表)变化一致,有研究表明沉积物氮含量的增加也可能会使NH3·H2O和NaOH相无机碳含量增加,其通过氨化和硝化作用促使碳酸盐沉淀溶解平衡发生移动[29]。从环境因子来看,在9月,由于温度下降(25℃),pH上升(8.37~8.52),及DO升高(4.93~5.63mg/L),制约了TIC的溶出,导致溶出量小于积累量,进而出现TIC含量回升。
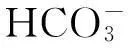
综上所述,不同混养模式下上覆水、表层间隙水和沉积物中各形态碳含量之间有着密切关系。根据分析,可推测上覆水DOC 和DIC含量具有一定的同源性,且相互促进。表层间隙水不断积累DOC的同时向上覆水释放;表层沉积物TOC的分解作用小于沉积作用,但对上覆水DOC含量的增加仍有一定促进作用。表层间隙水不断积累DIC的同时向上覆水释放;表层沉积物TIC是上覆水DIC的来源之一。
3.2 上覆水、间隙水和沉积物中各形态碳含量的差异分析
沉积物的垂直变化呈现明显沉降、降解、堆积三阶段的分布特征[32-34],沉降和降解阶段各项指标的波动会受到底栖动物扰动的影响,生物扰动既可以增大氧化层的下渗深度,也会把某些还原性的化合物从沉积物还原带垂直输送到氧化带,或把有机物含量丰富的新近沉积物颗粒垂直输送到沉积物深层,或排出一些酸性新陈代谢产物,改变沉积物的pH[35-36]。有研究表明,大型底栖动物对有机质的降解主要通过翻动颗粒,致使基质暴露,增加表面积,增强有机质的分解作用;其还能通过摄食、排泄和分泌,刺激细菌生长,增强再矿化作用[37]。因此,在养殖池塘配养底栖生物,将极大地影响物质的再循环和埋藏速率[38-41],加快由扩散速率限制的反应速度[42-43]。
本实验中,GSBL和GSBC模式分别配养凡纳滨对虾和鲤,其对沉积物有一定程度的扰动作用,加速了有机质的分解,所以整个实验周期GSBL和GSBC模式表层沉积物TOC含量都低于GSB模式。另外,GSBL模式中的凡纳滨对虾在池塘底部主要进行爬行活动,爬行对底质的扰动深度据推测大约在0~2cm[44];而GSBC模式中的鲤主要通过游动进行活动,游动对底质的扰动深度集中在1~5cm左右[45]。由此可见,鲤对底质扰动作用比凡纳滨对虾大,所以整个实验周期GSBC模式表层沉积物TOC含量都低于GSBL模式;尤其在7、8月,鲤和凡纳滨对虾活动都较活跃,对沉积物的扰动作用较大,所以GSBC和GSBL模式表层沉积物TOC的积累量较少。同时,还表现在养殖中后期GSBC模式沉积物TOC含量在0~2和2~4cm层的含量接近。
另外,表层间隙水和上覆水DOC的含量整体上表现为GSBC模式最高,GSBL模式次之,GSB模式最低,这是由于扰动作用不仅促进了有机质的分解生成DOC,而且使沉积物更为疏松,有利于间隙水中溶解物垂直方向上的迁移。因此,GSBC模式不仅在0~2cm的DOC含量高,且在上覆水和2~4cm的含量也较高;而GSBL模式由于凡纳滨对虾扰动深度较浅,制约了间隙水中DOC向下的迁移,含量仅在0~2cm层较高,但仍利于向上覆水释放。
表层间隙水和上覆水DIC含量整体表现为GSBC>GSB>GSBL,而表层沉积物TIC含量整体表现为GSB>GSBL>GSBC,表明扰动作用对TIC的分解并不起到主导作用,其受理化环境的影响更大,但在垂直迁移上仍具一定影响。因此,间隙水DIC和沉积物TIC垂直分布特征与间隙水DOC和沉积物TOC一致。
4结论
(1)上覆水、间隙水及沉积物中各形态碳含量随着养殖的进行呈一定的动态变化。
(2)上覆水DOC 和DIC含量之间呈极显著正相关关系(P<0.01);上覆水DOC与表层间隙水DOC呈极显著正相关关系(P<0.01),与表层沉积物TOC也呈正相关关系,但相关性不显著;上覆水DIC与表层间隙水DIC呈显著正相关关系(P<0.01),而与表层沉积物TIC则呈显著负相关关系(P<0.01)。
(3)间隙水及底泥中各形态碳含量的垂直分布特征主要受生物扰动作用的影响,其次是扩散作用。GSBC模式中间隙水及底泥中各形态碳含量受生物扰动作用影响最明显,GSBL模式次之,这是由于鲤对沉积物的扰动作用较凡纳滨对虾大。
参考文献:
[1]叶笃正. 中国的全球变化与可持续发展研究 [J]. 地球科学进展, 1999, 14(4): 317-318.
Ye D Z. Global change and sustainable development research in China [J]. Advance in Earth Sciences, 1999, 14(4): 317-318.
[2] Plass G N. The carbon dioxide theory of climatic change [J]. Tellus, 1956, 8(2): 140-154.
[3]刘文新. 地球的新陈代谢: 了解碳循环 [J]. 人类环境杂志, 1994, 23(1): 4-12.
Liu W X. The metabolism of the earth: Understanding of the carbon cycle [J]. AMBIO, 1994, 23(1): 4-12.
[4]Vitousek P M. Beyond global warming: ecology and global change [J]. Ecology, 1994, 75(7): 1861-1876.
[5]Barnola J M, Raynaud D, Lorius C, et al. Vostok ice core provides 160, 000-year record of atmospheric CO2[J]. Nature, 1987, 329(1): 408-414.
[6]Chappellaz J, Barnola J M, Raynaud D, et al. Ice-core record of atmospheric methane over the past 160, 000 years [J]. Nature, 1990, 345(6271): 127-131.
[7]Mahowald N, Kohfeld K, Hansson M, et al. Dust sources and deposition during the last glacial maximum and current climate: A comparison of model results with paleodata from ice cores and marine sediments [J]. Journal of Geophysical Research: Atmospheres, 1999, 104(D13): 15895-15916.
[8]Friedli H, Lötscher H, Oeschger H, et al. Ice core record of the13C/12C ratio of atmospheric CO2in the past two centuries [J]. Nature, 1986, 324(6094): 237-238.
[9]Raynaud D, Jouzel J, Barnola J M, et al. The ice record of greenhouse gases [J]. Science, 1993, 259(5097): 926-934.
[10]庄亚辉, 李长生, 高拯民. 复合生态系统元素循环 [M]. 北京: 中国环境科学出版社, 1996.
Zhuang Y H, Li Z S, Gao Z M . Compound ecosystem elements cycle [M]. Beijing: China Environmental Science Press, 1996.
[11] 方精云, 位梦华. 北极陆地生态系统的碳循环与全球温暖化 [J]. 环境科学学报, 1998, 18(2): 113-121.
Fang J Y, Wei M H. Carbon cycle in the arctic terrestrial ecosystems in relation to the global warming [J]. Acta Scientiae Circumstantiae, 1998, 18(2): 113-121.
[12]Cole J J, Prairie Y T, Caraco N F, et al. Plumbing the global carbon cycle: Integrating inland waters into the terrestrial carbon budget [J]. Ecosystems, 2007, 10(1): 172-185.
[13]Einsele G, Yan J, Hinderer M. Atmospheric carbon burial in modern lake basins and its significance for the global carbon budget [J]. Global and Planetary Change, 2001, 30(3): 167-195.
[14]吴丰昌, 万国江, 蔡玉蓉, 等. 沉积物-水界面的生物地球化学作用 [J]. 地球科学进展, 1996, 11(2): 191-197.
Wu F C, Wan G J, Cai Y R, et al. Biogeochemical processes at the sediment-water interface [J]. Advance in Earth Sciences, 1996, 11(2): 191-197.
[15]Anderson M A, Rubin A J. Adsorption of Inorganics at Solid-Liquid Interfaces [J]. Soil Science, 1982, 133(4): 257-258.
[16]刘华丽, 曹秀云, 宋春雷, 等. 水产养殖池塘沉积物有机质富集的环境效应与修复策略 [J]. 水生态学杂志, 2011, 32(6): 130-134.
Liu H L, Cao X Y, Song C L, et al. Environmental effects of organic matter enrichment and restoration strategy in sediment of aquaculture ponds [J]. Journal of Hydroecology, 2011, 32(6): 130-134.
[17]Aller R C. Bioturbation and remineralization of sedimentary organic matter: effects of redox oscillation [J]. Chemical Geology, 1994, 114(3): 331-345.
[18]Aller R C. Quantifying solute distributions in the bioturbated zone of marine sediments by defining an average microenvironment [J]. Geochimica et Cosmochimica Acta, 1980, 44(12): 1955-1965.
[19]Wheatcroft R A, Jumars P A, Smith C R, et al. A mechanistic view of the particulate biodiffusion coefficient: step lengths, rest periods and transport directions [J]. Journal of Marine Research, 1990, 48(1): 177-207.
[20]Kostka J E, Gribsholt B, Petrie E, et al. The rates and pathways of carbon oxidation in bioturbated saltmarsh sediments [J]. Limnology and Oceanography, 2002, 47(1): 230-240.
[21]张振东, 王芳, 董双林, 等. 草鱼、鲢鱼和凡纳滨对虾多元化养殖系统结构优化的研究 [J]. 中国海洋大学学报: 自然科学版, 2011, 41(7): 60-66.
Zhang Z D, Wang F, Dong S L, et al. A preliminary study on structural optimization in polycultural systems ofCtenopharyngodonidelluswithHypophthalmichthysmolitrixandLitopenaeusvannamei[J]. Periodical of ocean university of China: natural science edition, 2011, 41(7): 60-66.
[22]王友绍, 徐继荣. 一种无边界扰动的单管沉积物采样器: 中国, 200410026847.3 [P]. 2004-04-13.
Wang Y S, Xu J R.A single pipe sediment sampler with noboundary perturbation: China, 200410026847.3 [P]. 2004-04-13.
[23]刘朋. 草鱼不同混养系统有机碳, 氮和磷收支及变动的初步研究[D]. 青岛: 中国海洋大学, 2012.
Liu P. A preliminary study on budget and variation of organic carbon, nitrogen and phosphorus of grass carp in different polyculture systems [D]. Qingdao: Ocean University of China, 2012.
[24]Hope D, Billett M F, Cresser M S. A review of the export of carbon in river water: fluxes and processes [J]. Environmental Pollution, 1994, 84(3): 301-324.
[25]杨顶田, 陈伟民. 长江下游湖泊中可溶性有机碳的时空分布 [J]. 环境污染与防治, 2004, 26(4): 275-277.
Yang D T, Chen W M. The temporal and spatial distribution of dissolved organic carbon in lakes at the lower reach of Chang jiang River [J]. Environment Pollution and Control, 2004, 26(4): 275-277.
[26]Ford T E, Ford S A, Lock M A, et al. Dissolved organic carbon concentrations and fluxes along the Moisie River, Quebec [J]. Freshwater Biology, 1990, 24(1): 35-42.
[27]李学刚. 近海环境中无机碳的研究[D]. 青岛: 中国科学院海洋研究所, 2004.
Li X G. Studies on inorganic carbon in offshore environments [D]. Qingdao: Institute of Marine Research, Chinese Academy of Sciences, 2004.
[28]杨作升, 范德江, 郭志刚, 等. 东海陆架北部泥质区表层沉积物碳酸盐粒级分布与物源分析 [J]. 沉积学报, 2002, 20(1): 1-6.
Yang Z S, Fan D J, Guo Z G, et al. Distribution of the carbonate clast size and the provenance analyses of the surface sediments in the northern East China Sea [J]. Acta Sedimentologica Sinica, 2002, 20(1): 1-6.
[29]王晓亮. 黄河口无机碳输送行为研究[D]. 青岛: 中国海洋大学, 2005.
Wang X L. A study of transportation behaviors of inorganic carbon in Huanghe Estuary [D]. Qingdao: Ocean University of China, 2005.
[30]DeFries R S, Malone T F. Global Change and Our Common Future: Papers from a Forum [M]. Washington, DC: National Academy Press, 1989.
[31]类延斌, 姚檀栋, 张恩楼, 等. 羌塘高原湖水δ13CDIC值特征及影响因素分析 [J]. 湖泊科学, 2011, 23(5): 673-680.
Lei Y B, Yao T D, Zhang E L, et al. Characteristics of δ13CDICvalue in lakes on Qiangtang Plateau and its affected factors [J]. Journal of Lake Sciences, 2011(5): 673-680.
[32]Ruttenberg K C. Development of a sequential extraction method for different forms of phosphorus in marine sediments [J]. Limnology and Oceanography, 1992, 37(7): 1460-1482.
[33]Jensen H S, McGlathery K J, Marino R, et al. Forms and availability of sediment phosphorus in carbonate sand of Bermuda seagrass beds [J]. Limnology and Oceanography, 1998, 43(5): 799-810.
[34]Koch M S, Benz R E, Rudnick D T. Solid-phase phosphorus pools in highly organic carbonate sediments of northeastern Florida Bay [J]. Estuarine, Coastal and Shelf Science, 2001, 52(2): 279-291.
[35]Jensen H S, Thamdrup B. Iron-bound phosphorus in marine sediments as measured by bicarbonate-dithionite extraction [J]. Hydrobiologia, 1993, 253(1-3): 47-59.
[36]Herbert R A. Nitrogen cycling in coastal marine ecosystems [J]. FEMS Microbiology Reviews, 1999, 23(5): 563-590.
[37]Aller R C, Rude P D. Complete oxidation of solid phase sulfides by manganese and bacteria in anoxic marine sediments [J]. Geochimica et Cosmochimica Acta, 1988, 52(3): 751-765.
[38]Ferreira T O, Otero X L, Vidal-Torrado P, et al. Effects of bioturbation by root and crab activity on iron and sulfur biogeochemistry in mangrove substrate [J]. Geoderma, 2007, 142(1): 36-46.
[39]Wheatcroft R A. Time-series measurements of macrobenthos abundance and sediment bioturbation intensity on a flood-dominated shelf [J]. Progress in Oceanography, 2006, 71(1): 88-122.
[40]Mulsow S, Boudreau B P, Smith J A. Bioturbation and porosity gradients [J]. Limnology and Oceanography, 1998, 43(1): 1-9.
[41]Smith C R, Pope R H, DeMaster D J, et al. Age-dependent mixing of deep-sea sediments [J]. Geochimica et Cosmochimica Acta, 1993, 57(7): 1473-1488.
[42]Henderson G M, Lindsay F N, Slowey N C. Variation in bioturbation with water depth on marine slopes: A study on the Little Bahamas Bank [J]. Marine Geology, 1999, 160(1): 105-118.
[43]Chakrabarty D, Das S K. Bioturbation-induced phosphorous release from an insoluble phosphate source [J]. Biosystems, 2007, 90(2): 309-313.
[44]郭永坚. 草鱼与凡纳滨对虾复合养殖池塘沉积物—水界面营养盐动态研究[D]. 青岛: 中国海洋大学, 2011.
Guo Y J. Study on Dynamics of Nutrients Across sediment-water interface in composite culture pond of grass carp (Ctenopharyngodonidellus) and shrimp (Litopenaeusvannamei) [D]. Qingdao: Ocean University of China, 2011.
[45]钟大森, 王芳, 王春生, 等. 不同密度下的鲤鱼扰动作用对沉积物-水界面硝化, 反硝化和氨化速率的影响 [J]. 水生生物学报, 2013, 37(6): 1103-1111.
Zhong D S, Wang F, Wang C S, et al. Effect on the bioturbation of carps in different density on denitrification , nitrification and nitrate ammonification rates on sediment-water interface [J]. Acta Hydrobiologica Sinica, 2013, 37(6): 1103-1111.
责任编辑朱宝象
Study on Distribution of Different Carbon Forms in Overlying and Sediment
Interstitial Waters in Different Grass Carp Polyculture Models
XIONG Ying-Huai1, WANG Fang1, CHEN Yan1, DONG Shuang-Lin1, LIU Feng2
(1.The Key Laboratory of Mariculture, Ministry of Education, Ocean University of China, Qingdao 266003, China; 2.Freshwater Fisheries Research Institute of Shandong Province, Jinan 250000, China)
Abstract:Overlying water and sediment samples were collected from grass carp (Ctenopharyngodon idellus) experimental ponds set at different culture models from April to September,2013.The characteri-stics of temporal-spatial distribution and correlation of carbon in overlying water, interstitial water of surface layer and sediment were analyzed. Three polyculture systems were studied, which included (1) GSB (grass carp, silver carp Hypophthalmictuthys molitrix and bighead carp Aristichthys nobilis), (2) GSBL (grass carp, silver carp, bighead carp and white shrimp Litopenaeus vannamei), and (3) GSBC (grass carp, silver carp, bighead carp and common carp Cyprinus carpio). The results showed that the concentrations of dissolved organic carbons (DOC) and dissolved inorganic carbons (DIC) in the interstitial water of surface layer were significantly higher than those in overlying water (P<0.05). DOC and DIC were all the highest in August for GSB and GSBC, but in July for GSBL. The trend of those in the overlying water was similar to that in the interstitial water of surface layer during farming time. In different culture models, the content of DIC in the interstitial water of surface layer and overlying water ranged from GSBC to GSB and GSBL, and that of DOC from GSBC to GSBL and then to GSB. The contents of DIC and DOC were significantly different among treatments in August (P<0.05). As to total organic carbon (TOC) and total inorganic carbon (TIC) in the sediment of surface layer, the distributions were ranged from GSB to GSBL and then to GSBC. The content of TOC was significantly different among treatments in August and September (P<0.05). And the content of TIC in the GSB were significantly higher than others in June and July (P<0.05). TOC in sediment of surface layer was all the highest in September for three models,but TIC were the lowest in July for GSBL and in August for GSB and GSBC.There was no significantly differe-nce in 2~4cm and 4~7cm for GSB and GSBL, except for GSBC in 2~4cm. The correlation analysis results demonstrated that DOC in overlying water was positively correlated with DIC in overlying water (P<0.01) and DOC in the interstitial water of surface layer (P<0.01), but negatively with TIC in the sediments (P<0.01). In addition, the results demonstrated a positive relationship of DIC in overlying water with that in the interstitial water of surface layer (P<0.01), but a negative relationship with TIC in the sediment of surface layer (P<0.01). Various types of carbon vertical distributions in interstitial water and sediment were mainly affected by bioturbation, followed by the diffusion. The bioturbation was the most significant in GSBC, secondly in GSBL. The reason was that the bioturbation of carp was even deeper than that of shrimp. Grass carp is considered as an economically important aquaculture species in China with the largest production. And reasonable cultivation model is the key to obtain higher economic benefit in grass carp ponds. At present, the study has not been reported on carbon cycle in the grass carp ponds, and this study provided a basis for the further research of carbon cycle in polyculture ponds.
Key words:grass carp polyculture pond; overlying water; interstitial water; sediment; dissolved organic carbon; dissolved inorganic carbon; total organic carbon; total inorganic carbon
DOI:10.16441/j.cnki.hdxb. 20150013
中图法分类号:S96
文献标志码:A
文章编号:1672-5174(2016)03-022-09
作者简介:熊莹槐(1990-),男,硕士生。E-mail:xiongyinghuai@163.com**通讯作者:E-mail:wangfang249@ouc.edu.cn
收稿日期:2015-01-26;
修订日期:2015-05-12
*基金项目:山东省自然科学基金项目(ZR2014CM042);广西海洋生物技术重点实验室开放性课题项目(GLMBT-201402)资助
引用格式:熊莹槐, 王芳, 陈燕, 等. 草鱼不同混养模式的上覆水、间隙水及沉积物中各形态碳的分布特征[J].中国海洋大学学报(自然科学版), 2016, 46(3): 22-30.
Supported by Shandong province Natural Science Found Project (ZR2014CM042);Open Project of Guangxi Key Laboratory for Marine Biotechnology (GLMBT-201402)
