5-羟色胺对肠炎小鼠结肠组织中GRP78表达的影响*
2016-04-19陈梦露董仕桢常永超冯丹丹
陈梦露,董仕桢,常永超,陈 攀,冯丹丹,高 强#
1)河南科技大学第一附属医院(河南科技大学临床医学院)消化内科 洛阳 471003 2)河南科技大学第一附属医院(河南科技大学临床医学院)检验科 洛阳 471003
5-羟色胺对肠炎小鼠结肠组织中GRP78表达的影响*
陈梦露1,2),董仕桢1,2),常永超2),陈攀1),冯丹丹1),高强1)#
1)河南科技大学第一附属医院(河南科技大学临床医学院)消化内科 洛阳 4710032)河南科技大学第一附属医院(河南科技大学临床医学院)检验科 洛阳 471003
关键词5-羟色胺;炎症性肠病;葡萄糖调节蛋白78;小鼠
摘要目的:观察5-羟色胺(5-HT)对肠炎小鼠结肠组织葡萄糖调节蛋白78(GRP78)表达的影响。方法:将7~8周龄的C57BL/6小鼠随机分为6组(n=8):正常对照组,低、高剂量5-HT组(分别给予1.0、2.0 mg/kg的5-HT灌肠,每3 d 1次),低、高剂量DSS组(分别饮用10或25 g/L DSS溶液),DSS+5-HT组(给予10 g/L DSS+1.0 mg/kg 5-HT),于第6天结束时处死小鼠。通过疾病活动指数评分、结肠长度测定和HE染色等方法评估肠道炎症程度,采用实时定量PCR技术检测小鼠结肠组织中IL-6、TNF-α和 GRP78 mRNA的表达水平,采用免疫组化法检测小鼠结肠组织中GRP78蛋白的表达。结果:正常对照组,低、高剂量5-HT组小鼠无肠炎,低剂量DSS组有轻微肠炎,高剂量DSS组和DSS+5-HT组有严重肠炎。IL-6和TNF-α mRNA的表达水平随炎症程度而增加。GRP78 mRNA和蛋白在正常对照组、低剂量5-HT组和低剂量DSS组中的表达水平差异无统计学意义(P>0.05),在高剂量5-HT组、DSS+5-HT组和高剂量DSS组,尤其是高剂量DSS组表达增高(P<0.05)。结论:5-HT可能通过上调GRP78蛋白的表达激活内质网应激反应,参与肠道炎症反应。
Effects of 5-hydroxytryptamine on expression of GRP78 in colon tissue of mice with colitis
CHENMenglu1,2),DONGShizhen1,2),CHANGYongchao2),CHENPan1),FENGDandan1),GAOQiang1)
1)DepartmentofGastroenterologyandHepatology,theFirstAffiliatedHospitalandCollegeofClinicalMedicineofHenanUniversityofScienceandTechnology,Luoyang4710032)DepartmentofClinicalLaboratory,theFirstAffiliatedHospitalandCollegeofClinicalMedicineofHenanUniversityofScienceandTechnology,Luoyang471003
Key words5-hydroxytryptamine;inflammatory bowel disease;glucose regulated protein 78;mouse
AbstractAim: To investigate the impact of 5-hydroxytryptamine(5-HT) on the expression of endoplasmic reticulum stress chaperone glucose regulated protein 78(GRP78) in mouse inflammatory colon induced by dextran sulfate sodium (DSS). Methods: Seven to eight-week-old C57BL/6 mice were randomly allocated into 6 groups(n=8). Mice in normal control group drank water freely. Mice in low-dose 5-HT and high-dose 5-HT groups received 1.0 mg/kg and 2.0 mg/kg of 5-HT by enema respectively. Mice in low-dose DSS and high-dose DSS groups received 10 and 25 g/L DSS solution, respectively. Mice in DSS+5-HT group were concurrently treated with 10 g/L DSS solution and 1.0 mg/kg of 5-HT. At the end of the 6th day, they were scarified to gather specimens. The severity of colitis was evaluated by disease activity index(DAI), colon length and pathological inflammatory scores of colon. Inflammatory cytokines such as IL-6 and TNF-α mRNA expressions in colon tissue were measured by quantitative real-time PCR. The protein and mRNA expressions of GRP78 in colon tissue of mice were evaluated by immunohistochemistry and RT-PCR,respectively. Results: There was no colitis in mice of normal control, low-dose 5-HT and high-dose 5-HT groups, while mild colitis was found in mice of low-dose DSS group. However, mice co-treated with DSS and 5-HT had severe colitis, which was comparable to mice treated with high-dose DSS. In addition, the expressions of IL-6 and TNF-α mRNA increased with the deterioration of inflammatory degree. The mRNA and protein expressions of GRP78 in normal control, low-dose 5-HT and low-dose DSS groups was similar, while in high-dose 5-HT,DSS+5-HT and high-dose DSS groups, especially the high-dose DSS group were upregulated(P<0.05).Conclusion: 5-HT may activate endoplasmic reticulum stress response by increasing the expression of GRP78 protein, and participate in intestinal inflammation.
炎症性肠病(inflammatory bowel disease,IBD)是一种慢性非特异性肠道炎症性疾病,包括克罗恩病(Crohn's disease,CD)和溃疡性结肠炎(ulcerative colitis,UC)两种类型。IBD的确切病因尚未明确,目前普遍认为是遗传、免疫、肠道菌群和环境等多种因素相互作用的结果[1]。内质网应激是指在细胞内能量水平、氧化状态或钙离子浓度异常等情况下内质网功能发生改变,它在IBD发生和发展中的作用越来越受到重视[2]。葡萄糖调节蛋白78(glucose regulated protein 78,GRP78)是内质网应激诱导表达的关键蛋白,在蛋白质折叠、调节内质网应激跨膜信号蛋白活性等方面发挥着重要作用[3]。炎症发生时,细胞促炎因子及趋化因子如IL-1β、IL-8、IL-6、TNF-α及IFN-γ增加,促进炎症的发生发展。5-羟色胺(5-hydroxytryptamine,5-HT)在中枢神经系统中作为一种神经递质而起作用,然而体内大多数(约90%)5-HT存在于肠道,5-HT通过激活一系列受体调控许多胃肠道功能,包括分泌和蠕动[4]。在IBD中,5-HT信号系统异常导致胃肠道动力及分泌功能异常和内脏高敏性[5]。在CD患者和IBD动物模型中均发现有炎症的肠黏膜组织中5-HT水平上升[6]。该研究中作者采用葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导建立小鼠肠炎模型,观察5-HT对肠炎小鼠结肠组织GRP78 mRNA和蛋白的表达以及炎症因子mRNA水平的影响,探讨5-HT在DSS诱导小鼠肠炎过程中所发挥的作用。
1材料与方法
1.1材料实验动物:健康清洁级C57BL/6小鼠(购于北京维通利华公司),7~8周龄,雄性,体重20~25 g,饲养于河南科技大学第一附属医院新区医院实验动物中心,用混合配方颗粒饲料(北京华阜康生物科技股份有限公司)饲养。DSS(相对分子质量为 36 000~50 000,美国MP Biomedicals 公司),5-HT(德国Sigma公司),戊巴比妥钠(德国Merck公司)。总RNA提取试剂由Invitrogen公司生产,反转录试剂盒和实时荧光定量PCR试剂盒购于TaKaRa公司,免疫组化检测用GRP78一抗购于英国Abcam公司,SABC免疫组化检测试剂盒购于武汉博士德生物工程有限公司,浓缩型DAB显色试剂盒购于北京索莱宝公司。
1.2实验分组和取材小鼠适应性喂养1周,室内温度保持在20~22 ℃,湿度约50%,明暗交替周期为12 h,随机分为6组,每组8只。建模前所有小鼠禁食24 h,正常对照组自由饮水,低、高剂量5-HT组分别给予1.0和2.0 mg/kg的5-HT灌肠,低、高剂量DSS组分别饮用10或25 g/L DSS溶液,DSS+5-HT组给予10 g/L DSS溶液加1.0 mg/kg 5-HT;5-HT通过灌肠的方式给药,每3 d 1次,其他组灌注生理盐水,于第6天各组均饮用蒸馏水[7]。于造模第6天结束时脱颈处死所有小鼠,打开腹腔,取全结肠,翻转结肠后,PBS漂洗,自远端结肠始取约0.5 cm,体积分数4.0%的甲醛溶液固定,石蜡包埋,4.0 μm厚切片,以备HE和免疫组化染色使用。再取1.0 cm,-80 ℃保存,以备mRNA的测定。
1.3观察指标①每日定时测量小鼠体重、观察小鼠摄食/饮水、活动度、大便性状、便血等状态,参照Jackson等[8]的方法进行疾病活动指数(disease activity index,DAI)评分。取材时测量全结肠长度,肉眼观察结肠内血性内容物情况。参照张静等[9]的方法进行血便评分。②采用HE染色法对结肠组织进行病理分析。在400倍镜下进行细胞计数,每张切片选择10个视野,每个视野观察100个细胞。根据Esworthy等[10]的评分标准进行评分,急性炎症的临界值定为6分。
1.4各组小鼠结肠组织IL-6、TNF-α和GRP78 mRNA表达水平的检测Trizol法提取总RNA,测定RNA纯度和浓度后取2 μg,反转录合成cDNA,-20 ℃保存备用。引物由生工生物工程(上海)有限公司合成(表1)。冰上配制PCR反应液,反应体系25 μL:cDNA 2 μL,SYBR Premix EX TaqⅡ(2×)12.5 μL,DEPC水8.5 μL,上、下游引物各1.0 μL(浓度10 μmol/L)。于BIO-RAD Real-time PCR仪中进行PCR反应,反应条件为:95 ℃预变性30 s,95 ℃ 5 s;分别58 ℃、60 ℃和56 ℃退火30 s;72 ℃延伸30 s,共40个循环。每个样本3个复孔,取均值,以β-actin为内参,采用2-ΔΔCt法计算mRNA相对表达量。

表1 引物序列
1.6统计学处理采用SPSS 19.0处理数据,各组小鼠第6天DAI和血便评分的比较采用秩和检验,其他指标的比较采用单因素方差分析,两两比较采用LSD-t检验,检验水准α=0.05。
2结果
2.1各组小鼠一般情况观察、DAI评分及血便评分比较正常对照组、低剂量5-HT组和高剂量5-HT组小鼠每天摄食和饮水正常,活动如常,反应机警,皮毛有光泽,生长发育良好,体重增加;低剂量DSS组于造模第5天出现懒动,摄食/饮水减少,体重下降,出现稀便、肛周潮湿现象,第6天有3只出现血水样便,但体重下降均未超过10%;DSS+5-HT组和高剂量DSS组都于造模第4天开始相继出现懒动、精神萎靡,体毛凌乱,摄食/饮水减少,并出现稀便、肉眼血便、肛周潮湿现象,体重下降。DSS+5-HT组第6天有7只出现严重肉眼血便,6只体重下降超过10%,但无小鼠死亡。高剂量DSS组第6天有7只出现严重肉眼血便;有1只小鼠死亡,剩余7只体重下降均超过10%。各组小鼠第6天DAI和血便评分的比较见表2。
2.2各组小鼠病理观察结果各组小鼠结肠长度和炎症病理评分比较见表2。造模结束后,与正常对照组相比,低剂量DSS组、DSS+5-HT组和高剂量DSS组结肠长度均有不同程度的缩短,其中DSS+5-HT组和高剂量DSS组缩短最严重。正常对照组、低剂量5-HT组和高剂量5-HT组小鼠结肠黏膜结构完整,无炎性细胞浸润;低剂量DSS组黏膜腺体基本完整,局部有少量炎性细胞浸润或隐窝破坏,呈轻度炎症改变;DSS+5-HT组和高剂量DSS组均可见黏膜上皮细胞广泛缺失,腺体大多数不完整,细胞结构排列紊乱,杯状细胞消失,中性粒细胞等炎症细胞浸润广泛,呈严重炎症改变(图1)。

表2 各组小鼠第6天DAI、
*:与正常对照组相比,P<0.05;#:与低剂量DSS组相比,P<0.05;△:与低剂量5-HT组相比,P<0.05。
2.3各组小鼠结肠组织中IL-6、TNF-α和GRP78 mRNA的表达见表3。
2.4各组小鼠结肠组织中GRP78蛋白的表达GRP78蛋白主要表达于结肠上皮细胞胞质,少量分布于胞膜。GRP78蛋白在正常对照组、低剂量5-HT组和低剂量 DSS组的表达均较少,高剂量5-HT组和DSS+5-HT组表达上调,高剂量DSS组最高。见图2、表3。

表3 各组小鼠结肠组织中
*:与正常对照组相比,P<0.05;#:与低剂量DSS组相比,P<0.05;△:与低剂量5-HT组相比,P<0.05。

A:正常对照组;B:低剂量5-HT组;C:高剂量5-HT组;D:低剂量DSS组;E:DSS+5-HT组;F:高剂量DSS组。图1 各组小鼠结肠组织学表现(HE,×200)
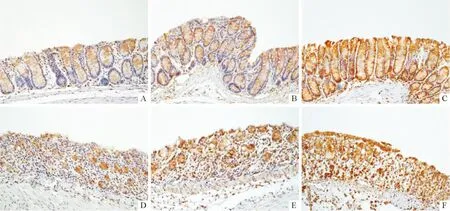
A:正常对照组;B:低剂量5-HT组;C:高剂量5-HT组;D:低剂量DSS组;E:DSS+5-HT组;F:高剂量DSS组。图2 各组小鼠GRP78蛋白的免疫组化染色(SABC,×200)
3讨论
IBD在西方国家属于常见病,在我国尚无普通人群的流行病学资料。研究[11]表明我国IBD的总报道病例数量在近十余年内增加了2.5倍,尤其是CD增加了15.7倍。临床上,IBD患者除了存在一般消化道症状外,还可出现肠道梗阻、穿孔等并发症以及肠道外症状,病程反复发作,迁延不愈。该实验成功建立了小鼠肠炎模型,其肠炎与人类UC有类似的症状,如体重下降、腹泻、血便等,病理表现为黏膜结构缺失,腺体变形萎缩,黏膜及黏膜下层以炎症细胞浸润为主,IL-6和TNF-α炎症因子的表达升高。
Khan等[12]发现在CD和UC患者体内EC细胞数量和5-HT水平会产生变化。Shajib等[6]发现实验性结肠炎模型中5-HT水平下降时,促炎因子水平降低,恢复 5-HT水平会增加DSS诱导的结肠炎的严重性。Regmi等[13]发现5-HT通过NADPH氧化酶Nox2调节肠黏膜的先天免疫反应。该研究发现单独使用低或高剂量的5-HT时小鼠无肠炎表现,单独使用低剂量DSS可诱导小鼠轻微肠炎改变,但低剂量DSS与低剂量5-HT合用则可引起与高剂量DSS相似的重度急性炎症改变,提示5-HT单独应用并不诱导小鼠明显的肠炎变化,但与DSS联合使用则有加重肠炎的作用。急性炎症时,5-HT促进炎症细胞的聚集,并促使巨噬细胞以激活NF-κB依赖的方式产生细胞因子,如IL-6[14]。该实验发现高剂量5-HT组IL-6 mRNA水平明显升高,提示5-HT参与炎症的形成。树突状细胞(dendritic cell,DC)是体内激活初始T细胞的专职抗原呈递细胞。EC细胞定位于DC附近,并且研究[15]发现5-HT在免疫调控中起着重要作用,反过来,免疫调节也改变EC细胞/5-HT信号。因此,5-HT信号和免疫反应的相互作用在引起IBD的发病机制中可能起着重要作用。
GRP78是内质网应激中重要的分子伴侣,在内质网中参与阻止内质网新生肽聚集、调节内质网钙稳态、抗内质网相关性细胞凋亡,以及启动未折叠蛋白反应等细胞生命过程[16]。生理条件下内质网应激对DC分化发育及存活具有至关重要的意义[17]。研究[18]发现衣霉素刺激可诱导DC中的内质网应激,内质网应激标志性分子GRP78蛋白表达水平明显升高。该研究结果显示GRP78蛋白和mRNA表达一致,正常结肠组织中GRP78表达较少,然而,随炎症程度的加重而表达增多,可能与炎症时诱导内质网应激反应,激活GRP78有关。GRP78在高浓度5-HT组中表达上调,提示5-HT刺激可能通过肠上皮细胞以及炎症细胞的5-HT受体,引起GRP78蛋白表达上调,激活内质网应激反应,进一步加重肠道炎症反应。
总之,该研究结果提示5-HT参与结肠组织炎症的发生发展;5-HT上调GRP78表达而影响肠道黏膜内质网应激。有关5-HT和GRP78之间具体的调控通路和作用机制还有待于进一步研究,以期为IBD的治疗找到新的靶点。
致谢:感谢姜雅琳、李宏谦、杨茉莉和李小珍在实验中给予的大力帮助。
参考文献
[1]智佳,智发朝,陈正彦.自噬体基因ATG16L1多态性与炎症性肠病的相关性研究[J].南方医科大学学报,2008,28(4):649
[2]NIEDERREITER L,KASER A.Endoplasmic reticulum stress and inflammatory bowel disease[J].Acta Gastroenterol Belg,2011,74(2):330
[3]曹珊,周慧茹,朱艳琴,等.苦参素对食管癌Eca-109细胞BIP和CHOP mRNA表达的影响[J].郑州大学学报(医学版),2014,49(1):1
[4]赵菊辉,董蕾,郝筱倩.多种胃肠激素对肠易激综合征患者小肠运动功能的研究[J].南方医科大学学报,2007,27(10):1492
[5]ISGAR B,HARMAN M,KAYE MD,et al.Symptoms of irritable bowel syndrome in ulcerative colitis in remission[J].Gut,1983,24(3):190
[6]SHAJIB MS,KHAN WI.The role of serotonin and its receptors in activation of immune responses and inflammation[J].Acta Physiol(Oxf),2015,213(3):561
[7]Chassaing B, Aitken JD, Malleshappa M, et al. Dextran sulfate sodium(DSS)-induced colitis in mice[J]. Curr Protoc Immunol,2014,104:Unit15.25
[8]JACKSON LN,ZHOU Y,QIU S,et al.Alternative medicine products as a novel treatment strategy for inflammatory bowel disease[J].Am J Chin Med,2008,36(5):953
[9]张静,韩英,纪欣,等.GSH在DSS诱导的小鼠实验性肠炎中的作用[J].世界华人消化杂志,2005,13(12):1400
[10]ESWORTHY RS,KIM BW,LARSON GP,et al.Colitis locus on chromosome 2 impacting the severity of early-onset disease in mice deficient in GPX1 and GPX2[J].Inflamm Bowel Dis,2011,17(6):1373
[11]OUYANG Q, XUE LY. Inflammatory bowel disease in the 21(st) century in China: turning challenges into opportunities[J].J Dig Dis, 2012,13(4):195
[12]KHAN WI,GHIA JE.Gut hormones: emerging role in immune activation and inflammation[J].Clin Exp Immunol,2010,161(1):19
[13]REGMI SC,PARK SY,KU SK,et al.Serotonin regulates innate immune responses of colon epithelial cells through Nox2-derived reactive oxygen species[J].Free Radic Biol Med,2014,69:377
[14]MANOCHA M,KHAN WI.Serotonin and GI disorders:an update on clinical and experimental studies[J].Clin Transl Gastroenterol,2012,3:e13
[15]SHAJIB MS,WANG H,KIM JJ,et al.Interleukin 13 and serotonin: linking the immune and endocrine systems in murine models of intestinal inflammation[J].PLoS One,2013,8(8):e72774
[16]周臣敏, 董浦江, 付小利. GRP78蛋白在结肠癌组织中的表达与意义[J].国际检验医学杂志,2013,34(10):1234
[17]IWAKOSHI NN,PYPAERT M,GLIMCHER LH.The transcription factor XBP-1 is essential for the development and survival of dendritic cells[J].J Exp Med,2007,204(10):2267
[18]祝筱梅,姚咏明,董宁,等.衣霉素诱导内质网应激对树突状细胞成熟分化的影响[J].感染、炎症、修复,2011,12(3):139
中图分类号R574.6
#通信作者,男,1961年8 月生,博士,主任医师,研究方向:消化道炎症和肿瘤,E-mail:gaoq@mail.haust.edu.cn
doi:10.13705/j.issn.1671-6825.2016.02.008
*国家自然科学基金面上项目81370487
