miR-34a在结肠癌细胞增殖和迁移中的作用及其分子机制
2016-04-18庄彪闵志均王延峰张鹏倪熊瞿惠龙丁育明上海市浦东医院上海201399
庄彪,闵志均,王延峰,张鹏,倪熊,瞿惠龙,丁育明(上海市浦东医院,上海201399)
miR-34a在结肠癌细胞增殖和迁移中的作用及其分子机制
庄彪,闵志均,王延峰,张鹏,倪熊,瞿惠龙,丁育明(上海市浦东医院,上海201399)
摘要:目的探讨miR-34a在结肠癌细胞增殖和迁移中的作用,并验证其靶点蛋白。方法传代培养人结肠癌细胞株HCT-116,分别采用空病毒载体(pRI-CMV-GFP)转染(阴性对照组)、慢病毒载体(pRI-CMV-GFP-miRNA-34a)转染(慢病毒组),另选未经任何处理的HCT-116细胞作为空白对照组。采用Real-time PCR法检测miR-34a的相对表达量,采用MTT实验、Transwell小室法检测HCT-116细胞增殖和迁移能力,采用细胞免疫荧光试验和Western blotting法验证其靶点蛋白。结果以空白对照组miR-34a表达为1,阴性对照组为1.03±0.09,慢病毒组为6.41±1.56,慢病毒组高于阴性对照组及空白对照组(P均<0.01),证实慢病毒转染成功。与空白对照组、阴性对照组比较,慢病毒组细胞增殖和迁移能力显著下降(P均<0.01)。细胞免疫荧光试验显示,慢病毒组细胞c-Met的荧光强度显著降低,而空白对照组与阴性对照组无明显变化。Western blotting结果显示,慢病毒组c-Met及磷酸化c-Met表达均低于阴性对照组、空白对照组(P均<0.01)。结论过表达miR-34a可抑制结肠癌细胞增殖及迁移,并下调靶点蛋白c-Met及磷酸化c-Met表达,提示miR-34a可作为结肠癌治疗的分子靶点。
关键词:结肠癌;miR-34a;细胞增殖;细胞迁移;c-Met
微小RNA(miRNA)是一种广泛存在于真核生物细胞内、长约22个核苷酸、能与特定靶基因信使RNA的3′UTR配对结合来调控靶基因表达的非编码RNA[1]。研究发现,miRNAs(如miR-21、miR-143、miR-145等)能通过调控不同蛋白的表达,影响结肠癌细胞的生物学行为[2]。miR-34a在肺癌、胃癌和肝癌等细胞中异常表达能够诱导多种癌细胞凋亡并抑制其迁移[3, 4];但其在结肠癌细胞中的作用及其机制鲜见报道。2014年5月,我们采用慢病毒miR-34a过表达载体转染结肠癌细胞,观察其对结肠癌细胞增殖和迁移的影响,并验证其靶点蛋白,旨在为结肠癌的临床治疗提供理论依据。
1材料与方法
1.1材料人结肠癌细胞株HCT-116,购自中国科学院上海细胞库;miRNA提取试剂盒,购自德国QIAGEN公司;逆转录、荧光定量PCR试剂盒,购自日本TaKaRa公司;miR-34a过表达的慢病毒载体(pRI-CMV-GFP-miRNA-34a,以下称慢病毒载体)和转染增强剂(polybrene),购自上海吉玛制药技术有限公司;一抗(兔抗人anti-c-Met,anti-c-Met phosphorylation,GAPDH)和辣根过氧化物酶标记的二抗(羊抗兔),购自美国Cell Signaling Technology公司;其他生化试剂购自Sigma公司。
1.2实验方法
1.2.1细胞培养及转染HCT-116细胞置于含10% FBS和100 U/mL青链霉素的DMEM培养基,37 ℃、5% CO2恒温细胞培养箱内培养,每2~3天更换培养液。待细胞融合>80%,胰蛋白酶消化并传代。取对数生长期细胞接种于6孔板,随机分为空白对照组、阴性对照组、慢病毒组,37 ℃、5% CO2恒温细胞培养箱培养。待细胞融合>30%时更换无血清培养基,阴性对照组转染空病毒载体(pRI-CMV-GFP)、慢病毒组转染慢病毒载体,空白对照组不予任何处理。按照1 μg载体∶500 μL DMEM混合均匀,加入polybrene(5 μg/mL)增强病毒转染效率,室温孵育30 min;将混合物加入6孔板中,混匀后继续培养,转染12 h更换DMEM完全培养液。采用浓度递增的嘌呤霉素对转染后的细胞进行稳定表达筛选,细胞出现GFP绿色荧光表明转染成功。取各组细胞1×106个,采用miRNA提取试剂盒提取总miRNA,TaqMan microRNA逆转录试剂盒将miRNA逆转录成cDNA。以cDNA为模板进行Real-time PCR反应。以U6为内参校正PCR模板的拷贝数。以2-ΔΔCt法[5]计算各组miR-34a的相对表达量。每组设3个复孔,取平均值。
1.2.2HCT-116细胞增殖能力检测采用MTT法。细胞分组及转染同上,待转染成功后,采用胰蛋白酶消化制成单细胞悬液,按2×103个/孔接种于96孔板中。分别于0、24、48、72 h,加入10 μL MTT试剂,37 ℃孵育1 h,酶标仪480 nm处读取每孔的吸光度(OD)值。细胞增殖能力=(当日OD值-前日OD值)/前日OD值。
1.2.3HCT-116细胞迁移能力检测采用Transwell小室法。细胞分组及转染同上,待转染成功后,于Transwell小室下室加入1 mL完全培养基,迁移小室内加入200 μL细胞悬液(细胞密度1×106/mL),37 ℃孵育24 h;棉签擦拭迁移小室内未迁移至基底层细胞,向迁移小室内加入200 μL染色液染色30 min,去除染色液,向每孔加入乙酸溶解染料,转移至24孔板,置于酶标仪570 nm处读数。
1.2.4miR-34a靶点蛋白验证①采用细胞免疫荧光试验。细胞分组及转染同上,待转染成功后,于细胞培养板中将已爬好细胞的玻片用PBS浸洗,4%多聚甲醛常温下固定15 min,0.5% Triton X-100室温通透,PBS浸洗;玻片上滴加正常山羊血清,室温封闭30 min;每张玻片滴加一抗(anti-c-Met)并放入湿盒,4 ℃孵育过夜;次日去除一抗,PBS清洗后加入荧光二抗,湿盒37 ℃孵育1 h;使用含抗荧光淬灭剂的封片液封片,荧光显微镜下观察。②采用Western blotting法。细胞分组及转染同上,48 h后取1×106个细胞,加入10 μL RIPA裂解液,10 min后提取总蛋白,并测定蛋白浓度,各组取50 μg蛋白进行10% SDS-PAGE电泳。电泳结束后转膜至PVDF膜,用5% milk-TBS将膜封闭1 h,加入相应的第一抗体,静置,4 ℃过夜。次日使用TBST漂洗,辣根过氧化物酶(HRP)标记的二抗室温孵育1 h,显色拍照。
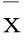
2结果
2.1各组miR-34a相对表达量比较转染48 h,慢病毒组和阴性对照组可见GFP绿色荧光,而空白对照组未见GFP绿色荧光,表明慢病毒转染成功。见插页Ⅰ图1。以空白对照组miR-34a表达为1,阴性对照组为1.03±0.09,慢病毒组为6.41±1.56。慢病毒组miR-34a表达高于阴性对照组、空白对照组(P均<0.01),而阴性对照组、空白对照组比较均无统计学差异(P>0.05)。
2.2各组细胞增殖能力及迁移能力比较见表1。
2.3miR-34a靶点蛋白验证结果细胞免疫荧光试验显示,慢病毒组c-Met的荧光强度显著降低,而空白对照组与阴性对照组无明显变化。见插页Ⅰ图2。Western blotting结果显示,以空白对照组c-Met及磷酸化c-Met表达为1,阴性对照组分别为1.10±0.22、1.14±0.31,慢病毒组分别为0.41±0.30、0.19±0.42。慢病毒组c-Met及磷酸化c-Met表达均低于阴性对照组、空白对照组(P均<0.01),而阴性对照组、空白对照组比较均无统计学差异(P均<0.01)。
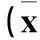
表1 各组细胞增殖能力及迁移能力比较±s)
注:与空白对照组、阴性对照组比较,*P<0.01。
3讨论
miRNAs是人体细胞内种类最多的表达调控因子,具有多种生物学功能[6~8]。目前,miRNAs在癌细胞恶性生物学行为的调控已成为肿瘤研究热点。有研究表明,肿瘤患者体内miRNAs表达谱已经出现显著差异,通过对其中差异化表达明显的miRNAs进行初步筛选,证实部分miRNAs表达与肿瘤预后相关[9~13]。miR-34a作为一种最新鉴定的、与多种癌症病理机制密切相关的miRNA,在前列腺癌、乳腺癌及胃癌中高表达,并与肿瘤的侵袭及转移密切相关。
为阐明miR-34a在结肠癌发生中的作用,本研究构建了miR-34a过表达的慢病毒载体,并稳定转染HCT-116细胞,通过嘌呤霉素和Real-time PCR法证实转染成功,并通过细胞功能试验证实过表达miR-34a可显著抑制HCT-116细胞增殖和迁移。
c-Met作为原癌基因,在多种癌细胞增殖、迁移和分化等过程中具有重要调节作用。c-Met在恶性肿瘤中过表达,可能与肿瘤的进展密切相关。Landskron等[14]研究发现,溃疡性结肠炎癌变黏膜c-Met表达明显增高。本研究结果显示,miR-34a可下调HCT-116细胞中靶点蛋白c-Met及磷酸化c-Met的表达。证实结肠癌细胞c-Met表达受miR-34a的调控,过表达miR-34a能够显著下调c-Met的表达,继而抑制结肠癌细胞的增殖和迁移。但在癌细胞的增殖、分化和迁移中,往往存在多种基因网络或信号通路的共同参与,如TREM2、SIRT1等,也受miR-34a的抑制或增强[15]。因此,要进一步明确miR-34a的作用及其机制,仍需对结肠癌相关基因的调控网络进行深入研究。
综上所述,过表达miR-34a可抑制结肠癌细胞增殖及迁移,并下调靶点蛋白c-Met及磷酸化c-Met表达,提示miR-34a可作为结肠癌治疗的分子靶点。
参考文献:
[1] Pereira DM, Rodrigues PM, Borralho PM, et al. Delivering the promise of miRNA cancer therapeutics[J]. Drug Discov Today, 2013,18(5-6):282-289.
[2] Schepeler T, Reinert JT, Ostenfeld MS, et al. Diagnostic and prognostic microRNAs in stage Ⅱ colon cancer[J]. Cancer Res, 2008,68(15):6416-6424.
[3] Hong JH, Roh KS, Suh SS, et al. The Expression of microRNA-34a is inversely correlated with c-Met and CDK6 and has a prognostic significance in lung adenocarcinoma patients[J]. Tumour Biol, 2015,36(12):9327-9337.
[4] Xu X, Chen W, Miao R, et al. miR-34a induces cellular senescence via modulation of telomerase activity in human hepatocellular carcinoma by targeting foxM1/c-Myc pathway[J]. Oncotarget, 2015,6(6):3988-4004.
[5] Schmittgen TD, Livak KJ. Analyzing real-time PCR data by the comparative C(T) method[J]. Nat Protoc, 2008,3(6):1101-1108.
[6] Shenouda SK, Alahari SK. microRNA function in cancer: oncogene or a tumor suppressor[J]. Cancer Metastasis Rev, 2009,28(3-4):369-378.
[7] Calin GA, Croce CM. microRNA signatures in human cancers[J]. Nat Rev Cancer, 2006,6(11):857-866.
[8] Mo YY. microRNA regulatory networks and human disease[J]. Cell Mol Life Sci, 2012,69(21):3529-3531.
[9] Schetter AJ, Leung SY, Sohn JJ, et al. microRNA expression profiles associated with prognosis and therapeutic outcome in colon adenocarcinoma[J]. JAMA, 2008,299(4):425-436.
[10] Duan K, Ge YC, Zhang XP, et al. miR-34a inhibits cell proliferation in prostate cancer by downregulation of SIRT1 expression[J]. Oncol Lett, 2015,10(5):3223-3227.
[11] Li G, Yao L, Zhang J, et al. Tumor-suppressive microrna-34a inhibits breast cancer cell migration and invasion via targeting oncogenic TPD52[J]. Tumour Biol, 2015.[Epud ahead of print]
[12] Cho CY, Huang JS, Shiah SG, et al. Negative feedback regulation of AXL by miR-34a modulates apoptosis in lung cancer cells[J]. RNA, 2015. [Epud ahead of print]
[13] Yan D, Zhou X, Chen X, et al. microRNA-34a inhibits uveal melanoma cell proliferation and migration through downregulation of c-Met[J]. Invest Ophthalmol Vis Sci, 2009,50(4):1559-1565.
[14] Landskron G, De la Fuente M, Thuwajit P, et al. Chronic inflammation and cytokines in the tumor microenvironment[J]. J Immunol Res, 2014,2014:149185.
[15] Yamakuchi M, Ferlito M, Lowenstein CJ. miR-34a repression of SIRT1 regulates apoptosis[J]. Proc Natl Acad Sci U S A, 2008,105(36):13421-13426.
Function and molecular mechanism of miR-34a in proliferation and migration of colon cancer
ZHUANGBiao,MINZhijun,WANGYanfeng,ZHANGPeng,NIXiong,QUHuilong,DINGYuming
(ShanghaiPudongHospital,Shanghai201399,China)
Abstract:ObjectiveTo explore the role of miR-34a in the proliferation and migration of colon cancer cells, and to validate the target protein. MethodsThe empty vector (pRI-CMV-GFP) and lentiviral vector (pRI-CMV-GFP-miRNA-34a vector) were transfected into human colon cancer cell line (HCT-116) as the negative control group and lentiviral group, while HCT116 cells without any processing were regarded as the blank control group. The expression of miR-34a was detected by real-time PCR. MTT and Transwell assays were used to detect HCT-116 cell proliferation and migration. Immunofluorescence and Western blotting were applied to verify the target gene of miR-34a in HCT-116. ResultsThe expression of miR-34a in the blank control group was taken as 1, the expression of miR-34a in the negative control group and lentiviral group was 1.03±0.09 and 6.41±1.56, respectively. The lentiviral group was higher than the negative control group and blank control group (all P<0.01), which confirmed lentiviral transfection was successful. Compared with the blank control group and negative control group, the proliferation and migration abilities of HCT-116 cells in the lentiviral group were significantly decreased (all P<0.01). Moreover, the fluorescence intensity of c-Met in the lentiviral group was significantly decreased while no change was found in the other two groups. Western blotting showed that the expression of c-Met and phosphorylated c-Met in the lentiviral group was lower than that of the negative control and blank control group (all P<0.01). ConclusionOver-expression of miR-34a inhibits the proliferation and migration of colon cancer cells and down-regulates the target protein c-Met and phosphorylated c-Met expression, which suggests miR-34a could be a effective molecular target in treatment of colon cancer.
Key words:colon cancer; miR-34a; cell proliferation; cell migration; c-Met
(收稿日期:2015-11-21)
中图分类号:R735.3
文献标志码:A
文章编号:1002-266X(2016)08-0014-03
doi:10.3969/j.issn.1002-266X.2016.08.005
作者简介:第一庄彪(1969-),男,副主任医师,主要研究方向为胃肠道肿瘤综合治疗。E-mail: zhuangbiao2000@163.com
基金项目:上海市浦东新区卫生和计划生育委员会卫生科技项目(PW2014A-28)。
