巴西橡胶树核糖体蛋白HbRPL14基因逆境响应机制
2016-04-17王立丰王纪坤谢贵水
王立丰 王纪坤 安 锋 谢贵水
(中国热带农业科学院橡胶研究所,农业部儋州热带作物科学观测试验站,海南儋州571737)
巴西橡胶树核糖体蛋白HbRPL14基因逆境响应机制
王立丰 王纪坤 安 锋 谢贵水
(中国热带农业科学院橡胶研究所,农业部儋州热带作物科学观测试验站,海南儋州571737)
为研究核糖体蛋白在橡胶树逆境响应中的作用机制,从巴西橡胶树品种热研7-33-97叶片中克隆了核糖体HbRPL14基因,并进行HbRPL14蛋白的生物信息学分析及HbRPL14基因的表达分析。结果表明:其编码蛋白含有特征性核糖体_L14家族结构域,该基因在橡胶树胶乳、花和叶片中表达,但在树皮中不表达。采用荧光定量分析技术证明干旱、机械伤害和白粉菌侵染均显著上调HbRPL14基因表达,表明核糖体HbRPL14基因受逆境调控,通过提高核糖体蛋白合成水平,参与橡胶树对干旱、机械伤害和白粉菌侵染的响应。
巴西橡胶树;干旱;核糖体蛋白;HbRPL14;基因;逆境响应
巴西橡胶树(Hevea brasiliensis)起源于热带,在我国种植经常面临干旱[1]、寒害[2]等逆境胁迫,橡胶树抗旱、抗寒和抗病等抗逆反应与植物内部蛋白含量或者酶活性增加显著相关[3]。核糖体是细胞内最重要的细胞器之一,在生物体将DNA所包含的基因信息翻译为蛋白质的过程中,核糖体在mRNA的指导下合成相应的蛋白质。在翻译过程中,核糖体需要解读mRNA的密码子,招募相应的氨酰tRNA,并催化肽链的生成[4]。真核生物核糖体的沉降系数为80S,它们含有2个亚基,沉降系数分别为60S和40S[4-6]。目前,在拟南芥(Arabidopsis thaliana)[7],刺参(Apostichopus japonicus)[8],橡胶树[9]等多种物种中发现核糖体蛋白,但对其在逆境相响应过程中的作用尚不清楚。已有研究证明,核糖体蛋白会与钙调蛋白[10]、C7orf30[3]以及核糖体蛋白之间互相结合[11]。笔者推测,作为翻译调控的重要环节,核糖体蛋白参与橡胶树抗逆反应中的蛋白合成。本研究克隆了核糖体RPL14蛋白基因,采用生物信息学技术分析其定位和功能,并在干旱等处理下研究其在橡胶树抗逆响应中的作用。
1 材料与方法
1.1 试验材料
以位于中国热带农业科学院实验场二队15年生巴西橡胶树品种热研7-33-97成龄开割树为材料,采集叶片、胶乳、花和树皮用于组织表达分析[12]。以中国热带农业科学院实验场五队培育的热研7-33-97芽接苗为材料,选取均匀一致的2蓬叶且顶棚叶片处于稳定期的芽接苗进行干旱、机械伤害和白粉菌侵染等处理。
1.2 试验方法
1.2.1 植物材料RNA提取和cDNA合成 胶乳、叶片等材料总RNA提取根据Qin等方法[12],利用DNase I去除RNA中残留的少量DNA。所提取的RNA经紫外分光光度计测定OD230、OD260和OD280吸收值以检测纯度,同时采用1%甲醛变性胶电泳检测RNA的完整性。cDNA第Ⅰ链合成参照RevertAidTM First Strand cDNA Synthesis Kit,Fermentas试剂盒说明书[13]。
1.2.2 HbRPL14基因的克隆 根据Genbank上公布人类、拟南芥和蓖麻(Ricinus communis)等核糖体L14蛋白序列,在橡胶树EST数据库中做tblastn搜索,通过DNAman8.0软件拼接同源片段,得到巴西橡胶树核糖体RPL14基因的cDNA序列。采用primer6.0软件设计基因特异引物RPL14F1(5’-AGAGATGACCTATGGCAATG-3’)和RPL14R1(5’-CTACAACGGAAGGAGAAAGA-3’),以反转录的叶片cDNA第Ⅰ链为模板,扩增巴西橡胶树核糖体蛋白HbRPL14基因的cDNA序列。使用2× Taq PCR MasterMix(天根生化)进行PCR扩增,反应体系为:cDNA 2μL,上游引物(10μmol/L)1μL,下游引物(10μmol/L)1μL,2×PCR MasterMix 25 μL,加ddH2O至50μL。PCR扩增程序为94℃变性3 min;94℃变性30 s,55℃退火50 s,72℃延伸2 min,35个循环;72℃延伸10 min。扩增产物经1%的琼脂糖凝胶电泳后,切下目的片段,凝胶回收纯化,并克隆到pMD19-T载体上,经菌落PCR检测,送上海立菲生物技术有限公司广州测序部进行测序验证。
1.2.3 HbRPL14蛋白的生物信息学分析 采用NCBIORF Finder在线分析工具预测基因的ORF及其编码的氨基酸序列,通过Expasy的ProtParam在线分析软件分析巴西橡胶树核糖体蛋白HbRPL14蛋白中各种氨基酸含量,并预测得到理论分子量和等电点;用NCBI Conserved Domains数据库和SMART在线分析软件分析蛋白的结构;用SignalP 4.1 Server在线分析软件分析信号肽结构;用TMHMM 2.0 Server在线分析软件分析蛋白跨膜结构域。在NCBI蛋白数据库中通过Blastp搜索其他物种的核糖体蛋白HbRPL14同源蛋白并获取其序列,利用DNAman8.0软件进行多重序列比对。
1.2.4 HbRPL14基因表达分析 干旱处理采用先将芽接苗浇水至饱和,然后放在光照培养箱进行断水处理,连续采集0~10 d叶片为材料[14];机械伤害处理采用Qin等的方法[12];白粉菌处理采用笔者的方法[15]。以荧光定量引物HbRLP14F(5’-TTCTGGCTTGTTGGACTC-3’)和HbRLP14R(5’-ATTGGCTGACCTTGCTTAT-3’)扩增,以HbACTIN(基因登录号:HO004792)HbACTIN F,5’-GATGTGGATATCAGGAAGGA-3’;HbACTIN R,5’-CATACTGCTTGGAGCAAGA-3’为内参基因。使用BioRad公司的CFX-96荧光定量PCR仪进行荧光定量PCR,反应程序为:95℃预变性30 s;94℃5 s,60℃20 s,72℃20 s扩增45个循环。扩增结束后进行溶解曲线制作,从50℃逐渐升温至95℃,升温速度0.2℃/s,全过程检测荧光信号。HbRPL14的表达量采用公式Qt=2-Ct(HbACTIN)-Ct(HbRPL14)计算,Ct为每个反应管内的荧光信号到达设定的域值时所经历的循环数。倍数是指处理叶片和同期对照叶片HbRPL14表达量的比值。
1.3 分析方法
采用SPSS软件(版本号21)进行统计分析,采用单因素方差分析和Duncan检验分析不同处理间基因表达的差异显著性。采用Origin 2015软件作图。
2 结果与分析
2.1 HbRPL14基因克隆与生物信息学分析
采用PCR扩增技术克隆的HbRPL14基因(基因登录号KM086720),全长1 054 bp,其5’端长度为237 bp,3’端长度为244 bp,编码区长度为573 bp,编码191氨基酸(图1)。其推导氨基酸分子量为20.7 kDa,等电点10.51,分子式为C902H1492N278O256S11,为疏水性稳定蛋白。其推导氨基酸与葡萄(Vitis vinifera)VvHLP(XP_010655685.1),蓖麻(Ricinus communis)RcRPL14(XP_002526273.1),番茄(Solanum lycopersicum)SlHLPXP_010318617.1)和山杜英(Nicotiana sylvestris)NsHLPXP_009803545.1)相似性分别为71.2%,75.39%,67.02%和67.54%,是60s核糖体蛋白RPL14家族成员(图2)。

从图3可以看出,HbRPL14推导的氨基酸序列不含有信号肽和跨膜结构域,72~191位氨基酸编码特异的Ribosomal_L14 superfamily结构域。亚细胞定位分析表明其在线粒体基质空间、线粒体内膜、线粒体内膜间隙和线粒体外膜的几率分别为0.92、0.60、0.60和0.60,表明HbRPL14定位在线粒体上。

2.2 HbRPL14基因的表达分析
从图4可以看出,干旱处理橡胶树芽接苗10 d的叶片中,HbRPL14在第3天有显著上调的表达趋势,随后随着干旱处理时间的延长,其表达量逐渐下降。由此说明,核糖体蛋白HbRPL14参与橡胶树干旱响应的关键时期为第3天。

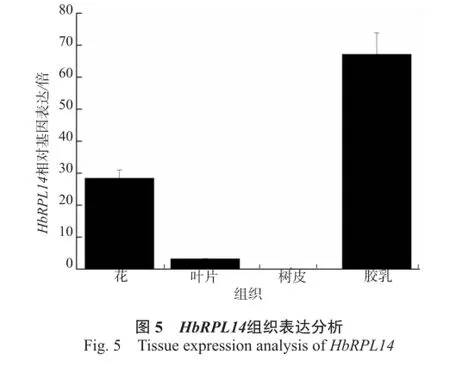
从图5可以看出,HbRPL14在胶乳中的表达量最高,在花和叶片胶乳表达量次之,在树皮中不表达。说明其主要在胶乳、花和叶片中起作用。
从图6可以看出,机械伤害处理叶片后,在1~2 h上调HbRPL14的表达,随后持续上升,其表达最高峰出现在机械伤害处理后的10~24 h,说明HbRPL14参与橡胶树对机械伤害的早期反应。白粉菌侵染后不同级别的叶片中HbRPL14的表达显著上调,尤其在3级和4级叶片中上调分别为6倍左右(图7)。说明白粉菌侵染会导致核糖体蛋白HbRPL14表达的显著增加,与干旱和机械伤害的结果一致。

3 结论与讨论
本试验克隆的HbRPL14基因含有核糖体L14蛋白家族特征的结构域,参与橡胶树对干旱、机械伤害和白粉菌侵染的响应。
鉴于核糖体蛋白在翻译中的作用,对核糖体蛋白的结构和定位研究十分深入[16-19]。发现其定位在线粒体中[16],受磷酸化调控[17],并获得了玉米(Zea mays)[20]、衣藻(Chlamydomonas reinhardtii)[21]和大肠杆菌(Escherichia coli)[22]核糖体蛋白L14的序列[23-24]。本试验从橡胶树品种热研7-33-97叶片中克隆了HbRPL14基因,与葡萄和蓖麻中的核糖体蛋白RPL14相似度达70%以上,含有特征性核糖体_L14结构域,没有跨膜结构和信号肽,并具有定位在线粒体的特点,说明HbRPL14是植物核糖体蛋白RPL14家族成员。
近年来,核糖体蛋白L14调控机制研究进展十分迅速,发现油菜素内酯调控核糖体蛋白在拟南芥悬浮培养细胞的核分裂中起作用[25]。随后,又发现核糖体基因参与酵母凋亡的线粒体依赖途径[26],核糖体调控机制正逐渐成为研究热点[27-28],橡胶树生长发育过程中经常遇到干旱、寒害和病虫害侵染等胁迫。研究发现,干旱会诱导橡胶树叶片产生活性氧,进而导致活性氧淬灭酶基因表达和活性增加。干旱处理3~5 d是橡胶树生理反应的关键时期。本试验中核糖体蛋白HbRPL14基因受干旱上调表达,其在第3天表达丰度最高,说明其同其他活性氧淬灭酶一起参与了橡胶树抗旱生理反应。随后,由于干旱的加重,导致其基因表达持续下降,机械伤害和白粉菌侵染亦会导致叶片中活性氧含量上升。研究显示橡胶树核糖体蛋白HbRPL14基因参与抗逆调控机制。
[1] 王立丰,王纪坤,谢贵水.巴西橡胶树抗旱机制研究进展[J].热带作物学报,2015,36(2):426-431.
[2] 王立丰,吴绍华,田维敏.巴西橡胶树抗寒机制研究进展[J].热带作物学报,2012,37(7):1320-1325.
[3] Fung S,Nishimura T,Sasarman F,et al.The conserved interaction of C7orf30 with MRPL14 promotes biogenesis of the mitochondrial large ribosomal subunit and mitochondrial translation[J].Mol Biol Cell,2013,24(3):184-193.
[4] 杨品红,王志陶,王志勇.核糖体的结构与功能研究[J].安徽农业科学,2011,36(6):3184-3189.
[5] 吴晓华,刘望夷.核糖体的结构与功能研究进展[J].生命的化学(中国生物化学会通讯),1996,16(3):1-4.
[6] 明镇寰.核糖体结构研究进展[J].浙江大学学报(理学版),2001,28(1):67-71.
[7] 范艳荣,刘莹,张飞云.拟南芥RPS14基因的克隆表达及功能初步研究[J].生物技术通报,2013(1):73-77.
[8] 王艳枫,李霞,秦艳杰.刺参核糖体蛋白L17基因(RPL17)全长cDNA克隆及组织表达[J].农业生物技术学报,2013,21(5):562-569.
[9] 邹智,杨礼富.巴西橡胶树线粒体50S核糖体蛋白L21 cDNA的克隆与分析[J].生物技术通报,2011(3):100-104.
[10] Behnen P,Davis E,Delaney E,et al.Calcium-dependent interaction of calmodulin with human 80S ribosomes and polyribosomes[J].Biochemistry,2012,51(34):6718-6727.
[11] Maisnier-Patin S,Paulander W,Pennhag A,et al. Compensatory evolution reveals functional interactions between ribosomal proteins S12,L14 and L19[J].JMol Biol,2007,366(1):207-215.
[12] Qin B,Zheng F,Zhang Y.Molecular cloning and characterization of a Mlo gene in rubber tree(Hevea brasiliensis)[J].Journal of Plant Physiology,2015,175:78-85.
[13] 覃碧,王萌,林雨见,等.巴西橡胶树HbMlo9基因克隆及其序列特征分析[J].热带农业科学,2013,33(8):47-52.
[14] Wang L F.Physiological and molecular responses to drought stress in rubber tree(Hevea brasiliensis Muell. Arg.)[J].Plant Physiol Biochem,2014,83:243-249.
[15] Wang L F,Wang M,Zhang Y.Effects of powderymildew infection on chloroplast and mitochondrial functions in rubber tree[J].Tropical Plant Pathology,2014,39(3):242-250.
[16] Tischendorf GW,Zeichhardt H,Stoffler G.Determination of the location of proteins L14,L17,L18,L19,L22,L23 on the surface of the 5oS ribosomal subunit of Escherichia coli by immune electron microscopy[J]. Mol Gen Genet,1974,134(3):187-208.
[17] Leader D P,Coia A A.The phosphorylation of ribosomal proteins L14 and S3 in Krebs II ascites cells[J]. Biochim Biophys Acta,1978,519(1):223-224.
[18] Morinaga T,Funatsu G,Funatsu M.Primary structure of protein L14 isolated from Escherichia coli ribosomes[J].FEBSLett,1978,91(1):74-77.
[19] Tsurugi K,Collatz E,Todokoro K,et al.Isolation of eukaryotic ribosomal proteins.Purification and characterization of the 60 S ribosomal subunit proteins La,Lb,Lf,P1,P2,L13’,L14,L18’,L20,and L38[J].JBiol Chem,1978,253(3):946-955.
[20] Markmann-Mulisch U,Subramanian A R.Nucleotide sequence and linkagemap position of the genes for ribosomal proteins L14 and S8 in themaize chloroplast genome[J].Eur JBiochem,1988,170(3):507-514.
[21] Lou JK,Cruz F D,Wu M.Nucleotide sequence of the chloroplast ribosomal protein gene L14 in Chlamydomonas reinhardtii[J].Nucleic Acids Res,1989,17(9):3587.
[22] Mattheakis L,Vu L,Sor F,et al.Retroregulation of the synthesis of ribosomal proteins L14 and L24 by feedback repressor S8 in Escherichia coli[J].Proc Natl Acad Sci U SA,1989,86(2):448-452.
[23] Beccari E,Mazzetti P,Mileo A,et al.Sequences coding for the ribosomal protein L14 in Xenopus laevis and Xenopus tropicalis;homologies in the 5'untranslated region are shared with other r-protein mRNAs[J].Nucleic Acids Res,1986,14(19):7633-7646.
[24] Beccari E,Mazzetti P.The nucleotide sequence of the ribosomal protein L14 gene of Xenopus laevis[J].Nucleic Acids Res,1987,15(4):1870-1872.
[25] Shigeta T,Yasuda D,Mori T,et al.Characterization of brassinosteroid-regulated proteins in a nuclear-enriched fraction of Arabidopsis suspension-cultured cells[J]. Plant Physiology and Biochemistry,2011,49(9):985-995.
[26] Cao S,Xu W,Zhang N,et al.A mitochondria-dependent pathwaymediates the apoptosis ofGSE-induced yeast[J].PLoSONE,2012,7(3):e32943.
[27] Häuser R,Pech M,Kijek J,et al.RsfA(YbeB)proteins are conserved ribosomal silencing factors[J]. PLoSGenetics,2012,8(7):e1002815.
[28] Meijer IM J,van Rotterdam W,van Zoelen E J J,et al.Cbl and Itch binding sites in ERBB4 CYT-1 and CYT-2 mediate K48-and K63-polyubiquitination,respectively[J].Cellular Signalling,2013,25(2):470-478.
(责任编辑 张 坤)
Stress Responsive Mechanisms of Ribosomal Protein HbRPL14 Gene in Rubber Tree(Hevea brasiliensis)
Wang Lifeng,Wang Jikun,An Feng,Xie Guishui
(Danzhou Investigation&Experiment Station of Tropical Crops ofMinistry of Agriculture,Rubber Research Institute of Chinese Academy of Tropical Agricultural Sciences,Danzhou Hainan 571737,China)
In order to study the mechanism of ribosomal protein of rubber tree in stress response,HbRPL14 gene was cloned from leaves of the rubber tree CATAS7-33-97,characteristics of bioinformatics and gene expression were analyzed.Tissue analysis showed that its coding area contained specific Ribosomal_L14 superfamily domain.The expression was highest in latex,flower and leaf,while not expressed in bark.Q-PCR analysis showed that drought,mechanicalwounding and powderymildew infection up-regulated HbRPL14 expression at significantly levels.These suggested that HbRPL14 was inducted by stress environment,through increase the ribosomal protein synthesis level,play roles in physiological and molecular stress resistance in rubber tree.
Hevea brasiliensis;drought;ribosomal protein;HbRPL14;gene;stress response

S718.46
A
2095-1914(2016)02-0067-05
10.11929/j.issn.2095-1914.2016.02.011
2015-07-09
现代农业产业技术体系建设专项资金资助(CARS-34-GW5);国家自然科学基金(31270643)资助;海南省自然科学基金(20153135)资助;中国热带农业科学院橡胶研究所基本科研业务费专项资助(1630022015013)。
第1作者:王立丰(1975—),男,博士,副研究员。研究方向:橡胶树逆境生理与分子生物学。Email:lfngwang@yahoo.com。
谢贵水(1967—),男,博士,研究员。研究方向:橡胶树生态学。Email:xie23300459@163.com。
