靶向下调Cep55表达水平对肝癌细胞增殖能力的影响
2016-04-17孟凡迪张靖垚付军科吴齐飞
张 勇,孟凡迪,张靖垚,付军科,刘 昌,吴齐飞
(西安交通大学第一附属医院:1. 胸外科;2. 肝胆外科,陕西西安 710061)
靶向下调Cep55表达水平对肝癌细胞增殖能力的影响
张 勇1,孟凡迪2,张靖垚2,付军科1,刘 昌2,吴齐飞1
(西安交通大学第一附属医院:1. 胸外科;2. 肝胆外科,陕西西安 710061)
目的 通过siRNA干扰技术下调中心体相关蛋白Cep55的表达水平,并检测对肝癌HepG2和Hep3B细胞增殖能力的影响,为原发性肝癌的基因靶向治疗提供理论依据。方法 应用Cep55特异性siRNA转染肝癌HepG2和Hep3B细胞,采用Real-time PCR和Western blot方法分别从mRNA和蛋白质水平检测Cep55 siRNA对Cep55基因的干扰效果,MTT法检测下调Cep55表达水平时细胞增殖能力的变化,流式细胞仪检测细胞周期分布变化。结果 与阴性对照组比较,干扰siRNA组Cep55的mRNA及蛋白表达水平均出现明显降低(P<0.05);MTT检测结果显示下调Cep55表达水平能够显著抑制肝癌细胞增殖(P<0.05);流式细胞仪检测显示下调Cep55表达水平能够增加G1期细胞的比例,同时降低G2-M期细胞的比例,出现明显的G2期阻滞。结论 下调Cep55表达水平能够显著抑制肝癌细胞的增殖能力,并出现G2期阻滞,提示Cep55可能成为原发性肝癌的有效治疗靶点。
中心体相关蛋白Cep55;原发性肝癌;细胞增殖;细胞周期;siRNA
原发性肝癌是全球最主要的恶性肿瘤之一,其病程进展迅速,并具有很高的复发及转移率;近年来成为我国肿瘤相关死亡率的第二位,仅次于肺癌,已成为影响人类身体健康并造成经济重大危害的世界卫生问题。原发性肝癌主要治疗方式目前仍是手术切除,但因其起病隐匿,早期发现困难,致使确诊时病程往往进展到局部晚期或有远处转移,单纯手术切除困难,且术后肝癌的复发率较高。因此,探索关于原发性肝癌有效的早期检测与治疗手段,对提高肝癌患者的术后生存质量有重要实际意义。
中心体相关蛋白(centrosomal protein 55 ku, Cep55)是新近发现的典型卷曲螺旋蛋白家族成员之一,其主要功能是锚定微管聚合相关蛋白,参与纺锤体形成,进而调控细胞增殖。研究表明,Cep55与多种肿瘤的发生发展关系密切[1],但是尚未见研究报道其对原发性肝癌生物学功能的影响。本研究通过体外应用siRNA干扰技术,抑制Cep55在HepG2和Hep3B细胞中的表达,观察其对肝癌细胞增殖能力的影响,以探寻Cep55对肝癌细胞生物学功能的影响。
1 材料与方法
人肝癌细胞HepG2和Hep3B均购自中科院上海细胞研究所,Cep55干涉siRNA购自上海吉玛科技有限公司。其具体序列如下:Cep55-siRNA#1:5′-GGAGAAGAAUGCUUA-UCAAUU-3′;Cep55-siRNA#2:5′-GAAGAGAAU-GAUAUUGCUAUU-3′;Control-siRNA:5′-GCAA-GCUGACCCUGAAGUUCAU-3′。细胞培养液RPMI-1640、胎牛血清(FBS)购自北京鼎国生物技术有限公司,Lipofectamine 2000转染试剂购自上海玉博生物科技有限公司,SYBR Real-time PCR试剂盒和cDNA反转录试剂盒购自大连宝生生物公司,Cep55兔抗人多克隆抗体购自美国Santa Cruz公司,免疫组化染色试剂盒、HRP标记山羊抗兔IgG二抗试剂盒和DAB显色试剂盒购自北京中杉金桥生物技术有限公司,MTT检测试剂盒和流式细胞周期检测试剂盒购自美国Sigma公司。
1.2 细胞培养
人肝癌细胞株HepG2和Hep3B均在含100 mL/L FBS的RPMI-1640培养液中培养,根据需要加入青霉素(100 μg/mL)和链霉素(100 μg/mL)防止细胞被细菌污染;将含有细胞及RPMI-1640完全培养基的培养皿放置于50 mL/L CO2细胞培养箱中,37 ℃常规培养,隔天换液,3~5 d传代。
1.3 细胞转染
取增殖期细胞接种于6孔板上,当细胞密度达到底面积的70%左右时弃去培养皿内的液体,PBS洗涤2次,更换新配制的不含血清及抗生素的DMEM培养基培养1 h;取适量的siRNA与Lipofectamine 2000各加入250 μL不含血清及抗生素的DMEM培养基中,使用移液器缓慢吹打混匀,常温放置10 min;将上述siRNA与Lipofectamine 2000各250 μL稀释液混匀,室温孵育15 min;用无血清DMEM培养基漂洗细胞2次,将孵育好的混合液500 μL转移至6孔板中,轻轻摇匀,使其覆盖整个皿底;37 ℃、50 mL/L CO2细胞培养箱中孵育8 h后,更换含100 mL/L FBS的DMEM培养基(不含抗生素),继续培养24 h。
1.4 肝癌细胞中Cep55表达水平的检测
Cep55 siRNA转染HepG2和Hep3B细胞后,提取RNA样品,应用Real-time PCR检测Cep55基因mRNA表达水平的变化,方法按照试剂盒说明书操作,计算Cep55基因相对表达量(2-ΔΔCt)。
液体饲料配方设计中,受副产品中的水分和盐含量影响,干物质采食量成为液体饲喂模式的第一限制因子,合适的水料比、多餐饲喂和饮水设计显得非常重要[2](见表1)。由于物料形态不同,在水的介导下,一些物料的营养价值发生改变。Perez等[6]研究表明,玉米胚芽粕和玉米麸在添加玉米浆后,代谢能分别提高17%和12%,且总能、干物质、N、钙、磷的消化率提高。在生长育肥阶段,赖氨酸能量比每天略为降低,成本利益将增加。高权新[7]研究结果显示,随着浸泡时间的增加,发酵液体饲料中的植酸降解率大幅度提高。仔猪、生长猪和育肥猪液体饲料总磷为0.6%、0.47%、0.39%时生产性能不受影响。
另提取蛋白,应用Western blot法检测转染后Cep55蛋白表达的变化,具体方法依照产品说明书进行,Cep55一抗工作液稀释比为1∶500。
1.5 MTT法检测细胞增殖能力
实验分为无义序列阴性对照siRNA转染组和Cep55 siRNA Mix转染组。取对数生长期细胞,用培养液调整细胞悬液密度达2×103/L后接种于96孔板。在1、2、3、4、5 d每孔分别加入5 g/L MTT溶液10 μL,于37 ℃培养4 h。吸弃孔内培养液,每孔加入DMSO 100 μL,振荡器上振荡10 min使结晶充分溶解,酶标仪检测490 nm波长处的吸光度(A)值,记录结果并绘制细胞生长曲线。
1.6 流式细胞术检测细胞周期
消化转染后处于对数生长期细胞,使细胞完全分散变为单个细胞,预冷的PBS洗涤2次,1 500 r/min离心5 min收集细胞,弃上清,加入1 mL预冷PBS重悬细胞,加入PI(1∶40)及RNase(1∶100)避光冰浴10 min,流式细胞仪检测细胞周期,方法按照流式细胞周期分析试剂盒产品说明书操作。
1.7 统计学分析
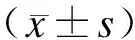
2 结 果
2.1 Cep55基因沉默效果情况
利用Western blot及Real-time PCR技术检测HepG2和Hep3B肝癌细胞转染后Cep55的表达变化进行评估。分别应用两种Cep55 siRNA转染HepG2和Hep3B肝癌细胞后,HepG2转染细胞内Cep55蛋白(siRNA#1:0.611±0.099;siRNA#2:0.159±0.052)和Hep3B转染细胞内Cep55蛋白(siRNA#1:0.261±0.066;siRNA#2:0.062±0.028)的表达水平相比于各自对照siRNA组蛋白(HepG2,control siRNA:1±0.121;Hep3B,control siRNA:1±0.112)水平均显著降低(图1);HepG2转染细胞内Cep55 mRNA(siRNA#1:0.431±0.069;siRNA#2:0.109±0.041)和Hep3B转染细胞内Cep55 mRNA(siRNA#1:0.217±0.056;siRNA#2:0.032±0.011)较各自对照组mRNA(HepG2,control siRNA:1±0.091;Hep3B,control siRNA:1±0.092)水平均显著降低(图2)。

图1 Western blot检测经Cep55 siRNA转染的HepG2和Hep3B肝癌细胞中Cep55蛋白的表达变化
Fig.1 Cep55 protein expression in HepG2 and Hep3B cells after transfection with Cep55 siRNA detected by Western blot
1:control siRNA;2:Cep55-siRNA#1;3:Cep55-siRNA#2。与control siRNA组比较,*P<0.05。

图2 应用Real-time PCR检测经Cep55 siRNA转染的HepG2和Hep3B中Cep55 mRNA的表达变化
Fig.2 Cep55 mRNA expression in HepG2 and Hep3B cells after transfection with Cep55 siRNA detected by Real-time PCR
1:control siRNA;2:Cep55-siRNA#1;3:Cep55-siRNA#2。与control siRNA组比较,*P<0.05。
在后续Cep55相关的siRNA干扰实验中,我们将Cep55 siRNA#1与Cep55 siRNA#2进行混合转染,以此尽量避免siRNA实验中出现的脱靶效应。
2.2 Cep55沉默表达对肝癌细胞增殖能力的影响
对转染pcDNA3.1-Cep55和Cep55 siRNA Mix的HepG2和Hep3B肝癌细胞的MTT检测结果显示:Cep55 siRNA Mix组细胞的增殖抑制在转染第3天开始出现,在转染3、4、5 d的增殖能力较对照组抑制差异有统计学意义(图3)。

图3 MTT检测Cep55 siRNA Mix转染HepG2(A)和Hep3B(B)肝癌细胞的增殖变化
Fig.3 Proliferation of HepG2(A) and Hep3B(B) cells after transfection with Cep55 siRNA Mix detected by MTT assay
与control-siRNA转染组比较,*P<0.05。
2.3 流式细胞术检测转染时细胞周期的变化
HepG2和Hep3B肝癌细胞转染Cep55 siRNA Mix后,流式细胞术结果显示:Cep55 siRNA Mix抑制两种肝癌细胞Cep55的表达,HepG2细胞的G2-M期、S期、G1期(37.99%、31.80%、30.21%)与对照组(18.27%、36.29%、45.45%)比较,G2-M期细胞比例显著升高,G1期细胞比例降低;Hep3B细胞的G2-M期(31.84%)较对照组(12.39%)显著升高,G1期细胞的比例(37.78%)较对照组(50.31%)降低(图4)。
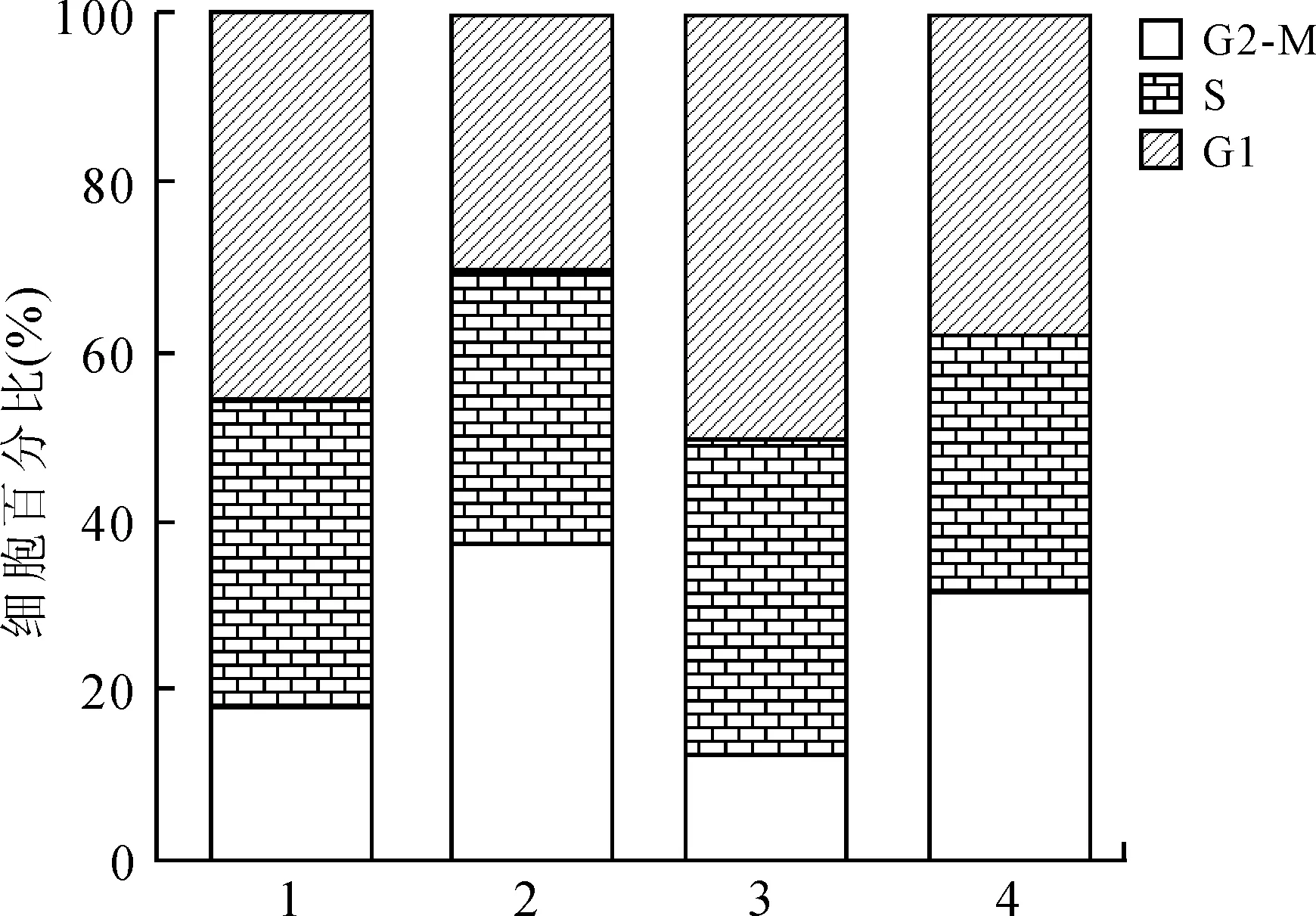
图4 流式细胞术检测Cep55 siRNA Mix转染HepG2和Hep3B肝癌细胞时细胞周期分布变化
Fig.4 FCM analysis of the cell cycle distribution structure of HepG2 and Hep3B cells after transfection with Cep55 siRNA Mix
1:HepG2 control-siRNA;2:HepG2 Cep55-siRNA;3:Hep3B control-siRNA;4:Hep3B Cep55-siRNA。
3 讨 论
原发性肝癌是全球目前最常见的恶性肿瘤之一,其来源主要分为两种:肝实质细胞和肝内胆管内皮细胞[2]。肝细胞癌(hepatocellular carcinoma, HCC)是原发性肝癌主要的组织学类型,占总体的85%~90%[3]。近年来原发性肝癌在我国所导致的死亡率仅次于肺癌,我国HCC患者占世界HCC总死亡率的55%[4]。目前针对原发性肝癌主要治疗方式仍为手术切除[5],但其起病隐匿,早期发现困难,确诊时病程往往进展到局部晚期或有远处转移,术后复发率较高[6]。因此新的化疗药物及分子靶向药物的应用成为原发性肝癌的研究热点,探讨其发病机制并寻找有潜力的生物标记分子,为肝癌的个性化治疗提供有力的理论依据。
Cep55定位于人染色体10q23.33,其转录的cDNA由464个氨基酸构成,包含9个外显子,根据其所编码区域的不同被划分为3个部分:N端(1-57);三联螺旋域(57-355);C端(355-464)[7]。Cep55在许多组织器官(脾、肾、肝、肺、胸腺、前列腺、睾丸、卵巢、胚胎、小肠、结肠、心、脑和骨骼肌等)中均有表达,其中以睾丸中表达量最高,胸腺次之[8]。研究表明,Cep55可与微管聚集相关蛋白CG-NAP和Kendrin相互作用而参与纺锤体的装配。Cep55是通过其C端与中心体相关蛋白CG-NAP和Kendrin的偶联而锚定于中心体上的[8],而CG-NAP和Kendrin是γ-微管蛋白和其他蛋白质构成的γ-微管蛋白环形复合物(γ-TuRC)的主要调控者。该蛋白质复合物是微管的一种高效集结结构,是中心体微管装配的起始结构[9]。可见,Cep55虽不是微管聚集、纺锤体装配所必需, 但是可通过相关蛋白质而参与此过程的调控[10]。Cep55表达水平的降低可导致多核细胞、中期纺锤体异常(多于2个),并且许多细胞停滞于中间体阶段,胞质分裂失败,这些现象证明了Cep55在纺锤体装配、极化、分离及胞质分裂中的重要调控作用。此外,Cep55表达异常通常会导致中心体异常,而这一中心体异常现象在多种肿瘤细胞中频繁发生,因此,Cep55可能与肿瘤的发生发展存在潜在的相关性[11]。
研究表明,Cep55与多种肿瘤的发生发展密切相关,如:胃癌、乳腺癌、口腔鳞癌和头颈部鳞癌等[12-16]。既往研究显示,Cep55参与肿瘤多种生物学功能可能是通过P53[17]、PLK1[17-19]、FoxM1[15-16]和TEX14[20]等信号通路介导的。目前,关于Cep55基因与原发性肝癌的相关性研究尚未见报道。本研究利用siRNA在肝癌细胞HepG2和Hep3B中沉默Cep55基因的表达,结果显示:在两种肝癌细胞内抑制Cep55的表达水平,能够显著抑制肝癌细胞的增殖能力;同时,肝癌细胞G1期细胞的比例明显减低,G2-M期细胞的比例显著升高,出现明显的G2期阻滞,提示Cep55基因沉默可能抑制细胞分裂。
综上所述,本研究初步证实了中心体相关蛋白Cep55在原发性肝癌中可能涉及的生物学功能,抑制其表达能显著降低肝癌细胞的增殖能力,而这可能与其对细胞周期的调控相关。本研究结果为以Cep55为靶点的肝癌临床预测和治疗提供了初步的理论依据,但对Cep55与肝癌发生发展作用的具体机制尚需进一步研究。
[1] JEFFERY J, SINHA D, SRIHARI S, et al. Beyond cytokinesis: the emerging roles of CEP55 in tumorigenesis[J]. Oncogene, 2015, doi: 10.1038/onc.2015.128.
[3] LAFARO KJ, DEMIRJIAN AN, PAWLIK TM. Epidemiology of hepatocellular carcinoma[J]. Surg Oncol Clin N Am, 2015, 24(1):1-17.
[4] CHEN W, ZHENG R, ZHANG S, et al. Report of incidence and mortality in China cancer registries, 2009[J]. Chin J Cancer Res, 2013, 25(1):10-21.
[5] LOPE CR, TREMOSINI S, FORNER A, et al. Management of HCC[J]. J Hepatol, 2012, 56:S75-S87.
[6] EL-SERAG HB, RUDOLPH KL. Hepatocellular carcinoma: epidemiology and molecular carcinogenesis[J]. Gastroenterology, 2007, 132(7):2557-2576.
[7] GALINDO-CUSPINERA V, WINNIG M, BUFE B, et al. A TAS1R receptor-based explanation of sweetwater-taste[J]. Nature, 2006, 441(7091):354-357.
[8] FABBRO M, ZHOU BB, TAKAHASHI M, et al. Cdk1/Erk2 and Plk1 dependent phosphorylation of a centrosome protein, Cep55, is required for its recruitment to midbody and cytokinesis [J]. Dev Cell, 2005, 9(4):477-488.
[9] DOXSEY SJ. Molecular links between centrosome and midbody[J]. Mol Cell, 2005, 20(2):170-172.
[10] VAN DER HORST A, SIMMONS J, KHANNA KK. Cep55 stabilization is required for normal execution of cytokinesis[J]. Cell Cycle, 2009, 8(22):3742-3749.
[11] KUMAR A, RAJENDRAN V, SETHUMADHAVAN R, et al. CEP proteins: the knights of centrosome dynasty[J]. Protoplasma, 2013, 250(5):965-983.
[12] TAO J, ZHI X, TIAN Y, et al. CEP55 contributes to human gastric carcinoma by regulating cell proliferation[J]. Tumour Biol, 2014, 35(5):4389-9439.
[13] MONDAL G, ROWLEY M, GUIDUGLI L, et al. BRCA2 localization to the midbody by filamin A regulates cep55 signaling and completion of cytokinesis[J]. Dev Cell, 2012, 23(1):137-152.
[14] INODA S, HIROHASHI Y, TORIGOE T, et al. Cep55/c10orf3, a tumor antigen derived from a centrosome residing protein in breast carcinoma[J]. J Immunother, 2009, 32(5):474-485.
[15] JANUS JR, LABORDE RR, GREENBERG AJ, et al. Linking expression of FOXM1, CEP55 and HELLS to tumorigenesis in oropharyngeal squamous cell carcinoma[J]. Laryngoscope, 2011, 121(12):2598-2603.
[16] WASEEM A, ALI M, ODELL EW, et al. Downstream targets of FOXM1: CEP55 and HELLS are cancer progression markers of head and neck squamous cell carcinoma[J]. Oral Oncol, 2010, 46(7):536-542.
[17] CHANG YC, WU CH, YEN TC, et al. Centrosomal protein 55 (Cep55) stability is negatively regulated by p53 protein through Polo-like kinase 1 (Plk1) [J]. J Biol Chem, 2012, 287(6):4376-4385.
[18] BASTOS RN, BARR FA. Plk1 negatively regulates Cep55 recruitment to the midbody to ensure orderly abscission[J]. J Cell Biol, 2010, 191(4):751-760.
[19] VAN DER HORST A, KHANNA KK. The peptidyl-prolyl isomerase Pin1 regulates cytokinesis through Cep55[J]. Cancer Res, 2009, 69(16):6651-6659.
[20] IWAMORI T, IWAMORI N, MA L, et al. TEX14 interacts with CEP55 to block cell abscission[J]. Mol Cell Biol, 2010, 30(9):2280-2292.
(编辑 国 荣)
Effect of knockdown of centrosomal protein 55 ku on the proliferation of human hepatocellular carcinoma cells
ZHANG Yong1, MENG Fan-di2, ZHANG Jing-yao2, FU Jun-ke1, LIU Chang2, WU Qi-fei1
(1. Department of Thoracic Surgery; 2. Department of Hepatobiliary Surgery, the First Affiliated Hospital of Xi’an Jiaotong University, Xi’an 710061, China)
Objective To investigate the effects of small interfering RNA (siRNA) knockdown of centrosomal protein 55 ku (Cep55) on the proliferation capacity of human hepatocellular carcinoma cells HepG2 and Hep3Binvitroso as to provide theoretical evidence for gene-targeted therapy for human hepatocellular carcinoma. Methods Cep55 siRNA was transfected into human hepatocellular carcinoma cells HepG2 and Hep3B with Lipofectamine 2000. Real-time PCR and Western blotting were used to detect the expression of Cep55 at mRNA and protein levels. Cell proliferation was evaluated by MTT assay and cell cycle analysis was performed by flow cytometry. Results Cep55 siRNA was successfully transfected into HepG2 and Hep3B cells, resulting in the significant inhibition of Cep55 mRNA and protein expressions (P<0.05). Downregulation of Cep55 significantly decreased the proliferation of HepG2 and Hep3B cells (P<0.05) and induced G2 cell cycle arrest. Conclusion Downregulating the expression of Cep 55 can inhibit the proliferation of hepatocellular carcinoma cells and induce G2 cell cycle arrest, which indicates that Cep 55 may be a potential target for primary hepatocellular carcinoma therapy.
centrosomal protein 55 ku (Cep55); primary hepatocellular carcinoma; cell proliferation; cell cycle; siRNA
2015-02-11
2015-05-18
中国博士后基金资助项目(No.2013M532058);陕西省科技攻关计划资助项目(No.2013K12-08-01) Supported by the China Postdoctoral Foundation (No.2013M532058) and the Key Science and Technology Project of Shaanxi Province (No.2013K12-08-01)
吴齐飞. E-mail: wuqifei-1@163.com
R735.7
A
10.7652/jdyxb201601008
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20151112.1537.002.html(2015-11-12)
