Pseudomonas putida细胞对微囊藻毒素-LR的胁迫响应
2016-04-16邓庭进叶锦韶刘芷辰华南理工大学环境与能源学院工业聚集区污染控制与生态修复教育部重点实验室广东广州50006暨南大学环境学院广东广州506暨南大学化学系广东广州506
邓庭进,尹 华*,叶锦韶,彭 辉,刘芷辰(.华南理工大学环境与能源学院,工业聚集区污染控制与生态修复教育部重点实验室,广东 广州 50006;.暨南大学环境学院,广东 广州 506;.暨南大学化学系,广东 广州 506)
Pseudomonas putida细胞对微囊藻毒素-LR的胁迫响应
邓庭进1,尹 华1*,叶锦韶2,彭 辉3,刘芷辰1(1.华南理工大学环境与能源学院,工业聚集区污染控制与生态修复教育部重点实验室,广东 广州 510006;2.暨南大学环境学院,广东 广州 510632;3.暨南大学化学系,广东 广州 510632)
摘要:将1.0g/L的微囊藻毒素-LR(MC-LR)降解菌恶臭假单胞菌(Pseudomonas putida)置于含不同浓度MC-LR的体系中,研究了体系中菌体细胞完整性和生物量的变化,考察了MC-LR对细胞的氧化胁迫以及抗氧化酶的响应.结果表明,MC-LR能够增大P. putida细胞质膜通透性,造成膜损伤,导致胞内物质外流,使细胞完整性遭到破坏;同时,MC-LR能够引起P. putida细胞的氧化胁迫,随着毒素暴露时间的延长,活性氧自由基(ROS)和膜脂过氧化产物丙二醛(MDA)含量显著升高,具有明显的剂量效应.超氧化物歧化酶(SOD)活性在MC-LR的诱导下有一个先升后降的过程,表现为对低浓度污染物的主动响应,而高浓度(2.5mg/L)MC-LR作用5d后,ROS积累到相当高水平,对细胞代谢功能造成破坏,使SOD活性下降,并加速细胞的死亡,P. putida生物量与对照相比,下降了将近50%.
关键词:微囊藻毒素-LR;恶臭假单胞菌;氧化胁迫;生物量;毒性
* 责任作者, 教授, huayin@scut.edu.cn
微囊藻毒素(MCs)是富营养化污染的次生代谢产物,其结构为环状七肽,具有很强的生物毒性.研究表明,世界上25%~70%的蓝藻水华能够产生藻毒素[1],对环境危害极大.目前,有关MCs的毒性研究大多集中在动物、高等植物上[2-4],而其对微生物的作用机制研究还很有限,大量细菌、真菌、浮游植物等微生物与藻毒素共存于富营养化水体中,两者相互接触,势必存在相互影响[5-6].杨翠云等[7-8]研究发现MCs能够促进溶菌酶对大肠杆菌和枯草芽孢杆菌的细胞膜渗透性,增加细胞内可溶性糖和可溶性蛋白的外渗.尹黎燕等[9]研究显示,MC-LR可对烟草BY-2细胞造成氧化胁迫,并激发细胞内抗氧化系统的响应.另一方面,产毒藻类普遍存在于富营养化水环境中,能够为微生物的附着生长及生物修复提供条件,然而,MCs的产生与蓝藻水华暴发具有同步性,二者呈极显著正相关[10],MCs对微生物的作用是否会影响到水华污染水域的修复作用,是亟待解决的科学问题.
当前,MCs的微生物降解去除是科学研究的热点,而关于MCs对菌体的毒性作用研究较少.袁媛等[11]研究发现,MC-LR能抑制降解菌的生长,导致MC-LR的降解率下降.Ding等[12]利用纯微囊藻毒素作用于菌体中,发现藻毒素能够引起菌体细胞的氧化胁迫,并破坏菌体线粒体和电子传递链.本文选取我国蓝藻水华中常见且毒性最强的MC-LR作为MCs代表物,利用本实验室前期分离、筛选得到的对MC-LR有降解作用的恶臭假单胞菌纯菌株(Pseudomonas putida)为研究对象,分析MC-LR对菌体细胞的毒性胁迫影响,并考察细胞抗氧化系统的响应机制,以期为进一步揭示MCs对菌体的作用机制和生理毒性影响,探明藻毒素对生态环境中藻菌之间的作用影响提供一定的理论依据.
1 材料与方法
1.1 实验试剂与材料
实验菌种:恶臭假单胞菌(Pseudomonas putida),由本课题组从广州市某发生水华的人工湖底泥中筛选驯化得到,该菌对MC-LR有良好的降解效果[13].
MC-LR储备液由实验室制备,其提取和纯化方法参照文献[14].
营养培养基:牛肉膏 3g,蛋白胨 10g,NaCl 5g,蒸馏水 1000mL,pH为7.4~7.6.
无机盐基础培养基(MSM):K2HPO40.02g, NaH2PO40.1g, MgSO4·7H2O 0.05g, NH4NO30.02g, CaCl20.05g,水1000mL.
绝对计数管(TruCOUNT Tubes)购于Becton–Dickinson (SanJose, CA, USA);2',7'-二氯二氢荧光素二乙酯(DCFH-DA)购于Sigma-Aldrich公司.超氧化物歧化酶(SOD)测试试剂盒、丙二醛(MDA)测试试剂盒均购于南京建成生物研究所.
1.2 实验设备
高速冷冻离心机(KDC-160HR,安徽中科中佳科学仪器有限公司);紫外分光光度计(UVmini-1240,日本岛津公司);高效液相色谱(CBM-20A,日本岛津公司);流式细胞仪(FACSDiva,美国BD公司);超声破壁仪(SCIENTZ-ⅡD,宁波新芝科技有限公司).
1.3 P. putida的毒素处理
将活化后的P. putida投加到MC-LR质量浓度分别为0,0.5,2.5mg/L的灭菌无机盐基础培养基中,使体系最终为20mL,菌体质量浓度为1.0g/L,于30℃、130r/min摇床中恒温振荡培养.以不加MC-LR的MSM体系作为空白对照.
1.4 MC-LR对P. putida细胞完整性的影响
分别取毒素处理0,12,24,48,72,96,120h后的样品,测定其在260nm处的吸光度值,以表征细胞完整性的变化.每组设置3个平行,进行2次重复实验.
1.5 MC-LR对P. putida细胞的氧化胁迫
1.5.1 MC-LR作用下P. putida细胞内活性氧自由基(ROS)的测定 分别取毒素处理第0,1,2,3, 4,5d样品,离心收集菌体,用10mg/L溶菌酶处理后,用双蒸水清洗2~3遍,用PBS重悬,加入200µL DCFH-DA染液,混匀,37℃避光孵育20min;加入500µL PBS洗涤,置于1000r/min下离心5min,弃上清液,加入200µL PBS,混匀,用流式细胞仪检测样品中生成的DCF荧光强度[15].
1.5.2 MC-LR作用下P. putida细胞内丙二醛(MDA)的测定 毒素处理后于0,24,48,72,96, 120h进行取样,离心收集菌体,用PBS清洗后重悬,置于0℃冰-水混合水浴中,超声破壁.超声破壁仪功率为:450W,工作3s,间隙3s,破壁150次.取混合悬液利用丙二醛测试试剂盒测定MDA含量.
1.6 MC-LR作用下P. putida超氧化物歧化酶S0D的响应变化
1.6.1 P. putida细胞酶液的制备 将P.putida菌体培养液离心过滤,收集菌体,用0.9%的生理盐水清洗3次.洗涤后的菌体收集于离心管中,加入生理盐水10mL,置于0℃的冰-水混合水浴中,超声破壁.将破碎后混合悬液离心15min (8000r/ min,4℃),上清液即为所需酶液.参照考马斯亮蓝G-250法测定制备酶液中可溶性蛋白含量,用牛血清蛋白(BSA)作为标准蛋白[16].
1.6.2 超氧化物歧化酶(SOD)活性测定 分别取毒素处理后第0,1,2,3,4,5d样品,离心收集菌体,根据1.6.1进行酶液的制备,并利用试剂盒测定SOD酶活性.
1.7 MC-LR对P. putida细胞生物量的影响
取毒素处理后第0,2,4,6d样品,离心收集底部菌体细胞,用PBS洗涤后重悬,稀释2000倍后, 取300µL加入绝对计数管中,涡旋震荡使样品与管中的内参物荧光微球混匀后上机检测.
每根绝对计数管中含有已知数量的内参物——荧光微球,通过流式细胞仪可以直接检测到仪器进样中P. putida细胞的数目和荧光微球的数目,得出数据后,通过公式(1)换算即可直接得出每个样品中P. putida的细菌数目[17]:

1.8 统计分析
试验所获数据利用SPSS 17.0和One-Way ANOVA法进行相关性分析和差异显著性分析.
2 结果与讨论
2.1 MC-LR对P. putida细胞完整性的影响
正常状态下的细胞,细胞质膜是完整闭合的,胞内物质被封闭起来,只通过主动运输或离子交换等方式与外界进行物质交换.当细胞质膜被损坏时,细胞质膜通透性会增大,某些胞内大分子物质会流出,这些胞内物质中如DNA、RNA等在波长260nm的发射光照射下能够被检出,因此,可以把测得的吸光度值变化情况作为间接判断细胞质膜完整性是否受到损坏的依据[18].
由图1可知,在未添加MC-LR的对照体系中,随着培养时间的延长,吸光度值略微上升,这可能是由于培养到后期,部分细胞逐渐衰老,少量细胞出现死亡破裂现象,胞内物质外流,从而导致所测吸光度值升高,反映出P. putida的完整性受到一定程度的破坏.而对于经不同浓度MC-LR处理的实验组,测得的吸光度值增加的现象较对照出现得更早,且随着MC-LR浓度的增加,吸光度值上升幅度更大(P<0.05),这表明MC-LR导致了胞内物质的大量外流,破坏了P. putida细胞的完整性,分析原因,一方面,可能是因为MC-LR能作用于P. putida的细胞质膜,使细胞质膜通透性增大[14],从而使胞内物质更易流出;另一方面,MC-LR可能致使细胞发生极化现象,使细胞遭受损伤,加速细胞的破裂和死亡,最终使得胞内物质大量流出,细胞的完整性遭到破坏.
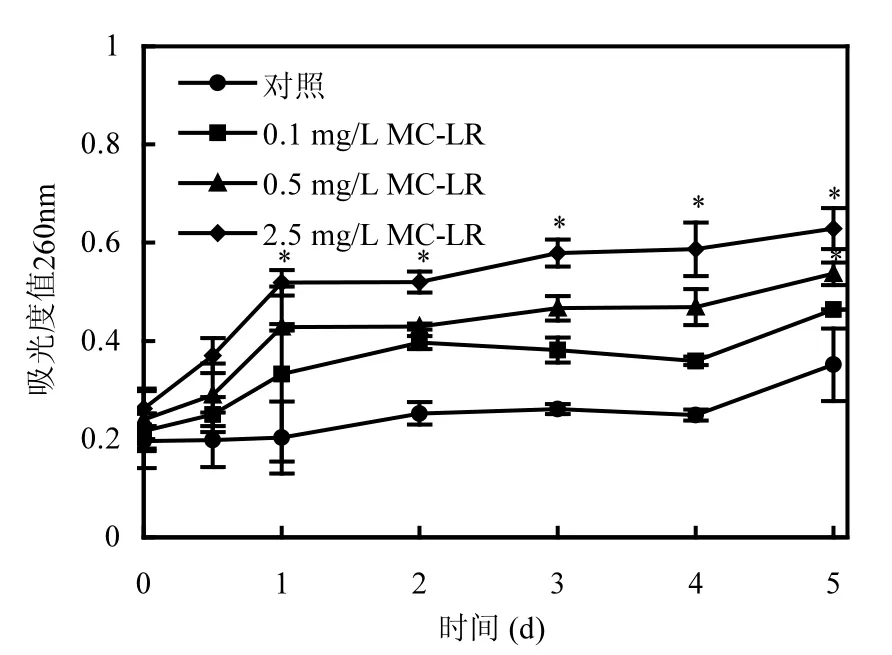
图1 MC-LR对P. putida细胞完整性的影响Fig.1 Effect of MC-LR on the cell integrity of P. putida *表示与对照组有显著性差异(P<0.05),下同
2.2 MC-LR对P. putida细胞的氧化胁迫
活性氧自由基ROS(Reactive Oxygen Species)是一类包括超氧阴离子自由基、羟基自由基、过氧化氢等在内的高反应性分子[19].在正常情况下,ROS为细胞提供正常的生理环境,而细胞内过量和长时间的ROS作用能破坏胞内蛋白,引发脂质过氧化作用,并因此形成脂质过氧化产物[20].丙二醛(MDA)是膜脂过氧化最重要的产物之一,它的产生能加剧膜的损伤,因此,可以通过ROS和MDA的含量了解膜脂过氧化的程度,以间接反映P. putida细胞及膜系统受氧化胁迫的损伤程度[21].
图2和图3分别为培养体系中不同MC-LR浓度下P. putida细胞内ROS和MDA随时间的变化情况.由图中可以看出,MC-LR可引起细胞ROS和MDA含量增多,差异具有显著性(P<0.05),且表现出一定的剂量效应,即MC-LR浓度越高,ROS和MDA增加越明显.
图2中,将P. putida投加至空白对照体系中,由于细胞进入新的培养环境而产生氧化胁迫,而菌体细胞通过自身的调节机制,很快适应了新的环境.因此,表现为ROS含量略微增加,但维持在较低水平.

图2 MC-LR对P. putida细胞活性氧自由基的影响Fig.2 Effect of MC-LR on ROS of P. putida
经MC-LR处理后的实验组细胞从第2d 起,ROS含量急剧上升,显著高于对照组,并在整个培养阶段都维持在较高水平,表明P. putida细胞受到了新的氧化胁迫,而这种胁迫正是由MC-LR所引起的.低浓度的MC-LR(0.5mg/L)毒性处于一个较低水平,对ROS的激发作用较小,对菌体的毒害作用也有限,但会随着暴露时间的增加而出现ROS的累积,最终使ROS含量逐渐上升.当把加入体系中的MC-LR浓度提高到2.5mg/L时,菌体ROS水平经过第1d的自动调整期之后,迅速呈现直线增长.Xiong等[22]发现,高浓度的MC-LR毒害性增大,能导致细胞膜系统变性,进而导致细胞的损伤,迅速破坏细胞内的自我防御机制.因此,高浓度MC-LR使P. putida处于不利环境,激发并积累大量活性氧自由基,毒素暴露5d后,ROS含量超过空白对照将近2倍多,对细胞的氧化胁迫程度大大加深.

图3 MC-LR作用下P. putida细胞丙二醛的变化Fig.3 Effect of MC-LR on MDA content of P. putida
膜脂过氧化是藻毒素诱导氧化损伤的另一个表征[23].由图3可知,对照组的膜脂过氧化程度(以MDA含量表示)在整个实验阶段保持较低水平,这与ROS的形成相似.利用SPSS 17.0统计软件对毒素处理组MDA含量的变化和ROS含量变化情况作相关性分析,得出其相关性为0.959,在0.01水平上显著正相关,说明P. putida细胞膜脂过氧化的程度与ROS的变化也存在一致性,均受到MC-LR剂量效应的影响与时间效应的累积作用.这是因为高浓度的MC-LR具有很强的生物毒性,能通过产生活性氧来诱导氧化应激,使得细胞受到氧化胁迫[24],影响细胞的活性,细胞功能遭到破坏,导致活性氧自由基ROS的升高和积累,并发生膜脂过氧化作用,造成细胞膜电位的去极化损伤和通透性的变化,从而使膜脂过氧化产物MDA的含量增加,这些结果与Ding等[12]的研究是一致的.
2.3 MC-LR对P. putida细胞抗氧化性酶活的影响
超氧化物歧化酶(SOD)是普遍存在于生物中的抗膜脂质过氧化的保护性酶.研究表明,高浓度的污染物能够导致细胞内活性氧自由基的过度积累,并引起氧化胁迫,造成细胞质膜系统脂质和蛋白的过氧化失活,并导致DNA等断裂,最终使细胞发生死亡[19].而SOD能快速将超氧阴离子自由基氧化还原为H2O2和O2,H2O2则进一步经抗氧化酶分解为H2O和O2,从而限制自由基的过量积累,消除活性氧自由基对细胞的伤害.
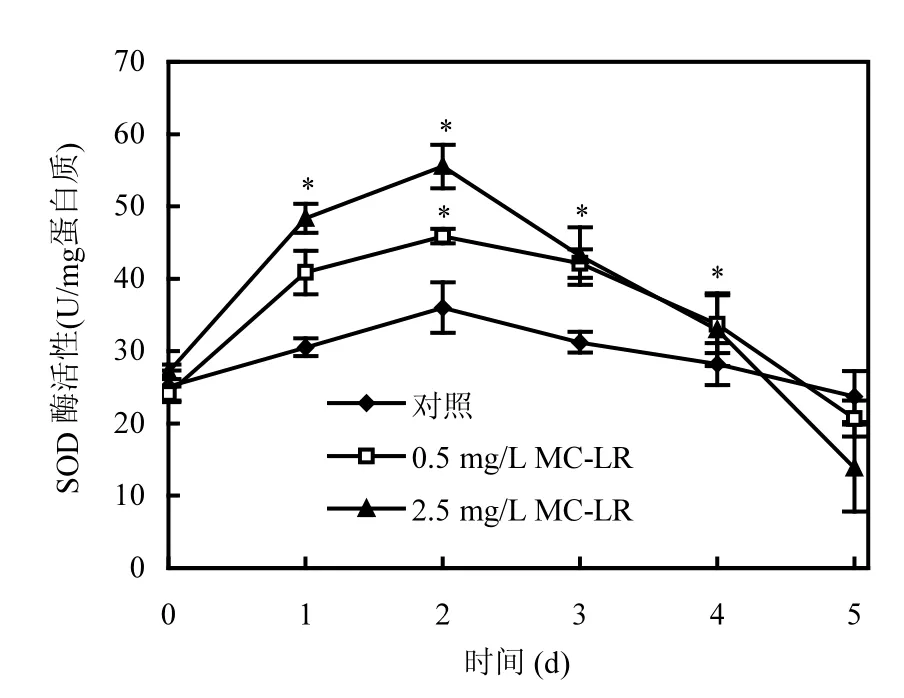
图4 MC-LR对P. putida细胞超氧化物歧化酶的影响Fig.4 Effect of MC-LR on SOD activity of P. putida
如图4所示,在空白对照体系中,SOD酶活性处于比较平稳的状态,在0~2d有略微上升,但波动不大,3d以后略有下降,说明在空白体系中SOD酶没有受到显著诱导或抑制作用,变化不明显.而在添加MC-LR的体系中,P. putida受到氧化胁迫,由2.2可知,细胞内氧自由基浓度上升,诱导抗氧化酶系统做出反应,因此,在0~2d SOD酶活性也会随着上升,以清除胞内自由基,减轻细胞损伤.而随着藻毒素暴露时间的延长,从第2d开始,SOD酶活性出现明显的下降(P<0.05).由于细胞内氧自由基浓度超过一定的范围,抗氧化体系酶活不能及时清除,一方面,SOD与MC-LR相结合,参与了MC-LR的解毒和ROS的清除[25],消耗大量的SOD;另一方面,过量的自由基会导致严重的氧化胁迫,破坏细胞,损伤细胞功能,使得抗氧化体系酶活性降低,SOD供应不足[9],最终导致SOD整体活性下降,且MC-LR浓度越高,下降越明显.
根据本实验结果及结合前人研究,可以得出,菌体抗氧化酶活可能受到诱导而升高,也有可能受到抑制,对于一定浓度范围内的MC-LR作用,P. putida细胞表现出主动响应,而当污染物浓度过高时,表现为对毒素的被动胁迫.
2.4 MC-LR对P. putida细胞生物量的影响
本实验采用流式细胞术(FCM)和绝对计数管(TruCount tube)相结合,对培养体系中的P. putida生物量进行定量检测.该方法是利用特殊荧光信号对悬液中的单细胞或生物粒子进行标记,再通过流式细胞仪对荧光信号进行检测和分析,从而实现高速、逐一的细胞定量分析和分选[26],比传统的细胞计数方法速度更快,精度更高,且更准确无误.

图5 绝对计数流式检测(0d)Fig.5 Flow cytometry diagram of P. putida A.对照; B. 0.5mg/L MC-LR; C. 2.5mg/L MC-LR
图5为流式细胞仪荧光检测结果图,图中荧光信号由两部分构成,其中R1部分为绝对计数管中微球的荧光信号,R2部分为检测样品中P. putida的荧光信号.由于绝对计数管中微球的数量为已知量,因此,通过样品信号和微球信号的对比,即可计算出样品中P. putida的数量,再通过样品的稀释倍数换算,便可得出培养体系中P. putida的准确生物量.
MC-LR对体系中P. putida细胞生物量的影响如图6所示,在培养过程中P. putida细胞的生物量变化情况可以反映出菌体对MC-LR作用的响应.由图可知,体系中P. putida细胞的数目均呈下降趋势.在空白体系中,当P. putida 从营养培养基转移到无机盐培养基中,由于环境的变化及外界营养的突然匮乏,导致菌体短时间内适应较差,从而发生菌体失活或死亡破裂等情况,使得细胞数目略有减少;而随着培养时间延长,越来越多细胞进入衰老期,死亡破裂的细胞逐渐增多,导致体系中P. putida的生物量进一步减少.

图6 MC-LR对体系中 P. putida 细胞数目的影响Fig.6 Effect of MC-LR on biomass of P. putida
而MC-LR的加入,使得上述情况变得更加明显,且加入的MC-LR浓度不同,对P. putida生物量的影响作用也不同,且差异具有显著性(P< 0.05).当向体系中加入0.5mg/L的MC-LR时,与空白对照相比,菌体生物量有略微的下降,这是由于污染物对P. putida细胞具有胁迫作用,加速了细胞的衰亡,使菌体细胞提前进入衰亡期,但是当污染物浓度处于较低水平时,其影响作用也较小;而当加入体系中的MC-LR浓度提高到2.5mg/L 时,污染物的毒性胁迫作用进一步加强,表现出明显的剂量效应.P. putida在高浓度MC-LR的毒害下,活性降低并发生细胞凋亡[12],细胞膜通透性逐渐增大,细胞完整性遭到破坏,且随着暴露时间的延长,污染物作用的时间效应加剧了细菌的死亡和消融,从而使得P. putida生物量迅速减少.
3 结论
3.1 MC-LR作用于P. putida的细胞质膜,使细胞质膜通透性增大,细胞遭受损伤,细胞的完整性遭到破坏.
3.2 MC-LR可引起细胞ROS含量的增多和积累,使P. putida遭受氧化胁迫,继而发生膜脂过氧化作用,使膜脂过氧化产物MDA的含量增加.P. putida细胞膜脂过氧化的程度与ROS的变化也存在一致性,均受到MC-LR剂量效应的影响与时间效应的累积作用.
3.3 对于低浓度(0.5mg/L)的MC-LR作用,P. putida细胞表现出主动响应,细胞抗氧化酶SOD诱导升高;而当污染物浓度过高时(2.5mg/L),其毒性胁迫作用增强,SOD酶活性受到抑制而降低,且导致P. putida生物量的减少.
参考文献:
[1] Chen X F, Chuai X M, Yang L Y. Status quo, historical evolution and causes of eutrophication in lakes in typical lake regions of China [J]. Journal of Ecology and Rural Environment, 2014,30(4): 438-443.
[2] 黄文敏,邢 伟,李敦海,等.微囊藻毒素-RR对烟草细胞活力及营养生理的影响 [J]. 中国环境科学, 2007,27(3):382-386.
[3] 王伟琴,金永堂,吴 斌,等.水源水中微囊藻毒素的遗传毒性与健康风险评价 [J]. 中国环境科学, 2010,30(4):468-476.
[4] Yin L Y, Huang J Q, Huang W M, et al. Microcystin-RR-induced accumulation of reactive oxygen species and alteration of antioxidant systems in tobacco BY-2cells [J]. Toxicon, 2005, 46(5):507-512.
[5] 徐慧敏,闫 海,马 松,等.鞘氨醇单胞菌USTB-05对微囊藻毒素的生物降解 [J]. 中国环境科学, 2014,34(5):1316-1321.
[6] 张 睿,王广军,李志斐,等.枯草芽孢杆菌对铜绿微囊藻抑制效果的研究 [J]. 中国环境科学, 2015,35(6):1814-1821.
[7] 杨翠云,李敦海,刘永定.微囊藻毒素对典型微生物生长及生理生化特性的影响 [J]. 水生生物学报, 2008,32(6):818-823.
[8] 杨翠云,夏传海,周世伟.微囊藻毒素-RR对大肠杆菌和枯草杆菌的渗透效应 [J]. 科学通报, 2010,55(11):1002-1006.
[9] 尹黎燕,黄家权,沈 强,等.烟草悬浮细胞抗氧化系统对微囊藻毒素-RR的响应 [J]. 中国环境科学, 2005,25(5):576-580.
[10] 鲍忠祥.滇池浮游植物和微囊藻毒素的时空分布及细菌去除毒素研究 [D]. 昆明,云南大学, 2012.
[11] 袁 媛,吴 涓,李玉成,等.活性炭纤维固定化菌对微囊藻毒素MC-LR的去除研究 [J]. 中国环境科学, 2014,34(2):403-409.
[12] Ding W X, Shen H M, Ong C N. Calpain activation after mitochondrial permeability transition in microcystin-induced cell death in rat hepatocytes [J]. Biochemical and Biophysical Research Communications, 2002,291(2):321-331.
[13] 肖巧巧,尹 华,叶锦韶,等.一株微囊藻毒素-LR降解菌的降解特性 [J]. 环境化学, 2014,33(9):1-7.
[14] 邓庭进,叶锦韶,彭 辉,等.微囊藻毒素-LR对恶臭假单胞菌细胞活性和表面特性的影响 [J]. 环境科学, 2015,36(1):252-258.
[15] He Y Y, Häder D P. UV-B-induced formation of reactive oxygen species and oxidative damage of the cyanobacterium Anabaena sp.: protective effects of ascorbic acid and N-acetyl-L-cysteine [J]. Journal of Photochemistry and Photobiology B: Biology, 2002,66(2):115-124.
[16] Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding [J]. Analytical Biochemistry, 1976,72(1): 248-254.
[17] Khan M M T, Pyle B H, Camper A K. Specific and rapid enumeration of viable but nonculturable and viable-culturable gram-negative bacteria by using flow cytometry [J]. Applied and environmental microbiology, 2010,76(15):5088-5096.
[18] Rurián-Henares J A, Morales F J. Antimicrobial activity of melanoidins against Escherichia coli is mediated by a membranedamage mechanism [J]. Journal of Agricultural and Food Chemistry, 2008,56(7):2357-2362.
[19] Schalk I J, Hannauer M, Braud A. New roles for bacterial siderophores in metal transport and tolerance [J]. Environmental Microbiology, 2011,13(11):2844-2854.
[20] 王 燕,陈永刚,葛郑增,等.TBT对大鼠肝脏ROS、抗氧化酶和解毒系统酶的影响 [J]. 中国环境科学, 2005,25(4):428-431.
[21] Codreanu S G, Liebler D C. Novel approaches to identify protein adducts produced by lipid peroxidation [J]. Free Radical Research, 2015(0):1-7.
[22] Xiong Q, Xie P, Li H, et al. Acute effects of microcystins exposure on the transcription of antioxidant enzyme genes in three organs (liver, kidney, and testis) of male Wistar rats [J]. Journal of Biochemical and Molecular Toxicology, 2010,24(6): 361-367.
[23] Žegura B, Štraser A, Filipič M. Genotoxicity and potential carcinogenicity of cyanobacterial toxins–a review [J]. Mutation Research/Reviews in Mutation Research, 2011,727(1):16-41.
[24] Pinho G L L, da Rosa C M, Maciel F E, et al. Antioxidant responses and oxidative stress after microcystin exposure in the hepatopancreas of an estuarine crab species [J]. Ecotoxicology and Environmental Safety, 2005,61(3):353-360.
[25] Pflugmacher S, Wiegand C, Beattie K A, et al. Uptake, effects, and metabolism of cyanobacterial toxins in the emergent reed plant Phragmites australis (cav.) trin. ex steud [J]. Environmental Toxicology and Chemistry, 2001,20(4):846-852.
[26] Wang Y, Hammes F, De Roy K, et al. Past, present and future applications of flow cytometry in aquatic microbiology [J]. Trends in biotechnology, 2010,28(8):416-424.
Response of Pseudomonas putida cells to MC-LR stress.
DENG Ting-jin1, YIN Hua1*, YE Jin-shao2, PENG Hui3, LIU Zhi-chen1(1.Key Laboratory on Pollution Control and Ecosystem Restoration in Industry Clusters, Ministry of Education College of Environment and Energy, South China University of Technology, Guangzhou 510006, China;2.College of Environment, Jinan University, Guangzhou 510632, China;3.Department of Chemistry, Jinan University, Guangzhou 510632, China). China Environment Science, 2016,36(2):603~609
Abstract:The cell integrity and biomass changes of Pseudomonas putida, a MC-LR degrading bacterium, were studied by inoculating 1.0g/L bacterium into systems with different concentrations of MC-LR. The oxidative stress of MC-LR on bacterial cell and the responses of antioxidase were also investigated. The results showed that membrane permeability of P. putida increased under the influence of MC-LR, causing membrane damage, which resulted in the outflow of intracellular substances and the destruction of cell integrity. Also, MC-LR could induce the oxidative stress on the cells of P. putida. With prolonged exposure to MC-LR, reactive oxygen species (ROS) and malondialdehyde (MDA), a product of membrane lipid peroxidation, evidently accumulated in the system, and had obvious dose-effect relationship. Under the effect of MC-LR, the activity of superoxide dismutase (SOD) increased first and then declined, exhibiting an active response to MC-LR of low level. However, after contacting higher concentrations (2.5mg/L) of MC-LR for 5d, ROS accumulation was so high as to cause damage to the metabolism of cells. As a result, SOD activity was suppressed and cells suffered mass mortality, and the biomass decreased by 50% compared with the control.
Key words:microcystin-LR;Pseudomonas putida;oxidative stress;biomass;toxicity
作者简介:邓庭进(1989-),男,湖南郴州人,华南理工大学硕士研究生,主要研究方向为水污染的微生物修复.
基金项目:国家自然科学基金委-广东省联合基金重点项目(U0933002);广东省自然科学基金重点项目(S2013020012808)
收稿日期:2015-07-02
中图分类号:X172
文献标识码:A
文章编号:1000-6923(2016)02-0603-07
