滇池浮游植物群落特征及与环境因子的典范对应分析
2016-04-16杨树平房晟忠余富朝冯文波刘丽萍昆明市环境监测中心云南昆明6508昆明理工大学生命科学与技术学院云南昆明650500
王 华,杨树平,房晟忠,余富朝,冯文波,刘丽萍(.昆明市环境监测中心,云南 昆明 6508;.昆明理工大学生命科学与技术学院,云南 昆明 650500)
滇池浮游植物群落特征及与环境因子的典范对应分析
王 华1*,杨树平1,房晟忠1,余富朝2,冯文波1,刘丽萍1(1.昆明市环境监测中心,云南 昆明 650228;2.昆明理工大学生命科学与技术学院,云南 昆明 650500)
摘要:2013年3、5、7和11月对滇池浮游植物群落进行监测,共检出浮游植物6门31属,主要由绿藻门、蓝藻门、硅藻门组成.浮游植物平均丰度值7482×104cells/L,3月绿藻门占优势,优势种为栅藻;5、7、11月均以蓝藻门占优势,优势种均为微囊藻.对31属浮游植物与10个环境因子的关系进行典范对应分析(Canonical Correspondence Analysis,CCA),结果表明:电导率、DO、TN、TP、CODMn是影响滇池浮游植物分布的主要环境因子.蓝藻能适应较高氮磷营养盐,还受到电导率、CODMn、DO、pH值影响;绿藻能适应高的水温、pH值和CODMn,同时受到氮磷营养盐、DO、电导率的影响;硅藻能适应高的pH值、CODMn,还受到氮磷营养盐、水温、DO、电导率的影响.
关键词:滇池;浮游植物;群落结构;环境因子;典范对应分析
* 责任作者, 工程师, wyhtonghai@sina.com
浮游植物是水域生态系统中主要的初级生产力,对系统内能量流动、物质循环和信息传递起着至关重要的作用[1-2],其生物量和群落结构能很好反应湖泊现状[3-5],浮游植物种类组成和演替规律受到相关物理、化学和生物、气候等环境因子的影响,不同类型的水体,起主导作用的环境因子在不同时期的作用不同[6-8].目前,浮游植物群落结构、多样性、生态分布及其与环境影响因子的关系是国内外研究的热点[9-12],滇池中浮游植物与环境因子的关系研究甚少[13].
典范对应分析(Canonical Correspondence Analysis, CCA)能在由环境因子特征变量构成的空间上,对环境变量和浮游植物等排序作图,在同一排序图上反映群落、生物种类与环境三者或两者间的关系,是分析生物群落与环境因子间复杂关系的有效工具[14].在由主轴1和主轴2构成的平面图中,箭头表征环境因子在平面上的相对位置,所处象限表征环境因子与排序轴的相关性正负,向量长短代表其与主轴的作用.近年来,利用CCA分析浮游生物群落与环境因子的关系得到广泛的应用[15-18].本文在采样调查的基础上,运用CCA来探讨滇池浮游植物分布与环境因子之间的关系,揭示了滇池浮游植物的群落结构、生态规律及影响群落分布的主要环境变量,为滇池浮游植物群落演替规律的研究、富营养化的科学治理提供理论基础和参考,并为后续研究奠定基础.

图1 滇池浮游植物采样点Fig.1 Sampling sites of phytoplankton in Dianchi Lake
1 材料与方法
1.1 区域概况
滇池是我国西南地区最大的高原淡水湖泊,为典型的富营养化湖泊,属长江流域金沙江水系.湖体略呈弓形,弓背向东,为南北向分布,地理坐标为102o37′~ 102o48′E,24o40′~25o02′N,南北长约41km,东西最宽处13.3km,海拔1887.5m,平均水深5.12m,水面面积306km2,库容为12.9×108m3.随着滇池流域内经济发展和城市化进程的加快,人口数量急剧增长,滇池污染物产生量迅速增加,滇池的污染日益加剧.
1.2 采样点位设置
依据地表水湖泊监测布设原则[19],选取滇池10个点位:断桥(1)、草海中心(2)、灰湾中(3)、罗家营(4)、观音山东(5)、观音山中(6)、观音山西(7)、白鱼口(8)、海口西(9)、滇池南(10)进行监测.滇池在3~11月为蓝藻爆发时间,为了突出反应浮游植物群落特征及环境因子相关性,在2013 年3月、5月、7月、11月各采样监测1次,通过GPS定位,4次采样位置保持一致.
1.3 浮游植物采集和鉴定
在水体表层0.5m处采集1L水样,并加入固定剂鲁哥试剂,静置24h以上浓缩至30mL.计数时取0.1mL放入浮游植物计数框内进行镜检,对浮游植物进行分类鉴别[20-21],并计算浮游植物细胞个数[22-23].
1.4 环境因子测定
环境因子采样与浮游植物同步进行,样品采集后冷冻保存,水温(WT)现场用水温计测定,pH值采用玻璃电极法测定,溶解氧(DO)采用碘量法测定,高锰酸盐指数(CODMn)采用酸性高锰酸钾法测定,总磷(TP)采用钼锑抗分光光度法测定,氨氮(NH4+-N)采用纳氏试剂分光光度法测定,总氮(TN)采用碱性过硫酸钾氧化-紫外分光光度法测定,叶绿素a(Chla)采用分光光度法测定[24].
1.5 数据分析方法
采用SPSS17.0对环境因子进行Pearson相关性分析,采用Canoco 4.5分析软件和Canodraw 4.5作图软件对浮游植物群落与环境因子进行典范对应分析.
2 结果与分析
2.1 滇池浮游植物群落特征
2.1.1 浮游植物群落结构 通过调查鉴定,滇池湖泊共检出浮游植物6门31属(其中3月5门27属,5月5门20属,7月5门18属, 11月5门17属).浮游植物主要为绿藻门、蓝藻门、硅藻门的藻类.绿藻门有17属,占全部属种的54.8%;蓝藻门有7属,占全部属种的22.6%;硅藻门有4属,占全部属种的12.9%;黄藻门、隐藻门、甲藻门各有1属.浮游植物名录见表1.

表1 滇池浮游植物调查名录Table 1 Investigation list of phytoplankton in lake of Dianchi

图2 滇池浮游植物的平均丰度组成Fig.2 Composition of the average phytoplankton abundance in Dianchi Lake
2.1.2 浮游植物生物量 滇池浮游植物丰度为687×104~62300×104cells/L,藻类丰度年平均7482×104cells/L.表2可知,3月藻类丰度平均值最小为1164×104cells/L,11月藻类丰度平均值最大为14054×104cells/L.由图2可知,3月绿藻门丰度值最高,占54.2%,其次为蓝藻门占27.6%,黄藻门占9.1%,硅藻门占4.4%,优势种为栅藻.5、7、11月蓝藻门丰度值均最高,分别占67.9%、84.5%、86.6%,优势种均为微囊藻.

表2 浮游植物丰度值(×104cells/L)Table 2 Values of the phytoplankton abundance in Dianchi Lake (×104cells/L)
2.2 环境因子及其相关性分析
滇池环境因子监测值为采样点位平均值,见表3,由表3可知:滇池水体偏碱性,水温相差较小为15.0~22.9℃,DO、CODMn、透明度、电导率总体变化不大;3月pH值、水温、DO、Chl a较其他月最低,分别为8.40、15.0℃、5.01mg/L、0.0326mg/L;5月Chl a最高为0.0914mg/L;7月水温、pH值、NH4+-N、TP较其他月最高,分别为22.9℃、9.28、0.625mg/L、0.217mg/L.

表4 滇池10个环境因子与Chl a相关系数Table 4 Correlation coefficients between the environmental factors and Chla in Dianchi Lake
富营养化湖泊中Chl a的现存量在一定程度上反映浮游植物的生长状况[25].将滇池水体10个环境因子进行Pearson相关性分析,Chl a与环境因子的相关系数见表4,由表4可知,相同环境因子在不同时段与Chl a相关性存在差异,其中3月与水温、DO、透明度、电导率呈显著正相关;5月与水温、DO、CODMn呈显著正相关,与TP、电导率呈显著负相关;7月与水温、pH值、DO呈显著正相关,与氨氮、TN、TP、电导率呈显著负相关;11月与DO、氨氮、TP、TN、电导率均为显著性正相关.
2.3 浮游植物群落与环境因子的CCA
2.3.1 3月浮游植物群落与环境因子的CCA 表5为环境因子与CCA排序轴的相关系数,由表5和图3可知Chl a与第一排序轴为较显著相关,相关系数为0.4544,与第二排序轴相关性较低,相关系数为0.1858,主要因为Chl a能在一定程度上反应浮游植物的生长状况[25].透明度和电导率与第一排序轴呈最大显著正相关,相关系数分别为0.8012、0.8172,与第二排序轴也有较显著相关性,其相关系数分别为0.5631、0.3619;其次DO与第一、第二排序轴呈较显著相关,相关系数为0.4142,0.3822;CODMn与第一排序轴呈较显著负相关,相关系数为-0.4476;TP、TN与第二排序轴为正相关,相关系数分别为0.3442、0.3202.从第一、第二排序轴的相关性分析可知,3月滇池电导率和透明度对浮游植物分布有较大影响, DO、CODMn、TP、TN对其也有一定影响.
图3为3月环境因子与浮游植物物种的排序图(物种序号见表1),图3可知,蓝藻门、绿藻门、硅藻门均在CAA第1、第2排序轴上得到了较好的分化.蓝藻门主要集中在第1、第2象限,绿藻门主要集中在第2象限,第1象限与水温、电导率、透明度、DO、TP表现出正相关,与pH值、CODMn呈负相关,第2象限与NH4+-N、TN呈正相关,说明3月蓝藻能适应较高的氮磷营养盐,还受到电导率、透明度、DO、CODMn影响;绿藻主要受到氮营养盐影响,能适应较高的氮营养盐.硅藻门主要集中在第3象限,第3象限与pH值、CODMn呈正相关,与水温、电导率、透明度、DO、TP表现出负相关,说明水温、电导率、透明度、DO、TP对硅藻均有影响,同时能较好适应高pH值、CODMn.大部分物种位于两排序轴中心位置,表明大部分物种对3月环境适应性较强.
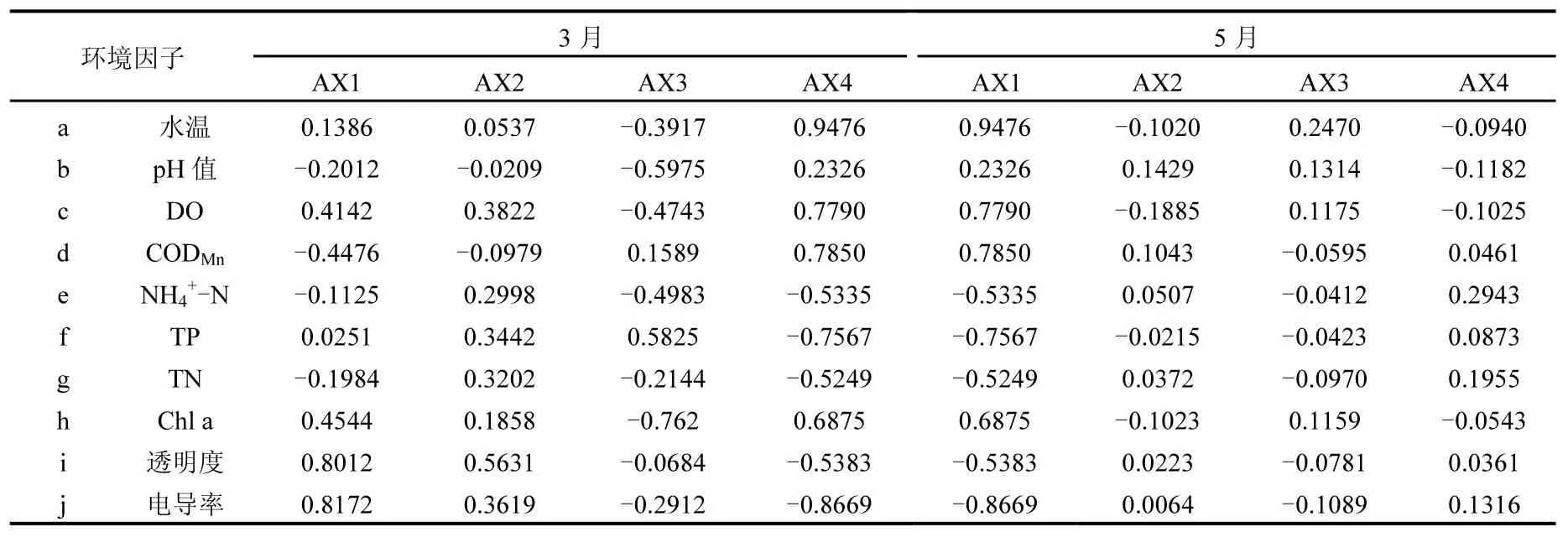
表5 3月和5月环境因子与CCA排序轴的相关关系Table 5 Correlation coefficients between environmental factors and CCA ordination axes in March and May

图3 3月浮游植物物种与环境因子的CCA排序Fig.3 CCA ordination biplot between phytoplankton species and environmental factors in March
2.3.2 5月浮游植物群落与环境因子的CCA由表5和图4可知,5月Chl a与第一排序轴为较显著正相关,相关系数为0.6875,与第二排序轴相关性极低,相关系数为-0.1023,原因同3月.水温与第一排序轴呈最大显著相关,相关系数为0.9476,与第二排序轴相关性较小,相关系数为-0.1020;其次CODMn、DO与第一排序轴呈极显著正相关,相关系数分别为0.7850、0.7790,与第二排序轴相关性较小,相关系数分别为0.1043、-0.1885;电导率、TP与第一排序轴为极显著负相关,相关系数分别为-0.8669、-0.7567,与第二排序轴无相关性;NH4+-N、TN、透明度与第一排序轴为显著负相关,相关系数分别为-0.5335、-0.5249、-0.5383,与第二排序轴无相关性.从第一、第二排序轴的相关性分析可以看出,5月滇池水温、DO、CODMn、电导率、TP对浮游植物分布有较大影响,TN、NH4+-N、透明度对其也有一定影响.
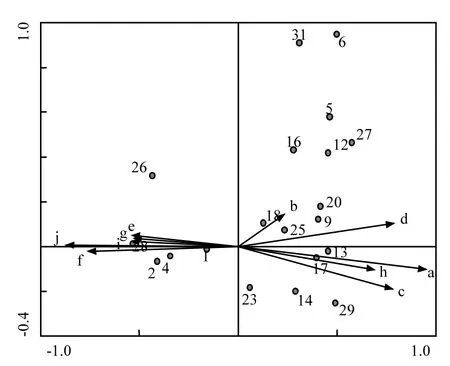
图4 5月浮游植物物种与环境因子的CCA排序Fig.4 CCA ordination biplot between phytoplankton species and environmental factors in May
图4为5月环境因子与浮游植物物种的排序图(物种序号见表1),图4可知,蓝藻门、绿藻门、硅藻门均在CAA第1、第2排序轴上得到了较好的分化.蓝藻门主要集中在第1、第3象限,绿藻门主要集中在第1、第4象限,硅藻门主要集中在第1、第2象限.第1象限与pH值、CODMn呈正相关,与TP呈负相关;第2象限与电导率、NH4+-N、TN、透明度呈正相关,与水温、DO表现为负相关;第3象限与TP表现出正相关,与pH值、CODMn为负相关;第4象限与NH4+-N、TN、透明度、电导率呈负相关,与水温、DO为正相关.说明5月蓝藻主要受到CODMn、TP和pH值浓度影响;绿藻主要受到氮磷营养盐、电导率影响,能适应较高的水温、DO、pH值和CODMn;硅藻门能适应较高氮营养盐、电导率、pH值和CODMn浓度,水温、DO、TP对其物种也有影响.
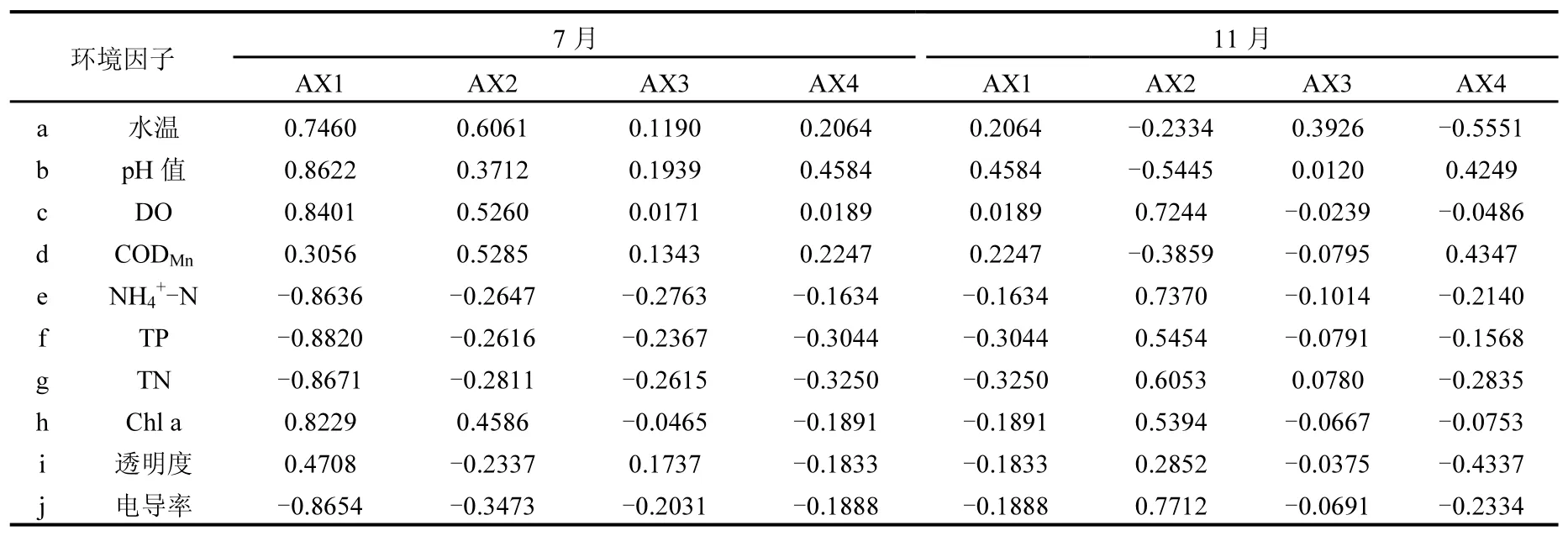
表6 7月和11月环境因子与CCA排序轴的相关关系Table 6 Correlation coefficients between environmental factors and CCA ordination axes in July and November
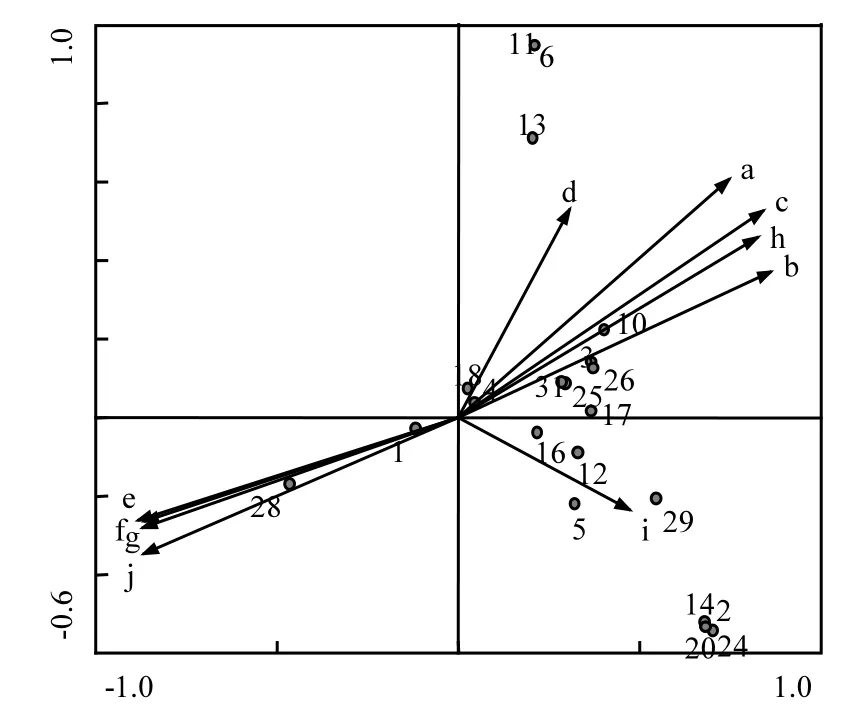
图5 7月浮游植物物种与环境因子的CCA排序Fig.5 CCA ordination biplot between phytoplankton species and environmental factors in July
2.3.3 7月浮游植物群落与环境因子的CCA 7月环境因子与CCA排序轴的相关系数见表6,由表6和图5可知Chl a与第一排序轴为极显著正相关,相关系数为0.8229,与第二排序轴也呈较显著正相关,相关系数为0.4586,原因同3月.pH值、DO、水温与第一排序轴呈最大显著正相关,相关系数分别为0.8622、0.8401、0.7460,与第二排序轴也有较显著正相关性,其相关系数分别为0.3712、0.5260、0.6061;其次CODMn与第一、二排序轴均呈较显著正相关,相关系数分别为0.3056、0.5285;NH4+-N、TP、TN、电导率与第一排序轴为最大的显著负相关,相关系数分别为-0.8636、-0.8820、-0.8671、-0.8654,与第二排序轴也有一定负相关性,相关系数分别为-0.2647、-0.2616、-0.2811、-0.3473.从第一、第二排序轴的相关性分析可知,7月滇池水温、pH值、DO、NH4+-N、TP、TN、电导率对浮游植物分布有较大影响,CODMn对其也存在一定影响.
图5为7月环境因子与浮游植物物种的排序图(物种序号见表1),图5可知,蓝藻门、绿藻门、硅藻门均在CAA第1、第2排序轴上得到了较好的分化.蓝藻门、绿藻门主要集中在第1、第4象限,硅藻门主要集中在第1象限.第1象限与水温、DO、pH值、CODMn呈正相关,与NH4+-N、TP、TN、电导率为负相关,第3象限与NH4+-N、TP、TN、电导率为正相关,与CODMn、水温、DO、pH值呈负相关,第4象限与透明度为正相关.说明7月蓝藻、绿藻、硅藻都能适应较高的水温、DO、pH值和CODMn,同时受到氮磷营养盐、电导率影响.
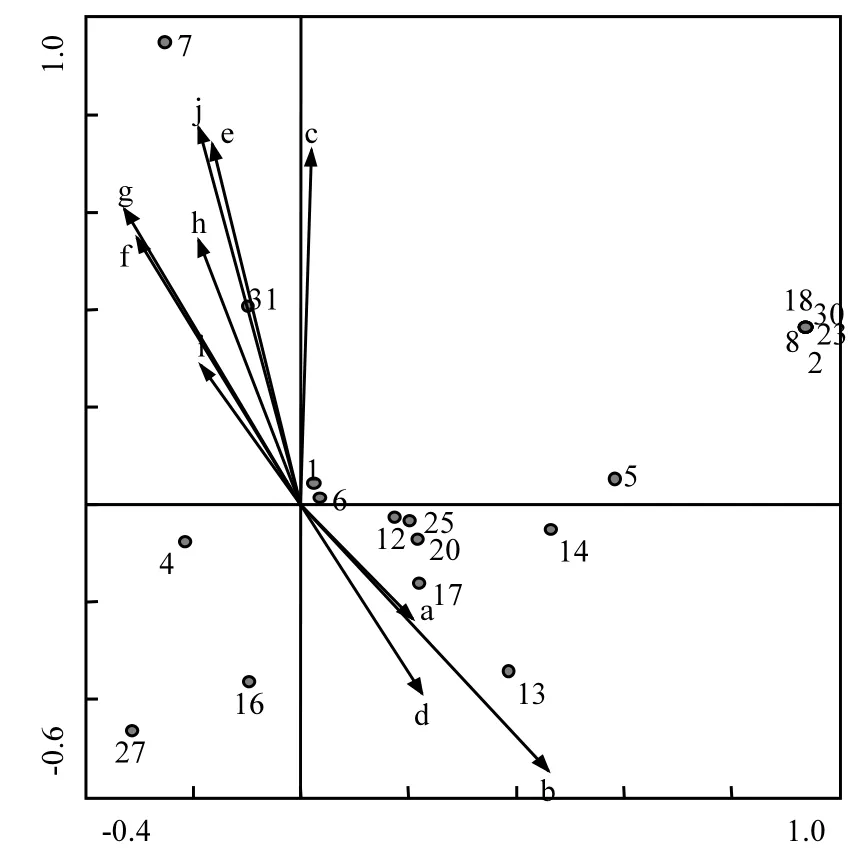
图6 11月浮游植物物种与环境因子的CCA排序Fig.6 CCA ordination biplot between phytoplankton species and environmental factors in November
2.3.4 11月浮游植物群落与环境因子的CCA 11月环境因子与CCA排序轴的相关系数见表6,由表6和图6可知Chl a与第一排序轴相关性极小,相关系数为-0.1891,Chl a与第二排序轴呈较显著正相关性,相关系数为0.5394,原因同3月.电导率、NH4+-N、DO与第二排序轴呈最大显著正相关,相关系数分别为0.7712、0.7370、0.7244,与第一排序轴无相关性;其次TN、TP与第二排序轴呈较显著正相关,相关系数为0.6053、0.5454,与一第排序轴呈负相关,相关系数分别为-0.3250、-0.3044;pH值、CODMn与第二排序轴为负相关,相关系数分别为-0.5445、-0.3859,与第一排序轴呈弱正相关性,相关系数分别为0.4584、0.2247.从第一、第二排序轴的相关性分析可知,11月pH值、电导率、NH4+-N、DO、TP、TN对滇池浮游植物分布均有较大影响,CODMn对其分布也存在一定影响.
图6为11月环境因子与浮游植物物种的排序图(物种序号见表1),图6可知,蓝藻门主要集中在第1象限,绿藻门、硅藻门主要集中在第4象限.第1象限与DO表现出正相关,第4象限与水温、pH值、CODMn为正相关,与NH4+-N、TP、TN、电导率、透明度表现出负相关.说明11月蓝藻能适应较高的DO;绿藻、硅藻都能适应较高的水温、pH值、CODMn,同时氮磷营养盐、电导率、透明度对其物种均有一定影响.
2.4 影响滇池浮游植物的主要环境因子分析
滇池浮游植物主要由绿藻门、蓝藻门、硅藻门的藻类组成,种属数为绿藻门>蓝藻门>硅藻门,种类组成相对稳定.滇池湖泊浮游植物丰度分布在不同月份存在一定差异:3月绿藻>蓝藻>黄藻>硅藻,5月蓝藻>绿藻>黄藻>硅藻,7月蓝藻>绿藻>硅藻>黄藻,11月蓝藻>绿藻>硅藻.这种差异性说明滇池湖泊环境因子在时间和空间上对浮游植物群落的影响都存在一定变化.滇池处于高海拔低纬度地带、属于亚热带季风气候,受西南季风、暖湿气流影响,热带大气气团交替控制[26],全年湖体温差变化较小,浮游植物种群相对稳定.
浮游植物群落与环境因子相互作用,不同时期和不同浓度的环境因子对浮游植物的生长繁殖具有促进或抑制作用[27],浮游植物的生长状况亦可反映环境的优劣.3月Chl a与水温、DO、透明度、电导率呈显著正相关,此时水温、DO最低,浮游植物生长、繁殖较慢,细胞丰度最低,叶绿素含量也最低.5月Chl a与水温、DO、CODMn呈正相关,与TP、电导率为负相关,此时温度、DO、CODMn升高,而TP、电导率下降,促进了浮游植物生长繁殖,藻生物的体积与数量显著增长,镜检观察5月藻体颗粒和体积较大,每个藻体中Chl a含量较高,Chl a较其它月为最高.7月Chl a与水温、pH值、DO显著正相关,而与电导率、DO及营养盐(NH4+-N、TN、TP)呈显著负相关,此时水温最高虽可促进藻体生长,但是电导率、DO及氮磷营养盐对藻体的生长繁殖却为抑制作用,藻体大小和数量无显著增长,一些藻体因生命周期而死亡,使Chl a浓度偏低.11月Chl a与水温无显著相关性,与电导率、DO及营养盐NH4+-N、TN、TP呈显著正相关,此时电导率、DO及氮磷营养盐对浮游植物生长繁殖具有促进作用,促使藻体大量繁殖,较其他月份生物细胞丰度达到最大,镜检观察11月藻体颗粒较细、体积较小,每个藻体含Chl a均较少,因此藻生物量较高而Chl a却较低.
浮游植物的群落结构及其动态演替规律是多个环境因子在不同时间和空间序列上作用的结果[3],不同湖泊具有不同的影响因子,相同湖泊不同时间有不同影响因子.Rosamarina湖泊中浮游植物主要受到NO2--N、NO3--N、混合水深及可溶性硅的影响,Arancio湖泊中水温、电导率、湖泊容量对浮游植物影响最大[28];Barton湖影响浮游植物群落的主要环境因子为氮磷营养盐、硅、浮游动物[29];Lomond湖泊中水温、DO、透明度和CODMn对浮游植物有重要影响[30].滇池浮游植物的CCA排序表明,电导率、DO、TN、TP、CODMn对浮游植物的分布都存在重大影响,其中3月还受到透明度影响,5月还受到NH4+-N、水温、透明度影响,7月还受到水温、pH值、NH4+-N影响,11月还受到NH4+-N、pH值影响.
滇池浮游植物在不同时间段,绿藻门、蓝藻门、硅藻门丰度变化的影响因子不同.3月大部分藻体对环境具有较强的适应能力,蓝藻主要受到氮磷营养盐、电导率、透明度、DO、CODMn影响,绿藻主要受到氮营养盐影响,硅藻主要受到电导率、透明度、DO、CODMn的影响,此时TN值最大,对绿藻门生长有利,绿藻门丰度值最高.5月蓝藻主要受到CODMn、TP、pH值影响,绿藻受到水温、DO、电导率、CODMn和氮磷营养盐影响,硅藻受到氮磷营养盐、水温、DO、电导率、CODMn的影响,此时Chl a与CODMn正相关,与TP负相关,CODMn最高而TP最低,更好的促进了蓝藻的生长繁殖,从而使蓝藻门丰度值最高.7月蓝藻、硅藻、绿藻主要受到水温、pH值、DO、CODMn、氮磷营养盐、电导率影响,蓝藻门的生长繁殖占优势.11月蓝藻主要受DO影响,绿藻、硅藻主要受到pH值、水温、CODMn、氮磷营养盐、电导率的影响,此时DO值最大与Chl a正相关,促进了蓝藻的生长繁殖,因而蓝藻门丰度值最大.
3 结论
3.1 滇池湖泊共检出浮游植物6门31属,主要由绿藻门、蓝藻门、硅藻门组成,从种属分析,绿藻>蓝藻>硅藻.浮游植物丰度11月>7月>5月>3月,其平均丰度值分别为14054×104cells/L、7608× 104cells/L、7303×104cells/L、1164×104cells/L;3月绿藻门占总丰度54.2%,蓝藻门、硅藻门次之,优势种为栅藻,5、7、11月份均以蓝藻门为优势,分别占总丰度67.9%、84.5%、86.6%,优势种均为微囊藻.
3.2 影响滇池浮游植物分布的主要环境因子为电导率、DO、TN、TP、CODMn,其次3月透明度也为主要环境影响因子,5月NH4+-N、水温、透明度也为主要环境影响因子,7月水温、pH值、NH4+-N也为主要环境影响因子,11月pH值、NH4+-N也为主要环境影响因子.滇池蓝藻能适应较高的氮磷营养盐,同时受到电导率、CODMn、DO、pH值影响;绿藻能适应高的水温、CODMn和pH值,同时受到氮磷营养盐、DO、电导率的影响;硅藻能适应高的pH值、CODMn,还受到氮磷营养盐、水温、DO、电导率的影响.
参考文献:
[1] Horne A J, Goldman C R. Limnology [M]. 2ed. New York: McGraw-Hill Companies, 1994:226-264.
[2] Xing Y S, Liang M H, Jian L Z, et al. Variation of phytoplankton biomass and primary production in Daya Bay during spring and summer [J]. Marine Pollution Bulletin, 2004,49:1036–1044.
[3] Salmaso N, Morabito G, Buzzi F, et al. Phytoplankton as indicator of the water quality of the deep lakes south of the Alps [J]. Hydrobiologia, 2006,563:167-187.
[4] Crossetti L O, Bicudo C E D. Phytoplankton as a monitoring tool in a tropical urban shallow reservoir (Garcas pond): the assemblage index application [J]. Hydrobiologia, 2008,610:161-173.
[5] Marchetto A, Padedda B M, Marinani M, et al. A numerical index for evaluating phytoplankton response to changes in nutrient levels in deep mediterranean reservoirs [J]. Limnol., 2009,68(1): 106-121.
[6] Cardinale B J, Palmer M A, Collins S L. Species diversityenhances ecosystem functioning through inter specific facilitation [J]. Nature, 2002,415:426–429.
[7] 陈 姝,郭照冰,方 华,等.CO2浓度升高对湖泊浮游藻类与浮游细菌耦合关系的影响 [J]. 中国环境科学, 2015,35(7):2209-2216.
[8] 李延伟,胡莹莹,陈淑梅.夏、秋季北黄海营养盐的时空分布特征及其影响机 [J]. 中国环境科学, 2013,33(6):1060-1067.
[9] Cermeno P, Teixeira I G, Branco M, et al. Samplingthe limits of species richness in marine phytoplankton communities [J]. Plankton Research, 2014,36:1135–1139.
[10] 宋 伦,宋广军,王年斌,等.辽东湾网采浮游植物粒级结构的胁迫响应 [J]. 中国环境科学, 2015,35(9):2764-2771.
[11] 汪 星,刘录三,李 黎,等.镜泊湖浮游藻类组成及其与环境因子的相关分析 [J]. 中国环境科学, 2015,35(11):3403-3413.
[12] 谭 啸,孔繁翔,于 洋,等.升温过程对藻类复苏和群落演替的影响 [J]. 中国环境科学, 2009,29(6):578-582.
[13] 代龚圆,李 杰,李 林,等.滇池北部湖区浮游植物时空格局及相关环境因子 [J]. 水生生物学报, 2012,36(5):947-956.
[14] 张金屯.数量生态学 [M]. 北京:科学出版社, 2004:171-178.
[15] 栾青杉,孙 军.2005年夏季长江口水域浮游植物群集特征及与环境因子的关系 [J]. 生态学报, 2010,30(18):4967-4975.
[16] Pappas J L. Phytoplankton assemblages, environmental influences and trophic status using canonical correspondence analysis, fuzzy relations, and linguistic translation [J]. Ecological Informatics, 2010,5(2):79-88.
[17] 夏品华,马健荣,李存雄,等.红枫水库冬春浮游生物与环境因子的典范对应分析 [J]. 环境科学研究, 2011,24(4):378-395.
[18] 刘奕伶,葛继稳,李艳元,等.古夫河着生藻类优势种体积与水质因子的相关性研究 [J]. 中国环境科学, 2015,35(7):2182-2191.
[19] HJ/T 91-2002 地表水和污水监测技术规范 [S].
[20] 黎尚豪,毕列爵.中国淡水藻志 [M]. 北京:科学出版社, 1998.
[21] 胡鸿钧,魏印心.中国淡水藻类系统、分类及生态 [M]. 北京:科学出版社, 2006.
[22] Reynolds C S. What factors influence the species composition of phytoplankton in lakes of different trophic status [J]. Hydrobiologia, 1998,369/370:11-26.
[23] Arhonditsisg, Winderm, Brenmt, et al. Pauems and mechanisms of phytoplankton varariability in lake Washington (USA) [J]. Water Research, 2004,38:4013-4027.
[24] 国家环境保护总局《水和废水监测分析方法》编委会.水和废水监测分析方法 [M]. 2版.北京:中国环境科学出版社, 2002: 156-290.
[25] Reynolds C S. The Ecology of Freshwater Phytoplankt on [M]. London: Cambridge University Press, 1984:63-74.
[26] 金相灿,刘鸿亮,屠清瑛,等.中国湖泊富营养化 [M]. 北京:中国环境科学出版社, 1990.
[27] 许 海,秦伯强,朱广伟.太湖不同湖区夏季蓝藻生长的营养盐制研究 [J]. 中国环境科学, 2012,32(12):2230-2236.
[28] Naselli-Flores L, Barone R. Phytoplankt on dynamics in two reservoir with different trophic state (Lake Rosamarina and Lake Arancio, Sicily, Italy [J]. Hydrobiologia, 1998,369/370:163-178.
[29] Lau S S S, Lane S N. Biological and chemical factors influencing shallow lake eutrophication: a long-term study [J]. The Science of the Total Environment, 2002,288(3):167-181.
[30] Habib O A, Tippett R, Murphy K J. Seasonal changes in phytoplankton community structure in relation to physicochemical factors in Loch Lomond, Scotland [J]. Hydrobiologia, 1997,350:63-79.
Canonical correspondence analysis of relationship between characteristics of phytoplankton community and environmental factors in Dianchi Lake.
WANG Hua1*, YANG Shu-ping1, FANG Sheng-zhong1, YU Fu-chao2, FENG Wen-bo1, LIU Li-ping1(1.Kunming Municipal Environmental Monitoring Center, Kunming 650228, China;2.Faculty of Life Science and Technology, Kunming University of Science and Technology, Kunming 650500, China). China Environmental Science, 2016,36(2):544~552
Abstract:Phytoplankton community of Dianchi Lake were investigated in March, May, July and November, 2013. Totally 6 phyla, 31genera of phytoplankton were identified which were mainly composed of Chlorophyta, Cyanophyta and Bacillariophyta. The average phytoplankton abundance was 7482×104cells/L. The Chlorophyta was the primary species, and which the Scenedesmus was dominating species in March. However, the Cyanophya dominated by the Microcystis was the primary species in May, July and November. The results of canonical correspondence analysis for the relationship between 31genera of phytoplankton and 10 environmental factors showed that the conductivity, dissolved oxygen (DO), total nitrogen (TN), total phosphorus (TP), and permanganate indexes (CODMn) were found to be main environmental factors effecting the distribution characteristics of phytoplankton community. Furthermore, the Cyanophyta was found to tolerate the higher concentration of nitrogen and phosphorus nutrients, and it could also be affected by the conductivity, permanganate indexes, dissolved oxygen and pH. The Chlorophyta could not only accommodate to the higher pH, water temperature and permanganate indexes, but also be affected by concentration of nitrogen and phosphorus nutrients, dissolved oxygen and conductivity. The Bacillariophyta could adapt to higher pH and permanganate indexes, and also be affected by concentration of nitrogen and phosphorus nutrients, water temperature, dissolved oxygen and conductivity.
Key words:Dianchi Lake;phytoplankton;community structure;environmental factors;canonical correspondence analysis
作者简介:王 华(1985-),女,傣族,云南通海人,工程师,硕士,主要从事环境监测及分析.
基金项目:国家水体污染控制与治理科技重大专项(2010ZX07102-006)
收稿日期:2015-07-15
中图分类号:X132
文献标识码:A
文章编号:1000-6923(2016)02-0544-09
