不同短程硝化系统中微生物群落结构的对比分析
2016-04-16侯爱月郑林雪张彦灼赵昕燕北京工业大学水质科学与水环境恢复工程北京市重点实验室北京100124
侯爱月,李 军,卞 伟,王 盟,郑林雪,张彦灼,赵昕燕 (北京工业大学水质科学与水环境恢复工程北京市重点实验室,北京 100124)
不同短程硝化系统中微生物群落结构的对比分析
侯爱月,李 军*,卞 伟,王 盟,郑林雪,张彦灼,赵昕燕 (北京工业大学水质科学与水环境恢复工程北京市重点实验室,北京 100124)
摘要:为探讨有机碳源对短程硝化系统中微生物群落结构的影响,采用构建克隆文库的方法对模拟无机城市生活污水和模拟实际城市生活污水短程硝化系统中的微生物群落结构进行对比分析.实验结果表明,变形菌门(Proteobacteria)和未培养菌(uncultured bacterium)是两系统中的优势菌群.两系统中的菌群结构存在差异,但优势菌群及其所占比例相似.两系统中的主要脱氮菌类群也相似,但由于有机碳源浓度的不同其菌属及比例有所差异.无机短程硝化系统中的脱氮菌群包括亚硝化单胞菌属(Nitrosomonas)、硝化螺菌属(Nitrospira)和Denitratisoma,其中自养硝化菌的比例高于其在有机短程硝化系统中的比例,但仍低于异养菌在该系统中的比例.有机短程硝化系统中的脱氮菌群主要包括β-Proteobacteria中的一些反硝化细菌和亚硝化单胞菌属(Nitrosomonas),其中亚硝化单胞菌属(Nitrosomonas)的含量很少.
关键词:有机碳源;短程硝化;克隆文库;微生物群落结构
* 责任作者, 教授, jglijun@bjut.edu.cn
与全程硝化相比,短程硝化可减少25%的硝化需氧量和40%的反硝化碳源,具有较低的污泥产量,并且可减少反硝化池容积[1-4],成为近几年新型生物脱氮工艺的研究热点.国内外有关短程硝化的研究多用于处理污泥消化液、垃圾渗滤液等高氨氮废水[5-6],并已有工程应用,而基于城市生活污水的短程硝化研究则多局限于实验室水平,有待于进一步深入.硝化过程是由氨氧化菌(AOB)和亚硝酸盐氧化菌(NOB)这两种菌群的生化作用完成,可以通过控制各种影响因素促进AOB的生长繁殖而抑制NOB的生长实现短程硝化[7-8].微生物在硝化过程中起着至关重要的作用,深入研究污泥中微生物群落结构有助于加强对硝化过程机理的理解,进而为工艺的优化控制和稳定运行提供更加全面的参考和依据.
目前国内外关于短程硝化的研究多集中在短程硝化的工艺运行及优化方面,李凌云等[9]对短程硝化的启动条件进行了优化,苏东霞等[10]进行了不同曝气方式SBR短程硝化试验.有关进水水质对短程硝化系统中微生物群落结构的研究较少,赵志瑞等[11]为探讨短程硝化系统中的微生物对不同污水的适应性,利用分子生物学技术对高氨氮废水和城市生活污水短程系统中活性污泥的细菌群落结构进行了比较.C、N是生活污水中最主要的两大污染元素,目前运用比较多的污水处理工艺(AO、AAO等)均是将硝化系统与反硝化系统分开,这样硝化系统中主要以N源为主,反硝化系统中以C源为主.但是,随着短程硝化技术的成熟以及对高脱氮率的追求而设置的高回流比,使得有机碳源可能进入硝化系统.另外,许多脱氮新工艺的出现,使得硝化系统与反硝化系统合二为一,比如,同步硝化反硝化(SND)和同步亚硝化-厌氧氨氧化-反硝化(SNAD)等,即C、N共存于同一系统中.因此,探讨有机碳源对短程硝化系统中微生物群落结构的影响有很大的现实意义.本研究考察了有机碳源的存在对短程硝化系统中微生物群落结构的影响,并着重考察了有机碳源对常见自养硝化菌群的影响,以期为SND、SNAD等C、N共存一个系统的新工艺提供微生物基础,利于污染去除效果的提高.
本实验采用两个SBR反应器,接种相同的活性污泥,进水分别为模拟无机城市生活污水和模拟实际城市生活污水,通过控制溶解氧(DO)和曝气时间,实现稳定的短程硝化.采用构建克隆文库的方法,对两种短程硝化系统中的微生物群落结构进行对比分析,考察有机碳源对基于城市生活污水短程硝化系统中微生物群落结构的影响,确定优势菌群,以期为实现可控短程硝化提供微生物群落调控方面的理论依据.
1 材料与方法
1.1 样品采集
实验采用两个构造相同由有机玻璃制成的SBR反应器,内部设置定时搅拌装置和精确曝气装置.反应器1的进水采用模拟无机城市生活污水,反应器2的进水为模拟实际城市生活污水,两个反应器中的具体水质指标(mg/L)为:COD (CH3COONa) 200(只有反应器2中添加), NH4+-N(NH4Cl) 70,碱度(CaCO3计) 500,磷(KH2PO4) 2; 铁(FeSO4⋅7H2O) 1,硼(H3BO3) 0.2,锰(MnCl2⋅4H2O) 0.2,锌(ZnSO4⋅7H2O) 0.2,铜(CuSO4⋅5H2O) 0.1,镁(MgSO4⋅7H2O) 0.1,镍(NiCl2⋅6H2O) 0.2,钴(CoCl2⋅6H2O) 0.3.两个反应器内的接种污泥均取自北京某污水处理厂曝气池,其硝化性能良好,f值在0.7左右,污泥指数(SVI)值在90mL/g左右,污泥浓度(MLSS)在3500mg/L左右.实验过程中控制温度在20~22℃,pH值在7.2~7.9,溶解氧在0.5~1mg/L,经过80个周期的运行,两个反应器内的NO2--N积累率均达到90%以上,继续运行30个周期, NO2--N积累率维持稳定,成功实现了短程硝化的稳定运行.在两反应器的稳定运行时期(第110个周期),进行污泥样品采集,对应编号样品为R1和R2,样品采集后在-20℃下保存.
1.2 实验方法
1.2.1 细菌总DNA提取 泥样在1.5mL离心管中静沉30min后去除上清液,15000r/min高速离心5min后,去除上层清液,取0.3g泥样用于总DNA提取,剩余污泥冷冻备用.采用上海生工提供的“Ezup柱式基因组DNA抽提试剂盒(土壤)”提取后,取5μL用1.2%琼脂糖凝胶检测.其余置于-20℃储存备用.
1.2.2 聚合酶链式反应(PCR) 将提取的细菌总DNA作为PCR的模板,采用针对细菌16S rRNA基因的通用引物对27f(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492r(5′-TACGGYTACCTTGTTACGACTT-3′)进行PCR扩增.PCR反应体系(50μL):10×PCR Buffer 5μL,dNTP(各2.5mmol/L) 1μL,27f(20μmol/L) 1μL,1492r(20μmol/L) 1μL, Taq DNA聚合酶(5U) 0.5μL,DNA模板0.5μL,加ddH2O至50μL.PCR采用降落式扩增程序,具体反应条件为:首先95℃预变性1.5min;其次95℃变性0.5min,60℃退火0.5min,72℃延伸2min,5个循环;之后95℃变性0.5min,55℃退火0.5min, 72℃延伸2min,5个循环;之后95℃变性0.5min, 50℃退火0.5min,72℃延伸2min,15个循环;最后60℃延伸10min.
将提取的细菌总DNA作为PCR的模板,采用针对AOB功能基因amoA的引物对amoA-1F(5′-GGGGTTTCTACTGGTGGT-3′)和amoA-2R(5′-CCCCTCKGSAAAGCCTTCTTC-3′)进行PCR扩增.PCR反应体系(50μL)为:10×PCR buffer 5μL,dNTP(各2.5mmol/L) 2μL,amoA-1F (20μmol/L)1μL,amoA-2R(20μmol/L) 1μL,Taq DNA聚合酶(5U) 0.5μL,DNA模板2μL,加ddH2O 至50μL.PCR反应条件为:首先94℃预变性5min;其次94℃变性30S,55℃退火1min,72℃延伸1min,35个循环;最后72℃延伸10min.
1.2.3 克隆、转化和文库的构建 PCR产物用上海生工提供的“SanPrep柱式DNA胶回收试剂盒”进行纯化后,与pMD18-T载体(Takara)连接.之后将连接产物转入JM109感受态细胞中,涂布在含Amp/X-Gal/IPTG的LB平板上,37℃下培养15h左右后进行蓝白斑筛选.蓝色菌落为阴性菌落,白色菌落为阳性菌落.随机挑选一定量的白斑,用载体通用引物对RV-M(5′-CGCCAGGGTTTTCCCAGTCACGAC-3′)和M13-47(5′-GAGCGGATAACAATTTCACACAGG-3′)做菌落PCR进行假阳性的验证,筛选出插入的片段大小正确的克隆子.
片段大小正确的PCR产物用Hha I(Takara, Japan)限制性内切酶进行酶切.酶切反应于37℃进行4h,酶切产物用3%的琼脂糖凝胶电泳检测,然后在凝胶成像系统中成像,并根据凝胶成像结果中的酶切带型分型,每个酶切类型挑取1~2个代表菌株送往上海生工生物公司测序.
将测序所得基因序列,去除载体片段,并利用Bellerophon软件进行chimerae的剔除(http:// comp-bio.anu.edu.au/bellerophon/bellerophon.pl).将处理后的测序基因序列输入到NCBI网站,利用blast程序与数据库中已有的序列进行比对鉴定,将序列比对结果相同的克隆子定义为一个操作分类单元(operational taxonomic unit, OTU),并下载每个OTU代表序列的同源性序列,利用MEGA5.0软件中的邻接算法构建系统发育树.
2 结果与分析
2.1 反应器运行状况分析
两个SBR反应器内短程硝化工艺启动驯化和稳定运行过程中NO2--N积累率随周期的变化情况如图1所示.

图1 两个反应器中NO2--N积累率的变化Fig.1 The change of nitrogen accumulation rate in two reactors
由图1可见,两个反应器中NO2--N积累率均随周期数增加而逐渐升高,运行至第80个周期, NO2--N积累率都达到90%以上,继续运行30个周期, NO2--N积累率维持稳定,成功实现了模拟无机城市生活污水短程硝化和模拟实际城市生活污水短程硝化的稳定运行.
两个SBR反应器中各个运行周期内的曝气时间如表1所示.由表1可见,两个反应器中各个运行周期内的曝气时间均随周期数增加而逐渐减少,但反应器2中各个周期内的曝气时间都多于反应器1内的曝气时间.
由图1和表1可见,针对SBR工艺,有机碳源对短程硝化启动所需的周期数没有太大影响,但是会增加每个周期的运行时间,进而增加短程硝化启动并维持稳定所需的总时间.进水中添加有机碳源,促进异养菌的生长,抑制自养硝化菌的生长,短程硝化的实现相对缓慢,在两反应器的稳定运行时期(第110个周期),进行污泥取样,检测微生物种群,考察有机碳源对短程硝化系统中微生物群落结构的影响.

表1 两个反应器中各个运行周期内的曝气时间Table 1 Aeration time of each operation cycle in two reactors
2.2 总DNA提取与PCR扩增
污泥样品提取的DNA进行电泳检测,得到的总DNA片段大小约为23kb.以样品总DNA为模板,通过引物分别对细菌16S rRNA基因和AOB amoA基因进行PCR扩增,所得到的片段大小约为1500bp和500bp,与目的基因片段长度相当,满足后续实验要求.
2.3 短程硝化系统中总细菌的群落结构分析
反应器1中细菌16S rRNA基因的系统发育树如图2所示.R1样品的16S rDNA克隆文库中,80个克隆子分类为24个OTUs.根据莫旭华[12]的群落结构计算方法和系统学分析,该文库的覆盖率为93.75%,Shannon–Weiner指数为4.25, Simpson指数为93.50%,均匀度为0.93.由图2可以看出所有OTUs分别属于细菌域的7个主要类群,其中,变形菌门(Proteobacteria)和未培养菌(uncultured bacterium)在文库中所占比例最大,分别为35%和31.25%;其次是拟杆菌门(Bacteroidetes)和酸杆菌门(Acidobacteria),分别占17.5%和7.5%;硝化螺旋菌门(Nitrospira)、螺旋体门(Spirochaetes)、和绿弯菌门(Chloroflexi)所占比例相对较小,分别为3.75%、3.75%、3.75%、1.25%.
反应器2中细菌16S rRNA基因的系统发育树如图3所示.R2样品的16S rDNA克隆文库中,100个克隆子分类为30个OTUs.该文库的覆盖率为90%,Shannon–Weiner指数为4.42, Simpson指数为93.76%,均匀度为0.90.由图3可以看出所有OTUs分别属于细菌域的5个主要类群,其中,未培养菌(uncultured bacterium)和变形菌门(Proteobacteria)在文库中所占比例最大,分别为43%和30%;其次是拟杆菌门(Bacteroidetes),占17%;此外还含有少量的疣微菌门(Verrucomicrobia)和浮霉菌门(Planctomycetes),在文库中各占比例为8%和2%.
这一结果与Snaidr等[13]的研究结果一致,即变形菌门(Proteobacteria)一直是废水处理系统中的优势类群.R1样品中Proteobacteria又分为α-Proteobacteria (1.25%);β-Proteobacteria (32.5%); δ-Proteobacteria (1.25%).R2样品中Proteobacteria又分为α-Proteobacteria (2%);β-Proteobacteria (18%); γ-Proteobacteria (7%); δ-Proteobacteria (3%).
两系统中的另一优势菌群为未培养菌,表明短程硝化系统中的细菌多样性丰富,并潜藏着许多未被人们认识的微生物新资源,有待于进一步深入研究.R1样品中未培养菌所占比例为31.25%, R2样品中未培养菌所占比例高达40%,表明有机碳源存在的短程硝化系统中,细菌多样性更丰富,潜藏着更多还无法估量的微生物资源,在未来的研究中还需结合纯分离培养方法和其它分子生物学手段,以验证和完善本研究的16S rDNA克隆文库菌群结构研究.
拟杆菌门(Bacteroidetes)是两系统中共同存在的第三大类菌群,且在两克隆文库中所占比例相近,表明Bacteroidetes对有机碳源的适应性较强.拟杆菌是化能有机营养菌,能够代谢碳水化合物,降解许多复杂有机物[14].
R1样品中特有的微生物类群为硝化螺旋菌门(Nitrospira)、酸杆菌门(Acidobacteria)、螺旋体门(Spirochaetes)和绿弯菌门(Chloroflexi). Nitrospira是到目前为止,很多文献中报道的在生物脱氮过程中占主导地位的亚硝酸盐氧化菌(NOB)[15-16].Nitrospira是自养型细菌,在与异养菌共同生存时,其自身生长周期长,没有时空方面的竞争优势,因而受到抑制.Tank 等[17]的研究指出Acidobacteria广泛存在于贫营养环境中.

图2 反应器1中细菌16S rRNA基因的系统发育树Fig.2 Phylogenetic tree based on comparison of bacteria 16S rRNA gene in reactor 1
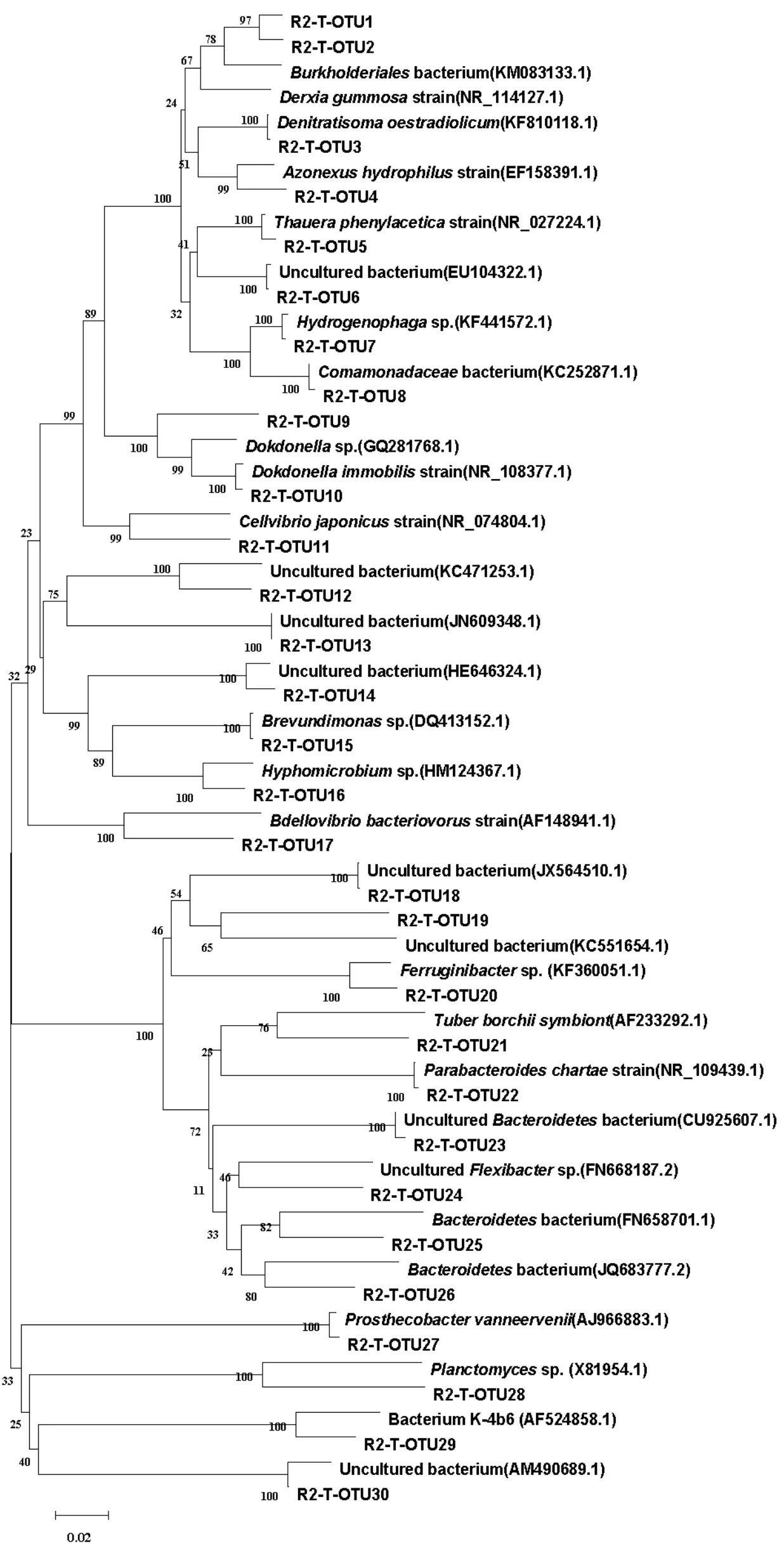
图3 反应器2中细菌16S rRNA基因的系统发育树Fig.3 Phylogenetic tree based on comparison of bacteria 16S rRNA gene in reactor 2
R2样品中特有的微生物类群为疣微菌门(Verrucomicrobia)和浮霉菌门(Planctomycetes). Verrucomicrobia是新划分出的一门细菌,含有为数不多的一些被辨别出的种类,多数在土壤和水中生存,能够降解有机物[18].Planctomycetes是一类重要的环境微生物,对全球氮循环具有重要意义,包括化能自养型的厌氧氨氧化菌,但多数浮霉菌是化能异养型的,如Planctomyces、Pirellula、Gemmata、Isosphaera,在厌氧条件下利用有机物进行发酵作用[19].该反应器为立方体结构,空间上可能存在缺氧区域,且反应器为间歇运行,闲置时反应器为缺氧状态,因此形成了适合此类细菌生长的环境.
2.4 短程硝化系统中脱氮功能菌的群落结构分析在构建的两个16S rDNA克隆文库中,变形菌都是优势菌群,多数脱氮细菌也分布在这一类中.R2样品中占优势的β-变形菌纲包括索氏菌属(Thauera)、固氮弧菌属(Azoarcus)、德克斯氏菌属(Derxia)、氢噬胞菌属(Hydrogenophaga)和Denitratisoma.其中,Thauera属细菌是一类广泛存在于各种类型的废水处理装置中具有反硝化及多种芳香族污染物降解能力的重要功能微生物[20];Azoarcus属在很多的研究中被证明是反硝化条件下降解芳香族化合物的重要的微生物[21-22].该模拟实际城市生活污水实现的短程硝化系统中一些具有反硝化功能的菌群出现,说明反应器2中除了传统的硝化途径外,还同时存在着多种反硝化反应作用于氨氮的去除过程中.该文库中未检测出常见的氨氧化菌(AOB)和亚硝酸盐氧化菌(NOB),因系统中添加有机碳源,异养菌相对于自养菌繁殖速度快,世代周期短,能够快速的生产繁殖并大量聚集.实验结果表明,在该有机碳源存在的短程硝化系统中,硝化细菌含量很少,异养菌仍然占绝对优势.
R1样品中占优势的β-变形菌纲包括亚硝化单胞菌属(Nitrosomonas)和Denitratisoma,其中代表克隆子R1-T-OTU1、R1-T-OTU2和R1-TOTU3分别与Nitrosomonas sp.(AJ224941)、Nitrosococcus mobilis(AF287297)和Nitrosomonas sp.(AB079053)的同源性为99%,且并未检出亚硝化螺菌属(Nitrosospira).因此,该系统中的优势自养型氨氧化菌(AOB)属于亚硝化单胞菌属(Nitrosomonas),所占比例为22.5%.这一结果与多数研究结果相吻合,即多数污水处理系统中占优势的AOB为Nitrosomonas[23-25].辛晓冬[26]的研究指出Denitratisoma具有反硝化性能.该系统中的优势自养亚硝酸盐氧化菌(NOB)属于硝化螺菌属(Nitrospira),所占比例为3.75%.结果表明该模拟无机城市生活污水实现的短程硝化系统中常见的自养硝化菌所占比例为26.25%,高于其在上述有机短程硝化系统中的比例,但仍低于异养菌在该系统中的比例.

图4 反应器1中AOB amoA基因的系统发育树Fig.4 Phylogenetic tree based on comparison of amoA gene of AOB in reactor 1
为了更加全面的了解短程硝化系统中的硝化细菌,对于系统中数量较少的氨氧化菌(AOB),采用针对AOB功能基因amoA的引物对进行PCR特异性扩增,构建AOB的克隆文库.基于amoA基因建立AOB的系统发育树见图4和图5.结果表明,构建的两个克隆文库中所检测出的AOB均属于亚硝化单胞菌属(Nitrosomonas).
通过构建克隆文库的方法对两个短程硝化系统中的脱氮菌群进行对比分析,实验结果表明:R1系统中的脱氮菌群包括亚硝化单胞菌属(Nitrosomonas)、硝化螺菌属(Nitrospira)和 Denitratisoma,其中自养硝化菌的比例为26.25%,高于其在有机短程硝化系统中的比例,但仍低于异养菌在该系统中的比例;R2系统中脱氮菌群主要包括β-变形菌纲中的一些反硝化细菌和亚硝化单胞菌属(Nitrosomonas),其中亚硝化单胞菌属(Nitrosomonas)的含量很少.两个短程硝化系统中的主要脱氮菌类群相似,主要分布于β-变形菌纲,由于有机碳源浓度的不同其菌属及比例有所差异.

图5 反应器2中AOB amoA基因的系统发育树Fig.5 Phylogenetic tree based on comparison of amoA gene of AOB in reactor 2
3 结论
3.1 通过构建系统16S rDNA克隆文库,对比分析了模拟无机城市生活污水和模拟实际城市生活污水短程硝化系统中的微生物群落结构,无机短程硝化系统中包括7个主要类群,按照优势类群依次为Proteobacteria(35%),uncultured bacterium (31.25%),Bacteroidetes(17.5%), Acidobacteria(7.5%), Nitrospira (3.75%), Spirochaetes (3.75%), Chloroflexi (3.75%);有机短程硝化系统中包括5个主要类群,按照优势类群依次为uncultured bacterium (43%), Proteobacteria (30%), Bacteroidetes (17%), Verrucomicrobia (8%), Planctomycetes (2%).
3.2 模拟无机城市生活污水和模拟实际城市生活污水短程硝化系统中的微生物群落结构存在差异,但优势菌群及其比例相似,Proteobacteria和 uncultured bacterium是两系统中的优势菌群.
3.3 模拟无机城市生活污水和模拟实际城市生活污水短程硝化系统中的主要脱氮菌类群相似,由于有机碳源浓度的不同其菌属及比例有所差异.无机短程硝化系统中的脱氮菌群包括Nitrosomonas、Nitrospira和Denitratisoma,其中自养硝化菌的比例高于其在有机短程硝化系统中的比例,但仍低于异养菌在该系统中的比例.有机短程硝化系统中的脱氮菌群主要包括β-Proteobacteria中的一些反硝化细菌和Nitrosomonas,其中Nitrosomonas的含量很少.
参考文献:
[1] 张功良,李 冬,张肖静,等.延时曝气对常温低氨氮SBR亚硝化影响及恢复 [J]. 中国环境科学, 2014,34(8):1998-2002.
[2] Bartroli A, Carrera J, Perez J. Bioaugmentation as a tool for improving the start-up and stability of a pilot-scale partial nitrification biofilm airlift reactor [J]. Bioresource Technology,2011,102(6):4370-4375.
[3] Nittami T, Ootake H, Imai Y, et al. Partial nitrification in a continuous pre-denitrification submerged membrane bioreactor and its nitrifying bacterial activity and community dynamics [J]. Biochemical Engineering Journal, 2011,55(2):101-107.
[4] 苏东霞,李 冬,张肖静,等.曝停时间比对间歇曝气SBR短程硝化的影响 [J]. 中国环境科学, 2014,34(5):1152-1158.
[5] 张 亮.高氨氮污泥消化液生物脱氮工艺与优化控制 [D]. 哈尔滨:哈尔滨工业大学, 2013.
[6] 何晓红,杨 暖,陶 勇,等.高浓度氨氮废水短程硝化及氨氧化菌群分析 [J]. 应用与环境生物学报, 2013,19(2):313-317.
[7] Beccari M, Passino R, Ramadori R, et al. Kinetics of dissimilatory nitrate and Nitrite reduction in suspended growth culture [J]. Water Pollution Control Federation, 1983,55(1):58-64.
[8] Turk O, Mavinic D S. Benefits of using selective inhibition to remove nitrogen from highly nitrogenous wastes [J]. Environmental. Technology. Letters, 1987,8(1):419-426.
[9] 李凌云,彭永臻,杨 庆,等.SBR工艺短程硝化快速启动条件的优化 [J]. 中国环境科学, 2009,29(3):312-317.
[10] 苏东霞,李 冬,张肖静,等.不同曝气方式SBR短程硝化试验研究 [J]. 中南大学学报(自然科学版), 2014,45(6):2120-2129.
[11] 赵志瑞,马 斌,张树军,等.高氨氮废水与城市生活污水短程硝化系统菌群比较 [J]. 环境科学, 2013,34(4):1448-1456.
[12] 莫旭华,麻 威,史荣久,等.氮肥对小麦田土壤nirS型反硝化细菌多样性的影响 [J]. 微生物学报, 2009,49(9):1203-1208.
[13] Snaidr J, Amann R, Huber I, et al. Phylogenetic analysis and in situ identification of bacteria in activated sludge [J]. Applied & Environmental Microbiology, 1997,63(7):2884-2896.
[14] Hill V R, Kahler A M, Jothikumar N, et al. Multi-State evaluation of an ultrafiltration-based procedure for simultaneous recovery of enteric microbes in 100-L tap water samples [J]. Journal of Japan Water Works Association, 2007,76(13):4218-4225.
[15] Burrell P, Keller J, Blackall L. Characterisation of the bacterial consortium involved in nit rite oxidation in activated sludge [J]. Water Science & Technology, 1999,39(6):45-52.
[16] Lee H, Lee S, Lee J, et al. Molecular characterization of microbial community in nit rate-removing activated sludge [J]. Fems Microbiology Ecology, 2002,41(2):85-94.
[17] Tank M, Bryant D A. Nutrient requirements and growth physiology of the photoheterotrophic Acidobacterium, Chloracidobacterium thermophilum [J]. Frontiers in Microbiology, DOI:10.3389/fmicb.2015.00226.
[18] 李妙婉.一体化脱氮除磷曝气生物滤池处理生活污水的效能及微生物种群结构研究 [D]. 济南:济南大学, 2014.
[19] 黄佩蓓,焦念志,冯 洁,等.海洋浮霉状菌多样性与生态学功能研究进展 [J]. 微生物学通报, 2014,41(9):1891-1902.
[20] 郑林雪,李 军,胡家玮,等.同步硝化反硝化系统中反硝化细菌多样性研究 [J]. 中国环境科学, 2015,35(1):116-121.
[21] Dagley S. Catabolism of aromatic compounds by microorganisms [J]. Advances in Microbial Physiology, 1971,6(6): 1-46.
[22] Caroline S H and Rebecca E P. The β-ketoadipate pathway and the biology of self-identity [J]. Annual Review of Microbiology, 1996,50:553-590.
[23] Limpiyakorn T, Kurisu F, Sakamoto Y, et al. Effects of ammonium and nitrite on communities and populations of ammonia-oxidizing bacteria in laboratory-scale continuous-flow reactors [J]. Fems Microbiology Ecology, 2007,60(3):501-512.
[24] Lapara T M., Ghosh S. Population dynamics of the ammonia-oxidizing bacteria in a full-scale municipal wastewater treatment facility [J]. Environmental Engineering Science, 2006,23(2):309-319.
[25] Limpiyakorn T, Shinohara Y, Kurisu F, et al. Communities of ammonia-oxidizing bacteria in activated sludge of various sewage treatment plants in Tokyo [J]. Fems Microbiology Ecology, 2006,54(2):205-217.
[26] 辛晓东.运行条件对MBR膜污染调控的微生物学研究 [D]. 哈尔滨:哈尔滨工业大学, 2013.
Analysis of microbial community structure in different partial nitrification system.
HOU Ai-yue, LI Jun*, BIAN Wei, WANG Meng, ZHENG Lin-xue, ZHANG Yan-zhuo, ZHAO Xin-yan (Key Laboratory of Beijing for Water Quality Science and Water Environment Recovery Engineering, Beijing University of Technology, Beijing 100124, China). China Environmental Science, 2016,36(2):428~426
Abstract:In order to study the influences of organic carbon source on the microbial community structure in partial nitrification system, the microbial diversity was investigated in two partial nitrification reactors by the construction of bacterial clone library. The influents of two reactors were artificial wastewater with and without organic carbon source, respectively. The results indicated that Proteobacteria and uncultured bacterium were the dominant bacteria of the two studied systems. The differences existed in the structure of the bacterial community of the two systems. Nonetheless, the dominant bacteria and their proportions were similar to each other in the total clones. In addition, the main denitrifer groups were also similar in the two systems. Due to the different concentrations of organic carbon source, the denitrifer genera and their proportions were distinct. The main denitrifer genera of partial nitrification reactor with inorganic wastewater were Nitrosomonas, Nitrospira and Denitratisoma. The proportion of autotrophic nitrifying bacteria in partial nitrification reactor with inorganic wastewater was higher than that with organic wastewater. But in the reactor with inorganic wastewater, the proportion of autotrophic bacteria was lower than heterotrophic bacteria. The main denitrifer genera of partial nitrification reactor with organic wastewater were some denitrifying bacteria of β-Proteobacteria and Nitrosomonas. Additionally, the proportion of the latter in this reactor was relatively low.
Key words:organic carbon;partial nitrification;clone library;microbial community structure
作者简介:侯爱月(1990-),女,河北张家口人,北京工业大学硕士研究生,主要从事污水生物处理研究.
基金项目:国家水体污染控制与治理科技重大专项资助项目(2014ZX07201-011)
收稿日期:2015-07-10
中图分类号:X172
文献标识码:A
文章编号:1000-6923(2016)02-0428-09
