膜生物反应器处理晚期垃圾渗滤液亚硝化性能及其抑制动力学分析
2016-04-16熊向阳张美雪张彦灼北京工业大学建筑工程学院北京市水质科学与水环境恢复工程重点实验室北京004中国城市建设研究院有限公司北京000
李 芸,熊向阳,李 军*,陈 刚,张美雪,张彦灼,姚 远,李 强(.北京工业大学建筑工程学院,北京市水质科学与水环境恢复工程重点实验室,北京 004;.中国城市建设研究院有限公司,北京 000)
膜生物反应器处理晚期垃圾渗滤液亚硝化性能及其抑制动力学分析
李 芸1,熊向阳2,李 军1*,陈 刚2,张美雪1,张彦灼1,姚 远2,李 强2(1.北京工业大学建筑工程学院,北京市水质科学与水环境恢复工程重点实验室,北京 100124;2.中国城市建设研究院有限公司,北京 100012)
摘要:采用连续流MBR反应器处理晚期垃圾渗滤液,考察其亚硝化性能;并探讨底物、产物和毒性物质对亚硝化性能的抑制及其动力学特性.结果表明,在进水N H4+-N浓度为(280±20)mg/L时,通过控制DO为0.5~1mg/L,pH值为7.8~8.2和温度为(30±1)℃,成功启动MBR的亚硝化工艺,在第32d时, NO2--N积累率为84.27%;后逐步升高进水负荷,并提高DO至2~3mg/L,逐渐实现MBR系统中以晚期垃圾渗滤液原液为进水的亚硝化,在第112d时,系统出水NO2--N浓度为889mg/L, NO2--N积累率为97.23%.底物、产物和毒性物质的抑制实验表明,毒性物质对微生物的抑制作用强于底物和产物;当毒性物质浓度(以COD计)为1600.2mg/L时,氨氧化速率下降了22.15%,而相应条件下若以FA为单因子抑制时,氨氧化速率下降了4.74%~6.49%,若以FNA为单因子抑制时,氨氧化速率相比下降了14.46%~15.86%.分别采用Haldane底物抑制模型、Aiba产物抑制模型以及修正后的毒性物质抑制模型对实验数据进行非线性拟合,相关系数R2分别为0.9821、0.9961和0.9924,并得到底物、产物和毒性物质的抑制动力学模型.
关键词:晚期垃圾渗滤液;膜生物反应器(MBR);亚硝化;抑制动力学
* 责任作者, 教授, jglijun@bjut.edu.cn
垃圾填埋场所产生的垃圾渗滤液成分复杂、氨氮浓度大,并且含有毒性有机物和重金属等毒害物质[1-2].在脱氮方面,新鲜的垃圾渗滤液中的有机物可生化性较好,可利用其自身碳源通过常规的硝化反硝化,或短程硝化反硝化等工艺进行脱氮;而晚期垃圾渗滤液中的有机物往往可生化性较差,为典型的高氨氮低碳氮比污水,在采用常规硝化反硝化工艺脱氮过程中需要补充大量碳源,造成处理成本增高,故应寻求更经济节能的脱氮方法.
亚硝化与厌氧氨氧化的自养组合脱氮技术已经成为高氨氮低碳氮比废水的研究热点.亚硝化与厌氧氨氧化的组合工艺有两种,一是亚硝化阶段实现NO2--N积累后与原液配成ρ(NO2--N)/ ρ(NH4+-N)为1:1的进水进行厌氧氨氧化脱氮,二是在亚硝化阶段控制出水ρ(NO2--N)/ρ(NH4+-N) 为1:1,后进行厌氧氨氧化脱氮.不管是前者还是后者都需实现稳定的亚硝化,才能满足后续脱氮要求,而实现稳定的亚硝化关键是氨氧化菌(AOB)的截留,及亚硝酸氧化菌(NOB)的淘汰; AOB为自养菌,其生长缓慢,世代周期较长[3]. MBR可实现系统污泥的高效截留,对于繁殖速度较慢的AOB来说,采用该工艺可实现AOB菌群的快速富集,从而缩短实现亚硝化的时间.目前,采用MBR实现亚硝化的研究较少[4-5],且处理的废水均为氨氮浓度较低的模拟配水.而晚期垃圾渗滤液原液中氨氮一般大于1000mg/L,采用MBR反应器处理晚期垃圾渗滤液原液的亚硝化也鲜有报道.
因此,本研究以实际晚期垃圾渗滤液原液为处理对象,通过控制运行条件,并逐步增加进水负荷以实现MBR反应器处理晚期垃圾渗滤液原液的亚硝化.此外,晚期垃圾渗滤液具有高氨氮和有微生物毒性作用的特点,在处理过程中,高氨氮环境会形成较高浓度的游离氨(FA)从而对微生物产生抑制,亚硝化会导致NO2--N逐渐积累所产生的游离亚硝酸(FNA)也会形成产物抑制[6-7],晚期垃圾渗滤液中所含的有毒害作用的有机物及重金属等也会形成毒性抑制[8-9].故通过批试实验分别对亚硝化过程中底物、产物及毒性物质的抑制作用及其抑制动力学进行探讨,以分析晚期垃圾渗滤液亚硝化过程中底物、产物及毒性物质的抑制特性并得出其抑制动力学方程,以期为MBR亚硝化工艺处理晚期垃圾渗滤液的实际应用提供指导.
1 材料与方法
1.1 实验装置
实验采用MBR反应器(图1),反应器由有机玻璃制成,其有效容积为25L,内置膜组件(聚偏氟乙烯中空纤维膜,膜孔径为0.1µm,膜面积为0.5m2).进水由蠕动泵泵入,出水通过膜组件由蠕动泵排出,通过可编程逻辑控制器系统控制,采用恒通量过滤间歇抽吸方式进行产水,膜通量为2.28L/(m2·h),抽吸周期为10min,8min抽吸,停2min.曝气装置置于膜组件下,通过转子流量计控制曝气量,曝气量为40~160L/h,曝气产生的水力剪切作用可形成错流过滤以减缓膜污染并对反应器内液相形成扰动.通过真空表(津制00000578型,天津)来显示过膜压力(TMP),以此判断膜污染程度.温控装置控制温度为(30±1)℃左右,HRT为22h,除了定期取100mL水样测MLSS外,未进行排泥.
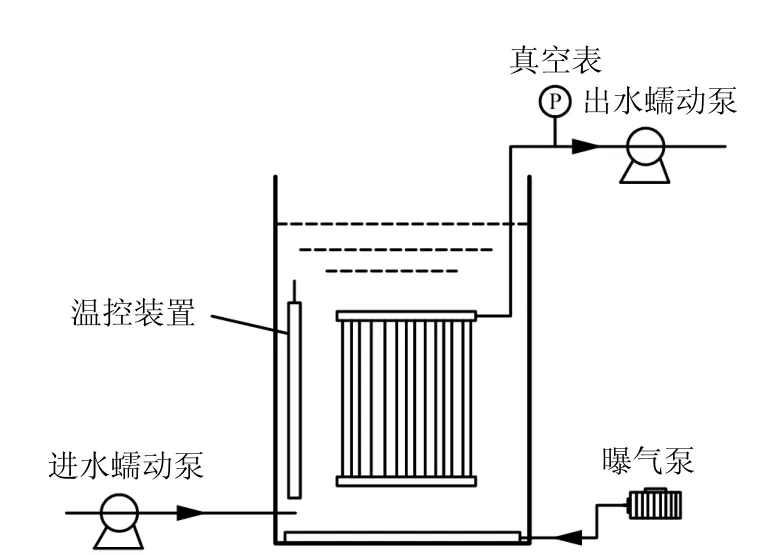
图1 MBR反应器示意Fig.1 Schematic diagram of MBR reactor
1.2 实验种泥和渗滤液
实验所用种泥取自北京某污水处理厂活性污泥,为全程硝化污泥,硝化性能良好.接种初始污泥浓度MLSS为3104mg/L,MLVSS为2540mg/L.
实验所用渗滤液取自北京某垃圾填埋厂(填埋年限大于5a),为晚期渗滤液,取回后密闭贮存于塑料桶中,平均每月更新一次.具体水质如下: NH4+-N为900~1500mg/L, NO2--N为0~2mg/L, NO3--N为0~8mg/L, COD为2000~4000mg/L, pH 值7.5~8.5,碱度6000~10000mg/L.
1.3 抑制动力学批试实验
取第71d时MBR中亚硝化活性污泥,用自来水和PBS缓冲液各清洗3~5遍,后进行浓缩,浓缩液MLSS约为5.04g/L,批试实验各取150mL污泥浓缩液加入至1L的烧杯中并稀释至1L进行,底物和产物抑制实验中NH4+-N和NO2--N根据所设梯度配成相应浓度,毒性物质抑制以氯化铵调节各梯度NH4+-N浓度统一以消除底物抑制的影响.以碳酸氢钠和盐酸调节碱度和pH值恒定,在恒温培养箱中进行实验,每间隔30min取样测定,计算氨氧化速率、NO2--N生成速率和硝态氮生成速率,所有测试设3个平行并求平均值.
1.4 测试分析方法
NH4+-N:纳氏试剂光度法;NO2--N:N-(1-萘基)-乙二胺分光光度法;NO3--N:麝香草酚分光光度法;悬浮固体(MLSS)、挥发性悬浮固体(MLVSS):重量法;pH值、DO、温度: WTW/ Multi3420便携式测定仪.
NO2--N积累率(R)、游离氨(FA)和游离亚硝酸(FNA)分别按照以下公式计算:

式中:ρ[NO2--N]为出水NO2--N浓度, mg/L; ρ[NO3--N]为出水NO3--N浓度, mg/L; ρ[NH4+-N] 为NH4+-N浓度, mg/L; T为温度,℃.
2 结果与讨论
2.1 低溶解氧条件下亚硝化的启动
一般认为,通过控制合适的温度、pH值以及溶解氧(DO)可以抑制亚硝酸氧化菌(NOB),促使氨氧化菌(AOB)的富集,从而实现亚硝化.多数研究表明,能够快速富集AOB并且对NOB产生抑制的条件是:温度为30~35℃[10],pH值为8.0左右[11],DO小于1mg/L[12-13].因此在本实验中,为了快速启动亚硝化反应,反应器在启动期的运行条件为:温度控制在(30±1)℃,pH值维持在7.8~8.2, DO控制在0.5~1mg/L,HRT为22h.启动期分为两个阶段,第一阶段(0~18d)是采用无机配水启动短程硝化,进水NH4+-N浓度为280±20mg/L;第二阶段(19~32d)通入稀释后的垃圾渗滤液,同样控制进水NH4+-N浓度为280±20mg/L.MBR亚硝化系统启动的运行性能如图2所示.
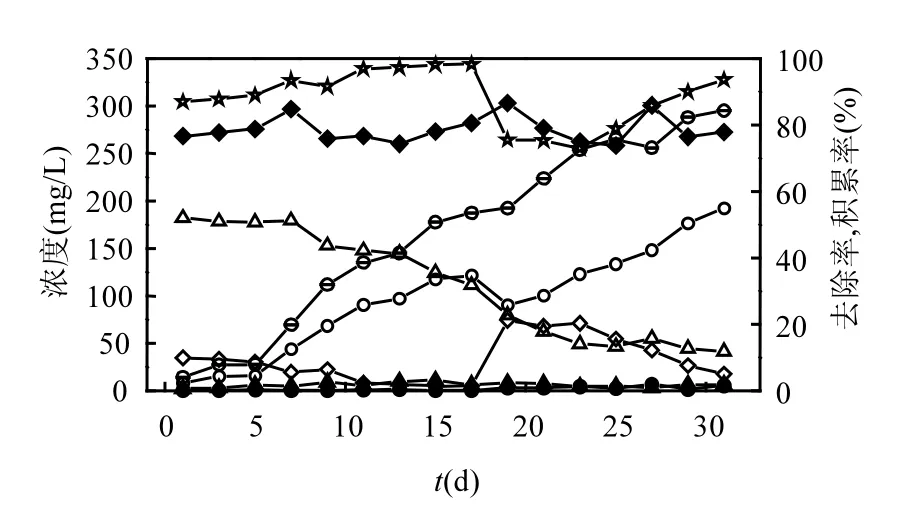
图2 启动阶段MBR亚硝化运行性能Fig.2 Performance of nitritation during startup

由图2可以看出,在第一阶段,经过3~5d的适应期后,出水NO3--N呈逐渐降低趋势,而出水NO2--N浓度则逐渐升高.说明通过控制实验温度、溶解氧和pH值,NOB活性受到明显抑制,而AOB活性则逐渐提高,系统在由全程硝化向亚硝化转变.在第15d和17d时,系统NO2--N积累率分别为50.7%和53.5%,说明此时系统中AOB已经为优势种群;通常认为,NO2--N积累率大于50%即发生了短程硝化反应.因此,在第19d开始通入稀释后的垃圾渗滤液,该开始时,系统因为进水水质发生变化,并且垃圾渗滤液中含有大量毒害物质,微生物活性受到抑制,从而导致系统受到干扰,出水水质发生变化,出水NH4+-N升高(由5.14mg/L升至74.20mg/L), NH4+-N去除率由98.17%降至75.53%.后经过14d的运行,系统硝化性能得到恢复,直至32d时, NH4+-N去除率恢复至93.59%,说明系统中微生物已经逐步适应该进水水质.而在整个启动过程中, NO2--N积累率呈逐渐增长的趋势,在第32d时,其值为84.27%,说明反应器亚硝化启动成功.
2.2 MBR反应器负荷提高阶段亚硝化性能
随着系统亚硝化的成功启动,系统中的亚硝化细菌已经逐渐取代硝化细菌成为优势菌种, NO2--N逐渐在系统中积累.此时系统中对NOB的抑制因子包括有温度、pH值、FA、FNA和DO.然而,较低的溶解氧不仅会抑制NOB,同时也会影响AOB的活性[14].有研究表明,当系统中存在其他的抑制因素时,即使在DO较高的情况下仍然能够维持亚硝化[15].因此,此时控制其他条件不变,将DO提高至2~3mg/L,并开始提高进水负荷,负荷提高期共历时72d,分为3个阶段逐渐提升至垃圾渗滤液原液,第一阶段(33~58d)进水NH4+-N浓度为550~600mg/L;第二阶段(59~80d)进水NH4+-N浓度为750~850mg/L;第三阶段(81~112d)为渗滤液原液,其进水NH4+-N浓度为950~1050mg/L.负荷提高期系统亚硝化性能如图3所示,可以看出,每次负荷的提高都会导致出水NH4+-N浓度升高,第一阶段初始时NH4+-N去除率由93.59%降至50.63%,第二阶段初始时NH4+-N去除率由92.53%降至66.47%,第三阶段初始时NH4+-N去除率由86.17%降至65.17%.这是因为一是每次负荷提高时系统中微生物生物量未相应升高,二是进水负荷提高使得系统中水质环境发生改变,从而影响系统中微生物活性,并且渗滤液中毒性物质浓度的升高也会对系统中微生物活性造成抑制.负荷提高后经过一段时间运行, NH4+-N出水逐渐降低,去除率逐渐升高,其原因为一是系统中微生物的增殖,处理负荷增强,二是微生物逐渐对负荷提高后水质的适应,活性有所提高. NO2--N出水浓度随着进水负荷的提高也呈先降低后升高的趋势,但是整体来看, NO2--N出水浓度随系统运行时间而逐步升高, NO2--N积累率在第45d时为90.18%,在运行至112d时,系统出水NO2--N浓度高达889mg/L, NO2--N积累率为97.23%;说明通过连续运行,系统中AOB大量富集,并且逐渐适应高负荷下的垃圾渗滤液.而尽管在负荷提高期将溶解氧提高至2~3mg/L,但是整个过程中并未见有NO3--N的大量积累,出水NO3--N基本维持在30~ 50mg/L的范围,说明该过程中DO不是NO2--N积累的关键因素.

图3 负荷提高阶段亚硝化运行性能Fig.3 Performance of nitritation during load increase stage

2.3 亚硝化过程中膜污染及污泥特性
一般通过过膜压力(TMP)来表征膜组件运行过程中的污染程度[16].在恒通量运行情况下,TMP会随着膜污染程度的加剧而升高.亚硝化过程中,共分为启动期和负荷提高期(图4),而负荷提高期又分为3阶段进行.不同运行阶段的TMP如图4所示,可以看出,随着垃圾渗滤液进水负荷的提高,膜污染速率逐渐加快,其原因为晚期垃圾渗滤液中含有较高浓度的有机物和金属离子等会加快膜污染速率,此外有研究表明,外界条件的改变会导致微生物释放大量的胞外聚合物(EPS)和溶解性微生物产物(SMP)[17],EPS和SMP的存在也会加快膜污染速率,说明本实验中垃圾渗滤液进水负荷的提高对膜污染的影响起一定作用.
图4同时也反映了系统中污泥浓度的变化,在亚硝化启动期,MLSS呈逐渐降低趋势,其原因是系统在启动前期进水为无机配水,通过限氧、高温及适宜pH值等条件的控制,系统逐渐向亚硝化转变,部分NOB裂解死亡;启动后期进入可生化性较差的晚期垃圾渗滤液,渗滤液中的毒性物质也会导致系统中微生物的死亡而分解.而进入负荷提高期后,系统中MLSS逐渐升高,其原因为一是经过启动后期微生物对垃圾渗滤液的适应驯化,其逐渐适应渗滤液的水质;二是渗滤液中微量的可降解有机物促进好氧异养菌的生长繁殖;三是AOB在系统中逐渐积累.

图4 亚硝化过程中TMP和MLSS的变化Fig.4 Evolution of TMP and MLSS during the operation phases
2.4 底物、产物和毒性物质对亚硝化的抑制及其动力学
实验所处理的废水为晚期垃圾渗滤液,具有高氨氮和有微生物毒性作用的特点,在通过MBR反应器亚硝化过程中会产生抑制作用,包括底物、产物及毒性物质的抑制作用.通过批试实验,对MBR反应器中亚硝化活性污泥进行不同抑制因子的抑制动力学测定并建立抑制动力学模型.
2.4.1 底物、产物和毒性物质的抑制 底物、产物和毒性物质对亚硝化的影响如表1所示,FA浓度在2.88~42.38mg/L,随着FA浓度的升高,氨氧化速率和NO2--N生成速率呈现出先升高后降低的趋势,而NO3--N生成速率则在逐渐降低.在FA浓度为11.75mg/L时,氨氧化速率为1.436g/ (g·d),而当FA浓度上升至42.38mg/L时,氨氧化速率降低至1.248mg/L,为最高时的86.88%; NO2--N生成速率和NO3--N生成速率分别降低至最高时的88.84%和53.97%.NH4+-N为硝化菌的底物,硝化细菌利用NH4+-N氧化成NO2--N和NO3--N,并从中获得其自身生长繁殖所需的能量. 高NH4+-N形成的FA可以抑制NOB的活性,从而致使AOB逐渐取代NOB成为优势菌群,从而实现亚硝化[18];然而过高的FA也会对AOB形成抑制,一般认为,FA对NOB的抑制作用强于AOB.Vadivelu等[19]的研究认为0.1~1mg/L的FA就会对NOB产生抑制,当FA达到6mg/L时几乎可完全抑制NOB的生长,而对AOB抑制范围一般在10~150mg/L[20].本实验中最高氨氧化速率和NO2--N生成速率时的FA浓度处于9.45~ 11.75mg/L,稍微高于Vadivelu等的研究;此外尽管FA浓度高达42.38mg/L,但是仍然有少量的NO3--N产生,并未完全抑制NOB的活性,这可能是由于实验中的活性污泥长期处于高NH4+-N水质条件下运行,从而对FA产生一定的适应性,此现象在Villaverde等[21]和Fux等[22]的研究中也有所体现.
AOB将NH4+-N氧化成NO2--N, NO2--N的存在以及大量的集聚会形成游离亚硝酸(FNA),而当FNA达到一定浓度时会对AOB和NOB都产生抑制作用.实验结果表明,FNA浓度在0.008~0.1036mg/L之间,随着FNA浓度的升高,氨氧化速率、NO2--N生成速率和NO3--N生成速率与FA呈现出相同的变化规律,当FNA为0.1036mg/L时,氨氧化速率、NO2--N生成速率和NO3--N生成速率分别降至最高时的84.14%、86.59%和54.23%. Vadivelu等的研究认为,当FNA浓度为0.011mg/L时,NOB的活性即受到抑制,而当FNA浓度为0.023mg/L时,NOB活性则被完全抑制;而FNA完全抑制AOB的浓度为0.4mg/L[23-25].本实验中FNA浓度小于AOB完全抑制浓度(0.40mg/L),在浓度为0.0317mg/L时,开始对AOB活性产生抑制;而在该范围内,也未见NOB活性被完全抑制,其原因也可能是其对FNA有一定的适应性.
垃圾渗滤液成分复杂,含有大量具有毒害作用的有机物、盐离子和重金属,这些因素均会对反应器中微生物产生抑制[26],从而影响亚硝化性能.垃圾渗滤液中毒性物质的浓度以COD计, 实验考察了其浓度在0~2667mg/L时的亚硝化情况,随着毒性物质浓度的升高,氨氧化速率、NO2--N生成速率和NO3--N生成速率都受到抑制,呈逐步降低的趋势,当COD为2667mg/L时,氨氧化速率、NO2--N生成速率和NO3--N生成速率分别降低至44.36%、45.12%和44.03%.
由表2可知,当COD为1600.2mg/L时,氨氧化速率为0.9848g/(g·d),与最大氨氧化速率相比下降了22.15%.同时相应条件下渗滤液中氨氮对应的FA为27.78mg/L,若以FA为单因子抑制,此时氨氧化速率为1.3432~1.3684mg/L之间,与最大氨氧化速率相比下降了4.74%~6.49%.假设NH4+-N完全转化成NO2--N,则相应条件下渗滤液中NO2--N对应的FNA为0.09638mg/L,若以FNA为单因子抑制,此时氨氧化速率为1.1875~ 1.2072mg/L之间,与最大氨氧化速率相比下降了14.46%~15.86%.通过对比发现,晚期垃圾渗滤液中的毒性物质对亚硝化的抑制作用强于FNA和FA.

表2 晚期垃圾渗滤液中COD与氨氮、FA和FNA对应关系Table 2 Corresponding relation of COD and NH4+-N, FA and FNA in the old landfill leachate
2.4.2 抑制动力学模型及分析 底物抑制动力学可采用Haldane模型[27-28]来进行描述,Haldane模型其方程为:

式中:ν为底物转化速率,g/(g·d);νmax为最大转化速率,g/(g·d);S为底物浓度, mg/L; kS为半饱和常数,mg/L;kh为Haldane抑制动力学常数, mg/L.
Aiba模型[29]最初是描述乙醇发酵产物抑制的模型,也有将其应用于硝化反应的基质抑制动力学模拟[30],并得出了较好的拟合相关度.其方程可以描述为:

式中:ν为底物转化速率,g/(g·d);νmax为最大底物转化速率,g/(g·d);S为基质浓度,mg/L; kS为半饱和常数,mg/L; ka为Aiba抑制动力学常数, mg/L.

表3 抑制动力学模型参数Table 3 Constants for inhibition kinetics model
毒性物质抑制的动力学模型引用乙酸降解时氯酚抑制作用的动力学模型[31],其方程如下:

式中:ν为底物转化速率,g/(g·d);νmax为最大底物转化速率,g/(g·d);S为基质浓度, mg/L;kS为半饱和速率常数,mg/L;k0和k1为抑制系数.
抑制系数k0和k1按以下公式计算:

式中:α为毒毒性物质浓度, mg/L;β为毒性物质完全抑制浓度, mg/L;m和n为常数.
通过引入速率比λ对上式进行经修正,得出反映毒性物质对基质转化速率的抑制方程为[32]:

其中λ= ν/ν0,λ为速率比;ν为毒性物质在各浓度下基质转化速率,g/(g·d);ν0为未投加毒性物质条件下基质转化速率,g/(g·d).该式可描述毒性物质浓度对基质转化速率的抑制作用,其中,β值越大说明需要更高浓度的毒性物质才能完全抑制微生物活性,其毒性越弱.当β值相近时,m和n值越大说明毒性物质的抑制作用越弱.用修正的抑制方程式(9)对实验结果进行拟合.
通过Origin8.0分别对表1中数据进行非线性拟合(图5),可得出底物、产物和毒性物质对亚硝化抑制的动力学方程.拟合曲线与实验数据的相关系数R2分别为0.9821、0.9961和0.9924,说明3个模型均可较好的描述本实验中各抑制因子对亚硝化的抑制动力学行为.其中,通过FA抑制动力学模型可得在FA单因子控制下的最大氨氧化速率为2.087g/(g·d),对FA的半饱和常数为3.185mg/L,Haldane抑制动力学常数为67.234mg/L;最大反应速率时的底物浓度可通过式(10)求得,为14.62mg/L.通过FNA抑制动力学模型可得在FNA单因子控制下的最大氨氧化速率为1.484g/(g·d), 对FNA的半饱和常数为0.001mg/L,Aiba抑制动力学常数为0.432mg/L.通过毒性物质抑制动力学模型可得在毒性物质控制下毒性物质完全抑制浓度为4054.02mg/L (以COD计),动力学常数m和n分别为2.19和2.32.
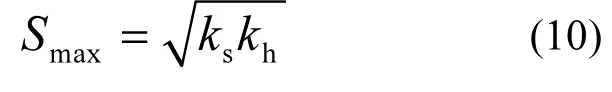

图5 亚硝化抑制动力学模型Fig.5 The inhibition kinetics model of nitritation a.底物抑制 b.产物抑制 c.毒性物质抑制
3 结论
3.1 通过控制DO为0.5~1mg/L,pH值为7.8~8.2和温度为(30±1)℃,在进水NH4+-N浓度为(280±20)mg/L时成功启动MBR的亚硝化工艺.后逐步升高进水负荷,并提高DO至2~3mg/L,逐渐实现MBR系统中以晚期垃圾渗滤液原液为进水的亚硝化,实现了垃圾渗滤液原液的亚硝化.
3.2 MBR亚硝化系统在运行过程中,微生物会受到底物、产物和垃圾渗滤液中的毒性物质的抑制,其中毒性物质对微生物的抑制作用强于底物和产物.当毒性物质浓度(以COD计)为1600.2mg/L时,氨氧化速率下降了22.15%,而相应条件下若以FA为单因子抑制时,氨氧化速率下降了4.74%~6.49%,若以FNA为单因子抑制时,氨氧化速率相比下降了14.46%~15.86%.
3.3 分别采用Haldane底物抑制模型、Aiba产物抑制模型以及修正后的毒性物质抑制模型对实验数据进行拟合,FA抑制的半饱和常数为3.185mg/L,抑制动力学常数为67.234mg/L;FNA抑制的半饱和常数为0.001mg/L,抑制动力学常数为0.432mg/L;毒性物质完全抑制浓度为4054.02mg/L (以COD计),动力学常数m和n分别为2.19和2.32.
参考文献:
[1] Michał B, E Ł Moysa, Marlena Z, et al. Removal of organic compounds from municipal landfill leachate in a membrane bioreactor [J]. Desalination, 2006,198:16-23.
[2] Farah N A, Christopher Q L. Treatment of landfill leachate using membrane bioreactors: A review [J]. Desalination, 2012,287: 41-54.
[3] Strous M, Heijnen J J, Kuenen J G, et al. The sequencing batch reactor as a powerful tool for the study of slowly growing anaerobic ammonium-oxidizing microorganisms [J]. Applied Microbiology and Biotechnology, 1998,50(5):589-596.
[4] Yuan X, Fenglin Y, Sitong L, et al. The influence of controlling factors on the start-up and operation for partial nitrification in membrane bioreactor [J]. Bioresource Technology, 2009,100: 1055-1060.
[5] Tadashi N, Hiroaki O, Yuko I, et al. Partial nitrification in a continuous pre-denitrification submerged membrane bioreactor and its nitrifying bacterial activity and community dynamics [J].Biochemical Engineering Journal, 2011,55:101-107.
[6] Anthonisen A C, Loehr R C, Prakasam T, et al. Inhibition of nitrification by ammonia and nitrous-Acid [J]. Journal Water Pollution Control Federation, 1976,48(5):835-852.
[7] Park S, Bae W. Modeling kinetics of ammonium oxidation and nitrite oxidation under simultaneous inhibition by free ammonia and free nitrous acid [J]. Process Biochemistry, 2009,44(6):631-640.
[8] Stuczynski T I, Mccarty G W, Siebielec G. Response of soil microbiological activities to cadmium, lead, and zinc salt amendments [J]. Journal of Environmental Quality, 2003,32(4): 1346-1355.
[9] Kargi F, Konya I. COD, para-chlorophenol and toxicity removal from para-chlorophenol containing synthetic waste water in an activated sludge unit [J]. Journal of Hazardous Materials, 2006, 132(2/3):226-231.
[10] van Dongen U, Jetten M S M, van Loosdrecht M C M. The SHARON-ANAMMOX process for treatment of ammonium rich wastewater [J]. Water Science and Technology, 2001,44:153-160.
[11] Anthonisen A C, Loehr R C, Prakasa m T B S, et al. Inhibition of nitrification by ammonia and nitrous acid [J]. Journal Water Pollution Control Federation, 1976,48(5):835-852.
[12] Bae W, Baek S C, Chung J W, et al. Nitrite accumulation in batch reactor under various operational conditions [J]. Biodegradation, 2002,12:359-366.
[13] Wang J L, Yang N. Partial nitrification under limited dissolved oxygen conditions [J]. Process Biochemistry, 2004,39:1223-1229.
[14] Naki K, Wantawin C, Ohgaki S. Nitrification at low levels of dissolved oxygen with and without organic loading in a suspendedgrowth reactor [J]. Water Research, 1990,24(3):297-302.
[15] 张功良,李 冬,张肖静,等.低温低氨氮SBR短程硝化稳定性试验研究 [J]. 中国环境科学, 2014,34(3):610-616.
[16] Kumar S M, Madhu G M, Roy S. Fouling behaviour, regeneration options and on-line control of biomass-based power plant effluents using microporous ceramic membranes [J]. Separation and Purification Technology, 2007,57(1):25-36.
[17] Meng F G, Yang F L, Shi B Q, et al. A comprehensive study on membrane fouling in submerged membrane bioreactors operated under different aeration intensities [J]. Separation and Purification Technology, 2008,59(1):91-100.
[18] Welander U, Henrysson T, Welander T. Biological nitrogen removal from municipal landfill leachate in a pilot scale suspended carrier biofilm process [J]. Water Research, 1998,32: 1564-1570.
[19] Vadivelu V M, Keller J, Yuan Zhiguo. Effect of free ammonia on the respiration and growth processes of an enriched Nitrobacter culture [J]. Water Research, 2007,41(4):826-834.
[20] Yun H J, Kim D J. Nitrite accumulation characteristics of high strength ammonia wastewater in an autotrophic nitrifying biofilm reactor [J]. Journal of Chemical Technology and Biotechnology, 2003,78(4):377-383.
[21] Villaverde S, Fdz-Polanco F, Garcia P A. Nitrifying biofilm acclimation to free ammonia in submerged biofilters. Start-up influence [J]. Water Research, 2000,34(2):602-610.
[22] Fux C, Huang D, Monti A, et al. Difficulties in maintaining long-term partial nitritation of ammonium-rich sludge digester liquids in a moving-bed biofilm reactor (MBBR) [J]. Water Science and Technology, 2004,49(11/12):53-60.
[23] Vadivelu V M, Yuan Z G, Fux C, et al. The inhibitory effects of free nitrous acid on the energy generation and growth processes of an enriched Nitrobacter culture [J]. Environmental Science & Technology, 2006,40(14):4442-4448.
[24] Vadivelu V M, Yuan Z G, Fux C, et al. Stoichiometric and kinetic characterisation of Nitrobacter in mixed culture by decoupling the growth and energy generation processes [J]. Biotechnology and Bioengineering, 2006,94(6):1176-1188.
[25] Vadivelu V M, Keller J, Yuan Z G. Effect of free ammonia and free nitrous acid concentration on the anabolic and catabolic processes of an enriched Nitrosomonas culture [J]. Biotechnology and Bioengineering, 2006,95(5):830-839.
[26] Mosquera-Corral A, Gonzlez F, Campos J L, et al. 2005. Partial nitrification in a SHARON reactor in the presence of salts and organic carbon compounds [J]. Process Biochemistry, 2005,40: 3109-3188.
[27] Sheintuch M, Tartakovsky B, Narkis N, et al. Substrate inhibition and multiple states in a continuous nitrification process [J]. Water Research, 1995,29:953-963.
[28] Surmacz-Gorska J, Gernaey K, Demuynck C, et al. Nitrification monitoring in activated sludge by oxygen uptake rate (OUR) [J]. Water Research, 1996,30:1228-1236.
[29] Aiba S, Shoda M, Nagatani M. Kinetics of product inhibition in alcohol fermentation [J]. Biotechnology and Bioengineering, 1968,10:845-864.
[30] 金仁村,阳广凤,马 春,等.逆流湍动床短程硝化反应器的运行性能及基质抑制动力学模型 [J]. 环境科学, 2011,32(1):217-224.
[31] Kim I S, Tabak H H, Young J C. Modeling of the fate and effect of chlorinated phenols in anaerobic treatment processes [J]. Water Science and Technology, 1997,36(6/7):287-294.
[32] 陈 皓,陈 玲,黄爱群,等.重金属对2-氯酚厌氧降解的抑制动力学研究 [J]. 中国环境科学, 2010,30(3):328-332.
Performance of nitritation process in membrane bioreactor for old landfill leachate and analysis of inhibition kinetics.
LI Yun1, XIONG Xiang-yang2, LI Jun1*, CHEN Gang2, ZHANG Mei-xue1, ZHANG Yan-zhuo1, YAO Yuan2, LI>Qiang2(1.College of Architecture and Civil Engineering, Beijing University of Technology, Beijing 1000124, China;2.China Urban Construction Design and Research Institute Corporation Limited, Beijing 100012, China). China Environmental Science, 2016,36(2):419~427
Abstract:The performance of nitritation were investigated in continuous flow MBR fed with old landfill leachate, the inhibition of substrate, product and toxicant on nitritation process and the inhibition kinetics were analyzed. The results show that: the nitritation process was started up in MBR which controlled the NH4+-N concentration of inflow was (280±20)mg/L, the DO was 0.5~1.0mg/L, pH was 7.8~8.2 and temperature was (30±1)℃; and at 32d, the nitrite accumulation rate was 84.27%. Influent load was increase gradually and improved the DO to 2~3mg/L in the next period, nitritation process was realized gradually in MBR system which the inflow was the old landfill leachate completely, the ρ (NO2--N) of effluent from system was 889mg/L and the nitrite accumulation rate was 97.23% at 112d. The inhibition experiments of substrate, product and toxicant showed that, the inhibition of toxicant surpass substrate and product, when the concentration of toxicant (calculated by COD) was 1600.2mg/L, the ammonia oxidation rate declined by 22.15%, and if inhibition factor was FA only in corresponding conditions, ammonia oxidation rate decreased by 4.74%~6.49%, and if inhibition factor was FNA only in corresponding conditions, ammonia oxidation rate decreased by 14.46%~15.86%. Haldane model, Aiba model and the revised toxicant inhibiting model were adopted for nonlinear fitting on the experimental data respectively, the correlation coefficient R2were 0.9821, 0.9961 and 0.9924 respectively, and the inhibition kinetics models of substrate, product and toxicant were obtained.
Key words:old landfill leachate;membrane bioreactor (MBR);nitritation;inhibition kinetics
作者简介:李 芸(1985-),男,江西宜春人,北京工业大学博士研究生,主要研究方向为污水处理理论与技术.发表论文2篇.
基金项目:国家水体污染控制与治理科技重大专项(2014ZX07201-011);中国城市建设研究院院级课题(Y07H13074)
收稿日期:2015-08-02
中图分类号:X703.5
文献标识码:A
文章编号:1000-6923(2016)02-0419-09
