金针菇多糖-Zn2+螯合物对L929肿瘤细胞的增殖抑制作用及其抗氧化活性
2016-04-15赵姝雯陈贵堂胡秋辉赵立艳南京农业大学食品科技学院江苏南京0095中国药科大学工学院江苏南京0009南京财经大学食品科学与工程学院江苏南京0046
赵姝雯,夏 宇,陈贵堂,胡秋辉,3,赵立艳,*(.南京农业大学食品科技学院,江苏 南京 0095;.中国药科大学工学院,江苏 南京 0009;3.南京财经大学食品科学与工程学院,江苏 南京 0046)
金针菇多糖-Zn2+螯合物对L929肿瘤细胞的增殖抑制作用及其抗氧化活性
赵姝雯1,夏 宇1,陈贵堂2,胡秋辉1,3,赵立艳1,*
(1.南京农业大学食品科技学院,江苏 南京 210095;2.中国药科大学工学院,江苏 南京 210009;3.南京财经大学食品科学与工程学院,江苏 南京 210046)
摘 要:比较研究金针菇多糖-Zn2+螯合前后的抗肿瘤作用与其体外抗氧化活性。通过小鼠成纤维肉瘤细胞L929培养实验,观察不同质量浓度金针菇多糖溶液对体外培养L929细胞形态的影响,四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)实验评价金针菇多糖对L929细胞生长和增殖的影响。结果表明:在质量浓度为5~50 μg/mL时,金针菇粗多糖及其纯化组分对L929细胞的抑制作用不强烈,金针菇多糖-Zn2+对L929细胞有较强的抑制作用。相比较金针菇多糖直接作用于L929细胞,金针菇多糖介导的RAW 264.7巨噬细胞上清液对L929细胞的抑制率作用显著增强。同时,以对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、超氧阴离子自由基(O2-•)、羟自由基(•OH)、H2O2的清除率为评价指标,体外抗氧化实验结果显示金针菇多糖-Zn2+抗氧化活性较螯合Zn2+前有所提高。即金针菇多糖中Zn含量的提高有助于提升其抗氧化活性。
关键词:金针菇多糖;螯合;Zn2+;L929细胞;抗氧化活性
引文格式:
赵姝雯,夏宇,陈贵堂,等.金针菇多糖-Zn2+螯合物对L929肿瘤细胞的增殖抑制作用及其抗氧化活性[J].食品科学,2016,37(5):202-207.DOI:10.7506/spkx1002-6630-201605036.http://www.spkx.net.cn
ZHAO Shuwen,XIA Yu,CHEN Guitang,et al.Effect of Flammulina velutipes polysaccharide-Zn2+chelate on suppression of L929 tumor cell proliferation and its antioxidant activity[J].Food Science,2016,37(5):202-207.(in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201605036.http://www.spkx.net.cn
金针菇多糖(Flammulina velutipes polysaccharide,FVP)是一种以葡聚糖为主,由数个多糖组分构成的混合多糖。研究表明,FVP对肝脏损伤有保护作用,对小鼠肿瘤S180、H22、L615及人乳腺癌细胞MDA-MB-231均有明显的抑制作用[1-2]。锌(Zn)是人体必需的微量元素之一,对生物的生长发育、免疫功能等均具有重要作用。由于其具有重要的生物学功能,关于Zn的形态分析、富Zn食品的开发及其生物活性等方面的研究越来越多[3-4]。目前的补Zn产品中多为无机Zn,摄入过多对人体有一定的毒害作用,且无机Zn不利于人体吸收。无机Zn通过生物转化作用可转化为低毒的有机Zn。由于有机Zn更接近于Zn在体内的作用形式从而易于被人体吸收,其生物学效价要高于无机Zn[5]。在生物体内,Zn主要是和多糖等大分子物质结合生成较为稳定的配合物质。与其他的营养物不同,Zn不能储留在人体内,也不能在身体中合成,只能从外界摄入[6]。交界离子如Fe2+、Co2+、Ni2+、Cu2+、Zn2+、Pb2+对硬软配体都有一定亲和性,能分别与软硬离子竞争配体形成络合物[7]。近年来,Zn2+与壳聚糖、黑木耳多糖及金针菇多糖的螯合工艺已有研究报道[8-10],但是关于其与金针菇多糖螯合产物的体内、体外活性尚未有深入研究。
同时,目前有关多糖抗氧化的研究比较多[11-14],而对金针菇纯化多糖与Zn螯合前后体外抗氧化活性比较、分析的研究相对较少。本实验通过考察金针菇多糖与Zn螯合前后的抗肿瘤效果以及金针菇多糖介导的巨噬细胞上清液对L929细胞的抑制作用,以期进一步了解其活性特点,为金针菇锌多糖功能性产品的开发提供理论依据。
1 材料与方法
1.1材料与试剂
金针菇购于众彩农副产品批发市场有限公司;L929小鼠成纤维肉瘤细胞、RAW 264.7巨噬细胞由中国科学院上海生命科学研究院细胞资源中心提供。
RMPI 1640培养基、胎牛血清、胰酶、DMEM培养基 美国Gibco公司;正丁醇、氯仿、硝酸、无水乙醇、丙酮、乙醚、硫酸、苯酚、氯化铁、邻苯三酚、盐酸、硫酸亚铁、H2O2、水杨酸、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、铁氰化钾、三羟甲基氨基甲烷(Tris)、二甲基亚砜(dimethyl sulfoxide,DMSO)等均为国产分析纯。各种溶液配制均使用超纯水。
1.2仪器与设备
HH-6数显恒温水浴锅 国华电器有限公司;TDL-5-A离心机 上海安亭科学仪器厂;旋转蒸发仪 上海爱朗仪器有限公司;2.5L冷冻干燥机 英国Labconco公司;MQX 200型酶标仪 美国Bio-Tek公司。
1.3方法
1.3.1金针菇多糖分离纯化及螯合
新鲜金针菇经晾晒至半干后,放在电热恒温鼓风干燥箱中,60 ℃鼓风烘干,然后用粉碎机将其粉碎,过60 目筛,制得金针菇粉,置于4 ℃条件下备用。
以水提法得到多糖提取液,Sevag试剂去蛋白质,取其离心后的上清液合并旋蒸至50~100 mL。醇沉后进行冻干得到初步分离纯化的金针菇粗多糖(简称FVPc)[15]。
FVPc通过DEAE Cellulose-52离子层析柱分离纯化及Sephadex G-100凝胶色谱分离纯化得到纯化的金针菇多糖(简称FVPp)[16]。
取0.6 g ZnSO4·7H2O溶于100 mL超纯水中,配成Zn2+质量浓度为6 mg/mL的溶液,按FVPp与Zn2+的质量比为5∶1加入多糖;30 ℃、150 r/min振荡螯合8 h,醇沉后冻干得到金针菇多糖-Zn2+螯合物(简称Zn-FVP)[17],按照下式计算螯合率。
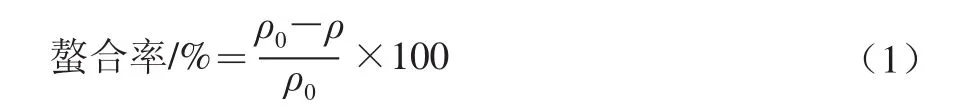
式中:ρ0为螯合前溶液中Zn2+的质量浓度/(mg/mL);ρ为螯合后溶液中Zn2+的质量浓度/(mg/mL)。
1.3.23种金针菇多糖对L929细胞增殖的抑制作用
将L929细胞密度调整为2×104个/mL,在96 孔板中按照每孔100 μL接种细胞悬液。置于含5% CO2、37 ℃培养箱中培养24 h,使细胞贴壁生长。吸去上清液,分别加入不同质量浓度(5、12.5、25、50 μg/mL)的样品溶液(FVPc、FVPp、Zn-FVP)100 μL和顺铂溶液(阳性对照组,5 μg/mL)100 μL,继续在培养箱中培养24 h后,每孔加入5 mg/mL的四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)溶液10 μL,继续培养4 h,吸去上清液,后加入DMSO 100 μL振荡,培养箱培养10 min。用酶标仪在490 nm波长处测定各孔的吸光度[18],按照下式计算L929细胞存活率。

式中:Ak为样品组或阳性对照组的吸光度;A1为阴性对照组(不加多糖样品)的吸光度;A0为空白组的吸光度。
1.3.33种金针菇多糖介导的RAW 264.7巨噬细胞上清液对L929细胞的增殖抑制作用
将RAW 264.7细胞密度调整为2×105个/mL,在96 孔板中按照每孔100 μL接种细胞悬液。置于含5% CO2、37 ℃培养箱中培养24 h,使细胞贴壁生长。吸去上清液,分别加入不同质量浓度(5、12.5、25、50 μg/mL)的样品溶液(FVPc、FVPp、Zn-FVP)100 μL,继续在培养箱中培养24 h。收集上清液,-20 ℃保存。
将L929细胞密度调整为2×104个/mL,在96 孔板中按照每孔100 μL接种细胞悬液。置于含5% CO2、37 ℃培养箱中培养24 h,使细胞贴壁生长。吸去上清液,分别加入上述以不同质量浓度(5、12.5、25、50 μg/mL)的样品溶液(FVPc、FVPp、Zn-FVP)培养的RAW 264.7细胞上清液和顺铂溶液(5 μg/mL)100 μL,继续在培养箱中培养24 h。每孔加入5 mg/mL的MTT溶液10 μL,继续培养4 h,吸去上清液,加入DMSO 100 μL振荡,培养箱培养10 min。用酶标仪在490 nm波长处测定各孔的吸光度[19],按照公式(2)计算L929细胞存活率。
1.3.43种金针菇多糖对L929细胞形态的影响
将L929细胞密度调整为2×104个/mL,在6 孔板中按照每孔3 mL接种细胞悬液。置于含5% CO2、37 ℃培养箱中培养24 h,使细胞贴壁生长。吸去上清液,分别加入不同质量浓度(100、200 μg/mL)的样品溶液(FVPc、FVPp、Zn-FVP)3 mL,继续在培养箱中培养24 h。使用倒置显微镜观察不同质量浓度的样品溶液对L929细胞形态的影响。
1.3.5金针菇多糖对DPPH自由基清除能力的测定
分别取不同质量浓度(0、0.2、0.4、0.6、0.8、1.0 mg/mL)的样品溶液(FVPc、FVPp、Zn-FVP)1 mL到试管中,加入0.4 mL 0.2 mmol/L DPPH-甲醇溶液和1.6 mL去离子水,混合均匀在30 ℃反应30 min后,用分光光度计在517 nm波长处测定吸光度As。同时测定不加DPPH的样品空白吸光度A1、加DPPH但不加样品(以体积分数80%甲醇或蒸馏水代替样品)的吸光度A0;用1 mL不同质量浓度的VC溶液代替样品溶液作为阳性对照组,测定其对DPPH自由基的清除能力[20-22]。实验设置3 组平行,结果取平均值。按照下式计算3 种金针菇多糖对DPPH自由基的清除率。
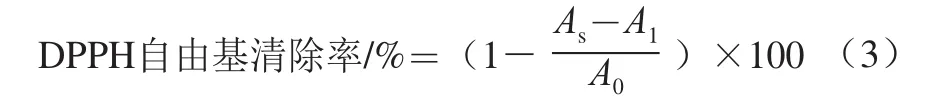
1.3.6金针菇多糖对超氧阴离子自由基(O2-•)清除能力的测定
取不同质量浓度(0、0.2、0.4、0.6、0.8、1.0 mg/mL)的样品溶液(FVPc、FVPp、Zn-FVP)1 mL于试管中,加入0.05 mol/L的Tris-HCl(pH 8.2)溶液3 mL,各管用蒸馏水补齐到7 mL,在30 ℃条件下水浴15 min,最后加入由10 mmol/L HCl配制的8 mmol/L邻苯三酚溶液1 mL,混合均匀后反应6 min,立即加入2 滴8 mol/L的HCl终止反应,用分光光度计在325 nm波长处测定吸光度。用蒸馏水代替样品溶液作为空白对照组,用1 mL不同质量浓度的VC溶液代替样品溶液作为阳性对照[23-25]。实验设置3 组平行,结果取平均值。按照下式计算3 种金针菇多糖对O2-•的清除率。

式中:A0为空白对照组的吸光度;A1为样品或阳性对照组的吸光度。
1.3.7金针菇多糖对羟自由基(•OH)清除能力的测定取不同质量浓度(0、0.2、0.4、0.6、0.8、1.0 mg/mL)的样品溶液(FVPc、FVPp、Zn-FVP)2 mL于试管中,分别加入6 mmol/L的FeSO4溶液2 mL、6 mmol/L H2O2溶液2 mL,混合均匀,静置10 min,再加6 mmol/L水杨酸溶液2 mL,摇匀后静置30 min,用分光光度计在510 nm波长处测定吸光度。以蒸馏水代替样品溶液作为空白对照组,以1 mL不同质量浓度的VC溶液代替样品溶液作为阳性对照组[26]。实验设置3 组平行,结果取平均值。按照下式计算3 种金针菇多糖对•OH的清除率。
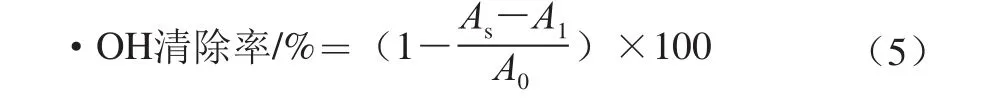
式中:A0为空白对照组的吸光度;AS为样品或阳性组的吸光度;A1为样品干扰实验(以蒸馏水代替水杨酸)组的吸光度。
1.3.8金针菇多糖对H2O2清除能力的测定
取不同质量浓度(0、0.2、0.4、0.6、0.8、1.0 mg/mL)的样品溶液(FVPc、FVPp、Zn-FVP)1 mL于试管中,分别加入2.8 mL 0.1 mmol/L的磷酸盐缓冲液(pH 4)和0.6 mL 40 mmol/L的H2O2溶液,混合物在30 ℃条件下反应10 min,之后用分光光度计在230 nm波长处测定吸光度。以蒸馏水代替样品溶液作为空白对照组;以1 mL不同质量浓度的VC溶液代替样品溶液作为阳性对照[27-28]。实验设置3 组平行,结果取平均值,按照下式计算3 种金针菇多糖对H2O2的清除率。
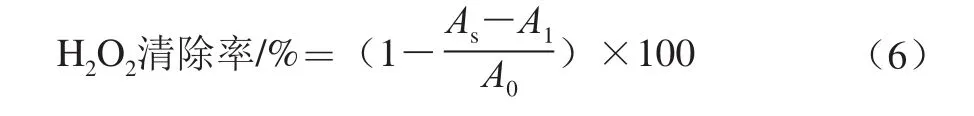
式中:A0为空白对照组的吸光度;As为样品或阳性对照组的吸光度;A1为样品干扰实验组(以蒸馏水代替H2O2)的吸光度。
2 结果与分析
2.1Zn-FVP螯合物的制备结果
Zn2+的初始质量浓度为6mg/mL,FVPp与Zn2+的质量比为5∶1、鳌合时间为8 h时,FVPp与Zn2+的螯合率达到97.28%,Zn-FVP中的Zn含量为175 mg/g。
2.2FVPc、FVPp、Zn-FVP对L929细胞增殖的抑制作用
分别测定MTT实验中在FVPc、FVPp、Zn-FVP的4 个质量浓度梯度(5、12.5、25、50 μg/mL)处理下细胞A490 nm的变化,确定其对L929细胞存活率的影响。由图1可知,FVPc、FVPp对L929细胞有微弱的促增殖效果,且这种促增殖效果随着3 种金针菇多糖质量浓度的增加而下降,且下降趋势不明显。在5~50 μg/mL之间,Zn-FVP 对L929细胞有抑制增殖的作用,在5~25 μg/mL范围内,L929细胞存活率下降较明显,在25~50 μg/mL时L929细胞存活率下降趋势平缓。当质量浓度为50 μg/mL时,Zn-FVPp使L929细胞存活率下降至17.33%。

图1 3 种金针菇多糖对L929细胞增殖的抑制作用Fig.1 Inhibitory effect of Flammulina velutipes polysaccharides on the growth of L929 cells
2.3FVPc、FVPp、Zn-FVP介导的RAW 264.7巨噬细胞上清液对L929细胞的增殖抑制作用
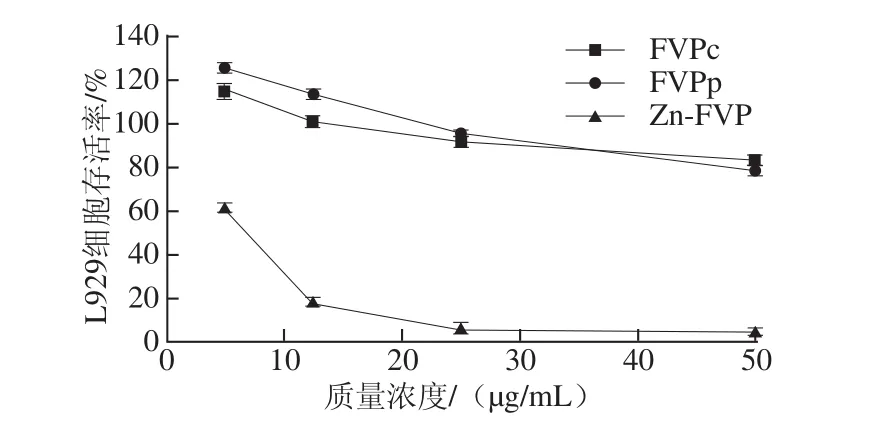
图2 3 种金针菇多糖介导的RAW 264.7巨噬细胞上清液对L929细胞的增殖抑制作用Fig.2 RAW 264.7 macrophage-mediated anti-tumor activity of Flammulina velutipes polysaccharides
分别测定MTT实验中4 个质量浓度梯度(5、12.5、25、50 μg/mL)介导的RAW 264.7巨噬细胞上清液处理下细胞A490 nm的变化,确定3 种金针菇多糖介导的RAW 264.7巨噬细胞上清液对L929细胞存活率的影响。由图2可知,在低质量浓度时,FVPc、FVPp对L929细胞有微弱的促进增殖效果,但这种促增殖效果随着3 种金针菇多糖质量浓度的增加而下降,当FVPc、FVPp质量浓度超过25 μg/mL时,RAW 264.7巨噬细胞上清液对细胞产生抑制作用。Zn-FVP在5~50 μg/mL范围内对L929细胞有抑制增殖的作用,在5~25 μg/mL范围内,L929细胞存活率下降较明显,在25~50 μg/mL时,L929细胞存活率下降趋势平缓。当质量浓度为50 μg/mL时,3 种金针菇多糖介导的RAW 264.7巨噬细胞上清液使L929细胞的存活率分别下降至83.52%、78.37%、3.97%,与3 种金针菇多糖直接作用于L929细胞相比,抑制率分别增强了27.35%、20.79%、77.07%。
据文献[29]报道,当归多糖对小鼠腹腔巨噬细胞释放细胞效应分子的诱导作用对癌细胞没有直接杀伤作用,而是通过调节免疫功能对癌细胞的增殖产生抑制作用。本实验使用3 种金针菇多糖刺激RAW 264.7巨噬细胞的上清液培养成纤维肉瘤细胞L929,检测其是否会对L929的增殖产生更大的抑制效果,结果表明3 种金针菇多糖介导的RAW 264.7巨噬细胞上清液对L929细胞有更强的抑制效果。这可能是因为L929细胞对于肿瘤坏死因子(tumor necrosis factor,TNF)更敏感,金针菇多糖可促进RAW 264.7巨噬细胞释放TNF-α等细胞效应分子,从而间接发挥抗肿瘤免疫作用。
2.4FVPc、FVPp、Zn-FVP对L929细胞形态的影响

图3 3 种金针菇多糖对L929细胞形态的影响Fig.3 Morphological change of L929 cells in the presence of Flammulina velutipes polysaccharides
为了直观地显示出不同质量浓度金针菇多糖对L929细胞形态的影响,本实验选取了较高质量浓度(100、200 μg/mL)的金针菇多糖提取液。如图3所示,在显微镜下观察细胞形态,100、200 μg/mL的FVPc、FVPp处理组的L929细胞多为长梭形和多角形,细胞密度随着多糖质量浓度增加而下降,100、200 μg/mL组的细胞形态基本相同。但100、200 μg/mL的Zn-FVP处理组的L929细胞数目均显著减少,细胞核缩小,悬浮细胞增多,基本不贴壁,细胞收缩为圆形,绝大部分细胞死亡。
2.5FVPp、Zn-FVP对DPPH自由基的清除能力
由于FVPc与FVPp的自由基清除效果大致相当,因此后续实验只选用FVPp与Zn-FVP进行对比分析。如图4所示,螯合Zn2+前后,FVP均有清除DPPH自由基的能力,但都弱于阳性对照组VC。各组DPPH自由基清除能力均随质量浓度增加逐渐增大,在一定质量浓度范围内,金针菇多糖的DPPH自由基清除率与质量浓度成正相关。在1.0 mg/mL时,VC、FVPp、Zn-FVP对DPPH自由基的清除率分别为84.11%、42.63%、52.10%。FVPp与Zn-FVP可以终止自由基链式反应,与DPPH自由基反应生成更稳定的产物。

图4 金针菇多糖对DPPH自由基的清除率Fig.4 DPPH radical scavenging efficiency of Flammulina velutipes polysaccharides
2.6FVPp、Zn-FVP对O2-•的清除能力
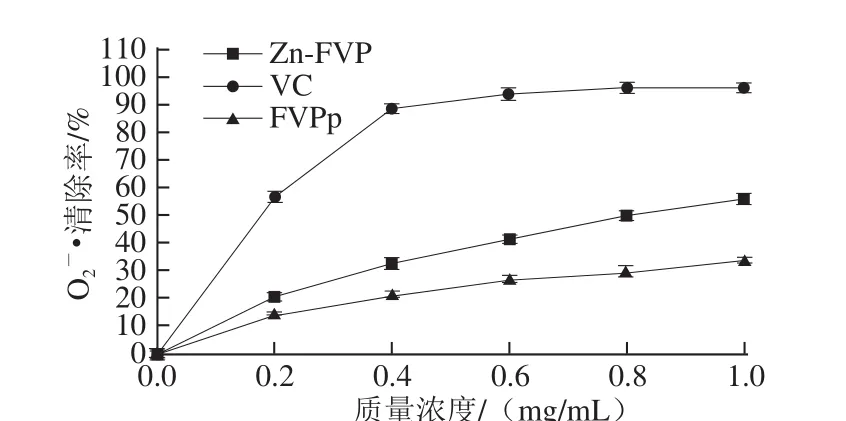
图5 金针菇多糖对OO2-·的清除率Fig.5 Superoxide anion radical scavenging efficiency of Flammulina velutipes polysaccharide
O2-•是生物体内最重要的自由基之一。如图5所示,各组O2-•清除能力随着质量浓度的增加而逐渐增大。在同等质量浓度条件下,O2-•清除能力由强到弱排序为
VC>Zn-FVP>FVPp。数据统计分析结果表明,FVPp、
Zn-FVP的O2-•清除能力在α=0.05水平上差异显著。在质量浓度为1.0 mg/mL时,与FVPp相比,Zn-FVP的O2-•清除率提高了20%。
2.7FVPp、Zn-FVP对•OH的清除能力

图6 金针菇多糖对·OH的清除率Fig.6 Hydroxyl radical scavenging efficiency of Flammulina velutipes polysaccharide
采用Fenton体系产生•OH,水杨酸法检测样品清除•OH的能力。如图6所示,各组•OH清除能力随着质量浓度的增加而逐渐增大。FVPp与Zn-FVP的•OH清除能力均弱于VC,Zn-FVP略强于FVPp。这可能是由于Zn能够阻断金属离子如Fe3+、Cu2+与H2O2和超氧化物反应产生•OH,防止在金属离子的作用过程中形成羟基基团,进而阻止了因金属离子的催化生成的•OH对机体组织产生的破坏作用[30]。数据统计分析结果表明,FVPp与Zn-FVP的•OH清除能力在α=0.05水平上差异显著。
2.8FVPp、Zn-FVP对H2O2的清除能力
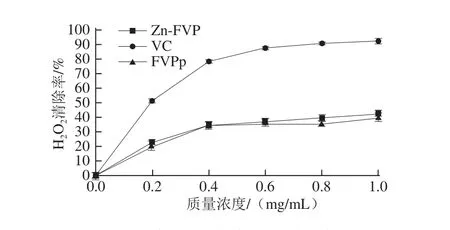
图7 金针菇多糖对HH2O2的清除率Fig.7 Hydrogen peroxide scavenging efficiency of Flammulina velutipes polysaccharide
如图7所示,各组的H2O2清除能力随着质量浓度的增加而逐渐增大。在金针菇多糖同等质量浓度条件下,对H2O2的清除能力由强到弱排序为VC>Zn-FVP>FVPp。
FVPp与Zn-FVP 的H2O2清除率在α=0.05水平上差异不显著。在质量浓度为1.0 mg/mL时,VC、FVPp与Zn-FVP的H2O2清除率分别为92.73%、39.59%、42.73%。含有Zn的猪苓多糖比不含Zn的猪苓多糖体外抗氧化能力高[31],这与本实验的结论相一致,说明Zn含量较高有利于提高多糖对H2O2的清除能力,引起这一现象的原因可能是Zn2+与多糖分子结构中产生自由基所必需的醇羟基络合在一起,使自由基的产生被抑制。
3 结 论
本实验结果显示,FVP螯合Zn2+后,其对DPPH自由基、O2-•、•OH、H2O2的清除率均有所提高。通过几组成分抗氧化活性能力的检测与其Zn含量的对比,可以初步得出多糖体外抗氧化活性与样品中Zn含量密切相关的结论。Zn2+质量浓度越大,Zn含量越高,多糖清除自由基的能力越强,抗氧化活性越高[32]。金针菇多糖与Zn2+的螯合增强了多糖的抗氧化活性。
本实验通过小鼠成纤维肉瘤细胞L929培养实验发现,FVPc及其纯化组分FVPp在质量浓度为5~50 μg/mL时对L929细胞的抑制率不大,FVPc对L929细胞无抑制作用,FVPp有微弱的抑制作用,在质量浓度为50 μg/mL时,L929细胞存活率为98.93%。Zn-FVP对L929细胞有较强的抑制作用,在质量浓度为50 μg/mL时,L929细胞存活率为17.33%。而以FVPc、其纯化组分FVPp及其螯合后的Zn-FVP培养RAW 264.7巨噬细胞,其上清液对L929细胞抑制率有显著提高。FVPc、FVPp、Zn-FVP在质量浓度为50 μg/mL时,L929细胞存活率分别为83.52%、78.37%、3.97%,与3 种金针菇多糖直接作用于L929细胞相比,抑制率分别增强了27.35%、20.79%、77.07%。金针菇多糖介导的RAW 264.7巨噬细胞上清液对L929细胞的抑制率明显提升。多糖抗肿瘤的机理可能是通过活化巨噬细胞和淋巴细胞、促进细胞因子分泌或活化补体等从而间接性发挥抗肿瘤免疫作用,但还需要进一步的实验来证明金针菇多糖介导的RAW 264.7巨噬细胞上清液对L929细胞产生抑制作用的机理。
Zn-FVP表现出了良好的抗氧化活性与抗肿瘤细胞增殖作用,这为Zn-FVP产品的进一步开发利用提供了科学依据,它有望成为一种有效的保健药物。
参考文献:
[1]苗立成,王立强,吴迪.金针菇多糖对小鼠抗肿瘤及抗白血病效应的实验研究[J].解放军药学学报,2003,19(3):171-173.
[2]ZHAO L Y,DONG Y H,CHEN G T,et al.Extraction,purification,characterization and antitumor activity of polysaccharides from Ganoderma lucidum[J].Carbohydrate Polymers,2010,80(3):783-789.DOI:10.1016/j.carbpol.2009.12.029.
[3]李素婷,朱蕴兰,张城,等.蛹虫草胞内锌多糖对丝裂霉素诱发蚕豆根尖细胞微核的影响[J].食品工业科技,2011,32(10):146-152.DOI:10.13386/j.issn1002-0306.2011.10.010.
[4]SIBIKINA O V,IOZEP A A,MOSKVIN A V.Polysaccharide complexes with metal cations:structure and application[J].Pharmaceutical Chemistry Journal,2009,43(6):341-345.DOI:10.1007/s11094-009-0292-1.
[5]常巧玲,孙建义.锌的生物学功能及有机锌的应用研究[J].中国动物保健,2005(9):46-48.DOI:10.3969/j.issn.1008-4754.2005.09.020.
[6]MARET W,SANDSTEAD H H.Zinc requirements and the risks and benefits of zinc supplementation[J].Journal of TraceElements in Medicine and Biology,2006,20(1):3-18.DOI:10.1016/j.jtemb.2006.01.006.
[7]彭红云,杨肖娥.金属有机配体分析方法及金属组学研究[J].分析化学,2006,34(8):1190-1196.DOI:10.3321/j.issn:0253-3820.2006.08.035.
[8]黄晓佳,王爱勤.壳聚糖对Zn2+的吸附性能研究[J].离子交换与吸附,2000,16(1):60-65.
[9]李公斌,王振宇.黑木耳多糖与Zn(Ⅱ)螯合物的制备工艺及红外光谱分析[J].东北林业大学学报,2006,34(3):65-66; 89.DOI:10.3969/j.issn.1000-5382.2006.03.026.
[10]贺菊萍,卢玲.金针菇多糖螯合微量元素锌的研究[J].食品工业科技,2011,32(12):301-303.
[11]KOZARSKI M,KLAUS A,NIKŠIĆ M,et al.Antioxidative activities and chemical characterization of polysaccharide extracts from the widely used mushrooms Ganoderma applanatum,Ganoderma lucidum,Lentinus edodes and Trametes versicolor[J].Journal of Food Composition and Analysis,2012,26(1):144-153.DOI:10.1016/j.jfca.2012.02.004.
[12]CHEN Y,ZHANG H,WANG Y X,et al.Acetylation and carboxymethylation of the polysaccharide from Ganoderma atrum and their antioxidant and immunomodulating activities[J].Food Chemistry,2014,156:279-288.DOI:10.1016/j.foodchem.2014.01.111.
[13]ZENG W C,ZHANG Z,JIA L R.Antioxidant activity and characterization of antioxidant polysaccharides from pine needle(Cedrus deodara)[J].Carbohydrate Polymers,2014,108:58-64.DOI:10.1016/j.carbpol.2014.03.022.
[14]JIANG L F.Cellulase-assisted extraction and antioxidant activity of polysaccharides from Rhizoma imperata[J].Carbohydrate Polymers,2014,108:99-102.DOI:10.1016/j.carbpol.2014.03.020.
[15]蒋海明,张秀华.金针菇多糖提取最佳工艺探讨研究[J].安徽农业科学,2011,39(11):6524-6528.DOI:10.13989/j.cnki.0517-6611.2011.11.042.
[16]杨文建.金针菇多糖的分离纯化、结构分析及其记忆功能改善作用机制研究[D].南京:南京农业大学,2012:23-25.
[17]马利华,秦卫东,陈学红,等.金针菇多糖-Fe(Ⅱ)螯合物的制备及抗氧化活性[J].食品科学,2010,31(20):202-207.
[18]安巍巍,薛莲,王敏伟,等.去甲斑蝥素诱导小鼠肺纤维瘤L929细胞凋亡[J].中国癌症杂志,2005,15(1):24-27.DOI:10.3969/j.issn.0517-6611.2011.11.089.
[19]傅亚欣.金针菇菌柄基部多糖的提取、纯化及细胞免疫活性研究[D].南京:南京农业大学,2012:48-56.
[20]张连富,王莲芳,窦春霞,等.富硒食用菌多糖的体外抗氧化研究[J].天然产物研究与开发,2007,19(6):1044-1047.DOI:10.3969/j.issn.1001-6880.2007.06.031.
[21]ZHAO L Y,CHEN G T,ZHAO G H,et al.Optimization of microwaveassisted extraction of astaxanthin from Haematococcus pluvialis by response surface methodology and antioxidant activities of the extracts[J].Separation Science and Technology,2009,44(1):243-262.DOI:10.1080/01496390802282321.
[22]ZHANG A Q,LI X Q,XING C,et al.Antioxidant activity of polysaccharide extracted from Pleurotus eryngii using response surface methodology[J].International Journal of Biological Macromolecules,2014,65:28-32.
[23]李正鹏,吴萍,孙玉军,等.树舌胞外富锌多糖体外抗氧化活性研究[J].热带作物杂志,2012,33(5):890-893.DOI:10.3969/j.issn.1000-2561.2012.05.021.
[24]ISFAHLAN A J,MAHMOODZADEH A,HASSANZADEH A,et al.Antioxidant and antiradical activities of phenolic extracts from Iranian almond(Prunus amygdalus L.)hulls and shells[J].Turkish Journal of Biology,2010,34(2):165-173.DOI:10.3906/biy-0807-21.
[25]GANG J,FANG Y T,WANG Z,et al.Fermentation optimization and antioxidant activities of mycelia polysaccharides from Morchella esculenta using soybean residues[J].African Journal of Biotechnology,2013,12(11):1239-1249.DOI:10.5897/AJB12.1883.
[26]李华为,赵素云,铁梅,等.富硒金针菇对羟自由基的清除作用[J].食品科学,2010,31(17):18-21.
[27]茹巧美,真明,郑海雷.忽地笑多糖的体外抗氧化和抑菌活性研究[J].中药材,2008,31(10):1536-1540.DOI:10.13863/j.issn1001-4454.2008.10.032.
[28]KESER S,CELIK S,TURKOGLU S,et al.Hydrogen peroxide radical scavenging and total antioxidant activity of hawthorn[J].Chemistry Journal,2012,2(1):9-12.
[29]杨兴斌,梅其炳,周四元,等.当归多糖对小鼠腹腔巨噬细胞释放细胞效应分子的诱导作用[J].细胞与分子免疫学杂志,2004,20(6):747-749.DOI:10.3321/j.issn:1007-8738.2004.06.032.
[30]李大刚,王宏,周桂莲.微量元素锌的抗氧化作用研究[J].饲料研究,2008(11):38-41.DOI:10.13557/j.cnki.issn1002-2813.2008.11.010.
[31]李志洲.猪苓多糖的提取及其锌配合物抗氧化性研究[J].食品研究与开发,2011,32(2):45-50.DOI:10.3969/j.issn.1005-6521.2011.02.013.
[32]张建军.姬菇SS-01胞外多糖及胞内锌多糖的提取和抗氧化活性[D].泰安:山东农业大学,2012:47-50.
Effect of Flammulina velutipes Polysaccharide-Zn2+Chelate on Suppression of L929 Tumor Cell Proliferation and Its Antioxidant Activity
ZHAO Shuwen1,XIA Yu1,CHEN Guitang2,HU Qiuhui1,3,ZHAO Liyan1,*
(1.College of Food Science and Technology,Nanjing Agricultural University,Nanjing 210095,China; 2.College of Engineering,China Pharmaceutical University,Nanjing 210009,China; 3.College of Food Science and Engineering,Nanjing University of Finance and Economics,Nanjing 210046,China)
Abstract:The antitumor effect and antioxidant activity of purified polysaccharide from Flammulina velutipes before and after chelation with Zn2+were evaluated.To investigate the antitumor effect of the polysaccharide-Zn2+chelate on the proliferation of L929 tumor cells,methlthiazolyl tetrazolium(MTT)experiments were carried out and the morphology of L929 cells was observed with different concentrations of polysaccharide.The results showed that crude and purified polysaccharide at concentrations of 5–50 μg/mL had little impact on the growth of L929 cells,while the polysaccharide-Zn2+chelate played an important role in the inhibition of cell growth.Furthermore,the supernatant of macrophages co-cultured with Flammulina velutipes polysaccharides could kill L929 cells.Moreover,the antioxidant activity was improved after the chelation with Zn2+.This study demonstrated that zinc chelation could enhance the antioxidant activity of purified polysaccharide from Flammulina velutipes.
Key words:Flammulina velutipes polysaccharide; chelation; Zn2+; L929 cell; antioxidant activity
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2016)05-0202-06
DOI:10.7506/spkx1002-6630-201605036
*通信作者:赵立艳(1977—),女,副教授,博士,研究方向为食品营养化学。E-mail:zhlychen@njau.edu.cn
作者简介:赵姝雯(1991—),女,硕士研究生,研究方向为食品营养化学。E-mail:2013108035@njau.edu.cn
基金项目:国家现代农业(食用菌)产业技术体系建设专项(CARS-24);国家自然科学基金青年科学基金项目(31101255)
收稿日期:2015-09-11
