芒柄花黄素对结直肠癌细胞增殖、凋亡的影响及机制探讨
2016-04-15李通黎欣高枫黄家豪甘嘉亮
李通,黎欣,高枫,黄家豪,甘嘉亮
(广西医科大学第一附属医院,南宁530021)
·论著·
芒柄花黄素对结直肠癌细胞增殖、凋亡的影响及机制探讨
李通,黎欣,高枫,黄家豪,甘嘉亮
(广西医科大学第一附属医院,南宁530021)
摘要:目的观察芒柄花黄素对结直肠癌细胞增殖、凋亡的影响,并探讨其机制。方法将结直肠癌细胞HCT116随机分为两组,观察组分别以25、50、100 μmol/L芒柄花黄素处理,对照组以等量二甲基亚砜处理;用MTT法检测细胞增殖情况(A490),Hoechst荧光染色法计数凋亡细胞,qRT-PCR法检测细胞中的HOC转录反义RNA(HOTAIR),Western blot法检测细胞中的Bax和Bcl-2。结果与对照组比较,观察组随着芒柄花黄素浓度增加及处理时间延长HCT116细胞A490值降低(P均<0.05);观察组以25、50、100 μmol/L芒柄花黄素处理48 h后HCT116细胞凋亡数分别为(3.20±0.84)、(20.20±1.92)、(31.00±2.92)个/HP,均高于对照组的(1.6±1.14) 个/HP(P均<0.01);与对照组比较,观察组细胞HOTAIR、Bcl-2表达量降低,而Bax表达量增加,P均<0.05。结论芒柄花黄素可能通过抑制HOTAIR调节Bax和Bcl-2的表达,从而抑制结直肠癌细胞的生长并诱导细胞凋亡。
关键词:结直肠癌;芒柄花黄素;HOC转录反义RNA;Bax蛋白;Bcl-2蛋白;细胞增殖;细胞凋亡
结直肠癌(CRC)的发生、发展是多个基因和多种因素综合调控的结果。HOX转录反义RNA(HOTAIR)是第一个被发现具有反式转录调控作用的长链非编码RNA,其在CRC组织中高表达,并能促进CRC细胞侵袭和转移[1]。虽然CRC靶向癌基因治疗的效果显著,但不良反应强,价格昂贵,应用范围受限。因此,寻找一种作用于癌基因杀死肿瘤细胞的低毒、廉价新药尤为重要。芒柄花黄素是传统中药红三叶草的有效成分,近年研究发现其能有效抑制多种肿瘤细胞的增殖并诱导其凋亡[2~4]。2105年4~11月,我们观察了不同浓度芒柄花黄素对CRC细胞HCT116增殖、凋亡的影响,并检测细胞HOTAIR及Bax、Bcl-2蛋白表达变化,探讨芒柄花黄素的抗肿瘤作用及潜在机制。现报告如下。
1材料与方法
1.1主要材料与试剂HCT116细胞株购自上海细胞生物研究所,芒柄花黄素(>99.0%)、噻唑蓝(MTT)和荧光染料Hoechst33258购自美国Sigma公司;DMEM高糖培养基购自中国维森特生物技术有限公司,胎牛血清购自澳大利亚Excellbio公司,RNA提取试剂盒购自美国Invitrogen公司,RNA逆转录试剂盒购自美国Thermo Scientific 公司;GAPDH、Bax及Bcl-2兔抗人多克隆抗体购自美国Cell Signaling Technology公司。
1.2细胞培养将HCT116细胞置于含1%青霉素/链霉素和10%胎牛血清的高糖DMEM培养基,于37 ℃ 5% CO2的培养箱中常规培养。
1.3细胞增殖情况观察采用MTT法。取对数生长期的HCT116细胞,以4×103/孔接种96孔板,终体积为200 μL/孔。培养24 h待细胞贴壁后,将细胞分为两组;观察组以含25、50、100 μmol/L芒柄花黄素的培养基培养,对照组以含0.1%二甲基亚砜(DMSO)的培养基培养,每个浓度5个复孔。分别于培养24、48、72 h后加入MTT 溶液,37 ℃细胞培养箱中放置4 h;移除孔内液体后加入DMSO,用酶标仪检测各孔吸光值(A490),以此表示细胞增殖情况。实验独立重复3次,取均值。
1.4细胞凋亡情况观察采用Hoechst荧光染色法。将对数生长期的HCT116细胞接种至放置好盖玻片的 6 孔板中。培养12 h细胞贴壁后分组及处理同1.3,继续培养 48 h。吸尽培养液,加入多聚甲醛固定10 min,再加入Hoechst33258 染色液避光孵育10 min;荧光显微镜下(200×)观察细胞核变化,统计细胞凋亡个数。实验重复3次,取均值。
1.5细胞HOTAIR检测收集1.4培养48 h的两组细胞,用RNA提取试剂盒提取HCT116细胞总RNA,采用核酸检测仪测总RNA的含量和纯度,分别将1 μg总RNA逆转录为cDNA。用HOTAIR基因特异性引物进行实时定量聚合酶链式反应(qRT-PCR),按说明书操作。HOTAIR引物序列:上游为5′-GGTAGAAAAAG-CAACCACGAAGC-3′,下游为5′-ACATAAACCTCTGTCT-GTGAGTGCC-3′;β-actin引物序列:上游为5′-GCACCACACCTTCTACAATGAGC-3′,下游为5′-GGATAGCACAGCCTGGATAGCAAC-3′。反应步骤:50 ℃ 2 min,95℃ 10 min, 95 ℃ 15 s,60 ℃ 1 min,共40个循环。以2-ΔΔCT表示HOTAIR相对表达量。
1.6细胞Bax及Bcl-2蛋白检测采用Western blot法。收集1.4培养48 h的两组细胞,加裂解液裂解细胞并提取细胞总蛋白,核酸检测仪检测样品蛋白浓度。以每孔100 μg蛋白上样,浓缩胶电泳电压为60 V,分离胶为120 V,电泳3 h。用聚偏二氟乙烯膜转膜,以含5%脱脂奶粉的PBS封闭1 h;分别加Bax、Bcl-2抗体和GAPDH 4 ℃过夜,抗体稀释度均为1∶1 000。以Tris-PBS溶液洗膜5 min×3次,室温避光孵育荧光二抗(1∶10 000) 1 h;用Tris-PBS溶液洗膜5 min×5次,用双色红外荧光扫描成像系统扫膜。以目的蛋白与GAPDH条带的光密度比值表示目的蛋白相对表达量。

2结果
2.1芒柄花黄素对HCT116细胞增殖能力的影响两组细胞增殖能力比较见表1。

表1 两组细胞增殖能力比较±s)
注:与对照组同时点比较,*P<0.05;与同浓度上一时点比较,#P<0.05;与同时点上一浓度比较,△P<0.05。
2.2芒柄花黄素对HCT116细胞凋亡的影响观察组以25、50、100 μmol/L芒柄花黄素处理48 h后HCT116细胞凋亡数分别为(3.20±0.84)、(20.20±1.92)、(31.00±2.92)个/HP,均高于对照组的(1.6±1.14) 个/HP(P均<0.01)。
2.3芒柄花黄素对HCT116细胞HOTAIR、Bax、Bcl-2表达的影响两组HOTAIR、Bax、Bcl-2表达比较见表2。
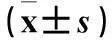
表2 两组HOTAIR、Bax、Bcl-2表达比较
注:与对照组比较,*P<0.05,#P<0.01。
3讨论
芒柄花黄素是一种活性异黄酮,其分子结构类似雌二醇,可通过雌激素受体(ER)发挥作用[5]。ER主要分为ERα和ERβ,结肠上皮细胞中主要表达ERβ[6]。ERβ介导的信号通路参与雌激素依赖性肿瘤的发生、发展,而CRC是一种雌激素依赖性肿瘤,雌激素替代疗法能明显降低绝经后妇女CRC发病率[7,8]。研究发现,CRC组织中ERβ表达降低,且ERβ表达量与CRC肿瘤大小、分期和预后呈负相关[9]。在CRC细胞中过表达ERβ后细胞增殖受到抑制,细胞周期阻滞在G1期[10]。又有研究发现,异黄酮可上调CRC细胞ERβ表达,通过多个信号通路抑制癌细胞的增殖和侵袭能力[11]。本研究显示,芒柄花黄素能明显抑制HCT116细胞的增殖能力,并诱导其凋亡。
HOTAIR是一种长链非编码RNA,研究发现其与CRC、乳腺癌、肝癌等的发生、发展密切相关,并可作为相关肿瘤诊断和预后判断的重要标志物[12]。CRC患者的肿瘤和血液中HOTAIR显著高表达,其水平与肝转移和不良预后密切相关[13]。在CRC中HOTAIR结合于多硫蛋白抑制复合体2(PRC2),并介导其抑制相关抑癌基因的表达,从而促进肿瘤的发生和转移[14]。沉默CRC细胞中的HOTAIR后能抑制细胞的侵袭和增殖能力,并增强细胞对放疗的敏感性[15]。本研究结果显示,芒柄花黄素作用于HCT116细胞后,其HOTAIR表达水平呈剂量依赖性下降。这提示芒柄花黄素可能通过ERβ介导的HOTAIR信号通路抑制细胞的增殖能力。细胞凋亡是由基因控制的细胞程序性死亡,它主要包括线粒体和内质网两条凋亡通路,而线粒体通路是控制凋亡的主要通路。Bcl-2和Bax是调控线粒体凋亡通路的关键凋亡蛋白。Bcl-2是抗凋亡基因,能促进肿瘤细胞增殖;Bax蛋白却可抑制Bcl-2的活性,并促进细胞凋亡。研究显示,在头颈部鳞状细胞癌中沉默HOTAIR能够抑制癌细胞增殖并诱导癌细胞凋亡,并证实线粒体凋亡通路Bax/Bcl-2参与到这一HOTAIR相关的凋亡过程中。我们的数据显示,芒柄花黄素能够升高Bax表达,同时抑制Bcl-2表达从而诱导HCT116细胞凋亡。
综上所述,芒柄花黄素能抑制CRC细胞增殖并诱导其凋亡,这一过程可能由HOTAIR/Bax/Bcl-2信号通路介导,为芒柄花黄素用于CRC的临床治疗提供了理论依据。
参考文献:
[1] Wu ZH, Wang XL, Tang HM, et al. Long non-coding RNA HOTAIR is a powerful predictor of metastasis and poor prognosis and is associated with epithelial-mesenchymal transition in colon cancer[J]. Oncol Rep, 2014,32(1):395-402.
[2] Yang Y, Zhao Y, Ai X, et al. Formononetin suppresses the proliferation of human non-small cell lung cancer through induction of cell cycle arrest and apoptosis[J]. Int J Clin Exp Pathol, 2014,7(12):8453-8461.
[3] Jin YM, Xu TM, Zhao YH, et al. In vitro and in vivo anti-cancer activity of formononetin on human cervical cancer cell line HeLa[J]. Tumour Biol, 2014,35(3):2279-2284.
[4] Li T, Zhao X, Mo Z, et al. Formononetin promotes cell cycle arrest via downregulation of Akt/Cyclin D1/CDK4 in human prostate cancer cells[J]. Cell Physiol Biochem, 2014,34(4):1351-1358.
[5] 叶雨,陈建.芒柄花黄素对超氧阴离子及羟自由基清除作用的研究[J].四川生理科学杂志,2012,3(2):53-55.
[6] Wang Y, Xing T, Huang L, et al. Period 1 and estrogen receptor-beta are downregulated in Chinese colon cancers[J]. Int J Clin Exp Pathol, 2015,8(7):8178-8188.
[7] Johnson JR, Lacey JV, Lazovich D, et al. Menopausal hormone therapy and risk of colorectal cancer[J]. Cancer Epidemiol Biomarkers Prev, 2009,18(1):196-203.
[8] Rudolph A, Toth C, Hoffmeister M, et al. Colorectal cancer risk associated with hormone use varies by expression of estrogen receptor-beta[J]. Cancer Res, 2013,73(11):3306-3315.
[9] Rudolph A, Toth C, Hoffmeister M, et al. Expression of estrogen receptor beta and prognosis of colorectal cancer[J]. Br J Cancer, 2012,107(5):831-839.
[10] Jassam N, Bell SM, Speirs V, et al. Loss of expression of estrogen receptor beta in colon cancer and its association with Dukes′ staging[J]. Oncol Rep, 2005,14(1):17-21.
[11] Pampaloni B, Palmini G, Mavilia C, et al. In vitro effects of polyphenols on colorectal cancer cells[J]. World J Gastroint Oncol, 2014,6(8):289-300.
[12] 曹林平,吴建,郑树森.长链非编码RNA HOTAIR在肿瘤中的研究进展[J].中国医药科学,2013,3(13):28-31.
[13] Svoboda M, Slyskova J, Schneiderova M, et al. HOTAIR long non-coding RNA is a negative prognostic factor not only in primary tumors, but also in the blood of colorectal cancer patients[J]. Carcinogenesis, 2014,35(7):1510-1515.
[14] Gupta RA, Shah N, Wang KC, et al. Long non-coding RNA HOTAIR reprograms chromatin state to promote cancer metastasis[J]. Nature, 2010,464(7291):1071-1076.
[15] Yang XD, Xu HT, Xu XH, et al. Knockdown of long non-coding RNA HOTAIR inhibits proliferation and invasiveness and improves radio sensitivity in colorectal cancer[J]. Oncol Rep, 2015,35(1):478-487.
Effects of formononetin on proliferation and apoptosis of colorectal cancer cells and its mechanism
LITong,LIXin,GAOFeng,HUANGJiahao,GANJialiang
(TheFirstAffiliatedHospitalofGuangxiMedicalUniversity,Nanning530021,China)
Abstract:ObjectiveTo observe the effects of formononetin on the proliferation and apoptosis of colorectal cancer cells in vitro and to study the underlying mechanism. MethodsThe colorectal cancer cells HCT116 were randomly divided into two groups: the observation group and the control group. Cells in the observation group were treated with 25 μmol/L, 50 μmol/L and 100 μmol/L formononetin, and the control group was treated with the same amount of dimethyl sulfoxide. The proliferation (A490) of HCT116 cells measured by MTT assay, the apoptosis was assessed with Hoechst 33258 staining, the expression level of HOC transcription antisense RNA (HOTAIR) was quantified by qRT-PCR, and the expression level of Bax protein and Bcl-2 protein was determined by Western blotting. Results Compared with the control group, the A490values of the HCT116 cells constantly decreased along with the increased doses and prolonged time in the observation group (all P<0.05). The numbers of apoptosis cells in the observation group treated with 25 μmol/L, 50 μmol/L and 100 μmol/L formononetin after 48 h were respectively (3.20±0.84), (20.20±1.92) and (31.00±2.92)/ HP, which were all higher than that[(1.6±1.14)/HP]of the control group (all P<0.01). Compared with the control group, the expression of Bcl-2 protein and HOTAIR was significantly decreased, but the expression of Bcl-2 protein was significantly increased in the observation group (all P<0.05). ConclusionFormononetin may inhibit the growth and induce the apoptosis of colorectal cancer cells by inhibiting HOTAIR to regulate the expression of Bcl-2 and Bax protein.
Key words:colorectal carcinoma; formononetin; HOC transcription antisense RNA; Bax protein; Bcl-2 protein; cell proliferation; apoptosis
(收稿日期:2015-12-10)
中图分类号:R735.3
文献标志码:A
文章编号:1002-266X(2016)10-0001-03
doi:10.3969/j.issn.1002-266X.2016.10.001
通信作者简介:甘嘉亮(1972-),男,主任医师,硕士研究生导师,主要研究方向为结直肠癌的基础与临床。E-mail: gjl259@126.com
作者简介:第一李通(1990-),男,硕士研究生,主要研究方向为结直肠癌的基础和临床。E-mail: leetongmail989@163.com
基金项目:广西自然科学基金面上项目(2013GXNSFAA019153);广西高校科学技术研究项目(2013ZD015)。
