dGFP-GUS基因标记新疆棉花黄萎病原菌的研究
2016-04-13孔德真华东来王秀珍刘步仓祝建波王爱英
孔德真,华东来,王秀珍,刘步仓,祝建波,王爱英
(新疆石河子大学生命科学学院,新疆石河子 832000)
dGFP-GUS基因标记新疆棉花黄萎病原菌的研究
孔德真,华东来,王秀珍,刘步仓,祝建波,王爱英
(新疆石河子大学生命科学学院,新疆石河子 832000)
【目的】研究棉花黄萎病原菌的入侵机理。【方法】以带有潮霉素抗性筛选基因的PUCCATPH载体以及pCAMBIA1304载体作为骨架,构建trpc启动子驱动的GFP-GUS基因的新疆棉花黄萎病菌表达载体1304-P-ORF,导入农杆菌GV3101和AGL-1中。通过农杆菌介导(ATMT)法分别转入新疆棉花黄萎病原菌VD-1和VD-278中,对表达效果进行检测。【结果】筛选的潮霉素B浓度为30 μg/mL,农杆菌AGL-1对黄萎病菌的转化效率比GV3101高40%。T0代经含有潮霉素B的PDA培养基筛选,获得了T1代转基因大丽轮枝菌VD-12株,VD-2 784株。通过GUS组织染色,在转基因VD-1和VD-278的菌丝和孢子中均可观察到GUS基因的表达。对转基因黄萎菌进行PCR分子检测,均可检测到GFP和潮霉素B基因。GUS-GFP和潮霉素B基因已成功转入新疆棉花黄萎菌VD-1和VD-278中。【结论】建立了新疆棉花黄萎菌的遗传转化体系,为进一步利用GFP-GUS基因研究新疆棉花黄萎菌对棉花侵染的过程奠定基础。
trpc启动子;农杆菌介导转化;GFP-GUS;棉花黄萎病菌
0 引 言
【研究意义】棉花黄萎病是由大丽轮枝菌(Verticilliumdahliae)引起的一种真菌性维管束系统病害[1]。当生长正常的植物被大丽轮枝菌侵染后,在植物木质部的导管系统中大量繁殖,使植物水分运输蒸腾阻力增大,从而减少植物叶片组织中水分供应,进而使植物的光和速率和蒸腾速率减慢[2]。机械障碍和毒素作用现在已经被认为是黄萎病菌致病的两个主要原因。但是在毒素作用中黄萎病菌产生的多糖蛋白是主要的萎蔫毒素,毒素通过刺激植物微管周围的薄壁细胞,从而使植物细胞产生大量的代谢物,造成了植物正常代谢系统紊乱,最终导致了棉花植株的死亡[3]。虽然这两种观点已经有很多试验证据证明了黄萎病菌的致病机理,但黄萎病菌如何侵入植物体,并且在植物体内怎样繁殖和生长还不清楚,所以需要引入一种观察和事实检测定的方法,揭示棉花黄萎病菌和棉花之间的互作。 【前人研究进展】GFP和GUS基因作为两种最为常用的报告基因,已经成功用于目的基因的表达定位,活细胞蛋白的定量观察和动力学研究等方面[4-5]。Andrie等[6]和Vallad等[7]利用sGFP基因,分别在马铃薯和莴苣中分离的大丽轮枝菌菌株中成功标记了绿色荧光,依赖菌体上的绿色荧光,对病原菌侵染的不同阶段进行了观察。【本研究切入点】由于黄萎病菌对植物的侵染是通过微管进行扩展的,致病力不同的黄萎病菌对植物的侵染过程是不同的,为了研究致病力不同黄萎病在植物中侵染过程,构建了含有明显标记的真菌表达载体,通过标记来研究病菌的侵染过程。报告基因dGFP-GUS是由植物表达载体pCAMBIA1304载体携带的融合表达基因,通过对植物表达载体的改造,去除了植物表达载体,在报告基因上游加入了黄萎病菌识别的,在黄萎病菌中启动报告基因,并且连有启动子和潮霉素B的开放阅读框,构建含有dGFP-GUS的真菌表达载体,通过点击转化法转入农杆菌AGL-1中。通过农杆菌介导的转化方法,转化已从乌苏地区分离的落叶型和非落叶型黄萎病菌Vd-1和Vd-278,得到已经转化成功的黄萎病菌,通过GUS组织染色,得到已经转化成功的黄萎病菌。【拟解决的关键问题】为研究大丽轮枝菌侵染棉花过程的组织学和致病机理研究奠定基础。
1 材料与方法
1.1 材 料
1.1.1 菌株、质粒及试剂
农杆菌GV3101、AGL-1,大丽轮枝菌菌株VD-1和VD-278均由新疆乌苏地区棉区分离获得,采用鉴定棉花大丽轮枝菌特异引物zhu-1/zhu-2(5’-CATCAGTCTCTCTGTTTATACCAACG-3’/5’-CGATGCGAGCTGTAACTACTACGCAA-3’),大丽轮枝菌落叶型和非落叶型引物D-1/D-2(5’-CATGTTGCTCTGTTGACTGG-3’/5’-GACACGGTATCTTTGCTGAA-3’)和ND-1/ ND-2(5’-CAGGGGATACTGGTACGAGACG-3’/5’-ATGAGTATTGCCGATAAGAACA-3’)引物进行PCR鉴定,鉴定结果为非落叶型大丽轮枝菌。质粒PUCCATPH由河北农业大学李继刚教授馈赠,植物表达载体pCAMBIA1304由石河子大学农业生物技术重点实验室保存,在研究中构建载体所需要的分子试剂均购自TaKaRa(Japan)公司;引物合成和序列的测定由北京华大基因公司完成。
1.1.2 基本培养基和培养条件
大肠杆菌用LB培养,37℃,200 r/min 振荡培养过夜。农杆菌用LB常规培养基培养,200 r/min、28℃,振荡培养 2 d。基本培养基 MM[8]和诱导培养基 IM[9]用于农杆菌的遗传转化培养。大丽轮枝菌用CM[10]和 Czapek 培养基的培养,25℃,150 r/min培养4~7 d。抗生素卡那霉素(Km)、利福平(Rif)和氨噻肟头孢霉素(Cef)用量为 100 μg/mL;潮霉素(hyg)用量为30 μg/mL。
1.2 方 法
1.2.1 含有trpc启动子潮霉素B开放阅读框和trpe启动子的克隆与鉴定
在以质粒DNA PUCCATPH为模板,克隆含有潮霉素 B的反应体系如下:1 μL质粒DNA,5 μL 10×TaqDNA聚合酶Buffer,4 μL dNTP,上游引物ORF-F(5’-CGAGCTCGGTCGACAGAAGATGATATTGAA-3’)和下游引物 ORF-R (5’-CAAGCTTGCAGGGGCTGGTGACGGAATTTT-3’)各1 μL(虚线标注部分为SacⅠ和HindⅢ酶切位点),TaqDNA聚合酶 1 μL,ddH2O补齐,总体积为50 μL,PCR反应程序为:94℃预变性5 min,进入循环94℃变性30 s,63℃退火45 s,72℃延伸2 min,30个循环,72℃终延伸7 min;启动子的克隆按照上述程序反应,trpc启动子上游引物Ptrpc-F(5’-CAAGCTTGGTCGACAGAAGATGATATTGAA-3’)和下游引物(5’-CCCATGGGGATCGAGGCTTGGGTAGAATAG-3’),虚线标注部分为HindⅢ和NocⅠ酶切位点。PCR反应结束后,在1%的琼脂糖凝胶电泳中对目的片段进行检测,切下目的条带,采用琼脂糖凝胶回收试剂盒对目的片段纯化回收,将目的片段连接到pMD19-T载体上,连接产物转化于DH5α感受态细胞中,利用蓝白斑筛选的方法挑选阳性菌落获得的重组质粒命名为构建成pMD19-T:ORF和pMD19-T:Ptrpc。
1.2.2 含有Ptrpc启动子和潮霉素B抗性的表达载体的构建
测序正确的质粒pMD19-T:ORF和PMD19-T:trpc,分别采用SacⅠ和HindⅢ、HindⅢ和NocⅠ酶切回收ORF和Ptrpc。将pCAMBIA1304-35S-GFP-GUS-OCS载体用HindⅢ和NocⅠ双酶切后回收质粒大片段,将回收质粒的大片段和回收的启动子小片段经T4连接酶相互连接后,连接产物转化于DH5α感受态细胞,通过抗生素筛选和酶切鉴定,成功构建载体Ptrpc-GFP-GUS-OCS。然后将Ptrpc-GFP-GUS-OCS载体用SacⅠ和HindⅢ双酶切回收质粒大片段,将回收的载体大片段和回收的小片段经T4DNA连接酶相互连接后,转化大肠杆菌感受态细胞,通过抗生素筛选和酶切鉴定,构建棉花黄萎菌表达载体:1304-P-ORF。
1.2.3 潮霉素B对野生型大丽轮枝菌的抑制测定
将野生型棉花黄萎病菌VD-1和VD-278活化,接种于PDA培养基上,在25℃下培养8 d,采用0.5 cm的打孔器,打取菌饼接种在浓度为0、10、20、30、40、50、70、100 μg/mL的潮霉素B的PDA培养基上,每个培养皿中放置3个,在25℃下培养8 d,每个浓度重复3次,进行观察记录。
1.2.4 棉花黄萎病菌的纯化和培养
将棉花黄萎病菌株VD-1和VD-278接在PDA平板培养基上,在25℃、暗培养10 d后,采用微生物单孢分离的方法对两株菌进行纯化培养。
1.2.5 不同农杆菌对新疆棉花黄萎病菌转化效率的影响
构建真菌表达载体1304-P-ORF后,将表达载体采用电击转化法转入两种农杆菌GV3101和AGL-1中,用于棉花黄萎病菌的遗传转化,农杆菌介导转化真菌的方法参照kang等[11]和Mullins 等[12]方法进行,在两种菌转化共培养时选用的介质为微孔滤膜(上海新亚水溶性微孔滤膜0.45 μm)。在25℃共培养5 d后,在滤膜的表面长出具有潮霉素B抗性的白色菌落,将白色菌落挑取,转接到含有相同浓度潮霉素B的PDA平板上进行纯化培养。分别记录这两种农杆菌获得的新疆棉花黄萎病菌阳性转化子的个数。
1.2.6 PCR鉴定转化阳性的黄萎病菌
转基因菌株的DNA提取[13],以提取的转基因菌株的DNA为模板,对GFP和潮霉素基因进行检测,GFP所用的正向引物(5'-GACAAACAAAAGAATGGAATCA-3')反义引物:(5'-TCAAGAAGGACCATGTGG-3');PCR扩增潮霉素B检测引物的900序列进行分子验证,所用的正向引物(5’-GCAGACAGGAACGAGGACAT-3’)反义引物(5’-GCTCCATACAAGCCAACCAC-3’)。
1.2.7 转基因棉花黄萎病菌GUS组织化学检测
挑取少许继代4~5次长势良好的转基因黄萎病菌菌块放于Eppendorf管中,加入一定量的GUS染色液,使染色的菌落组织快完全浸没在液体中,在37℃下保温染色4~5 h后,在显微镜下观察染色结果。选取呈现蓝色较深的菌株继续培养。
2 结果与分析
2.1 含有trpc启动子潮霉素B开放阅读框和trpc启动子的克隆与真菌表达载体的构建
根据质粒PUCCATP报导的基因序列,通过TaqDNA聚合酶扩增trpc启动子和开放阅读框ORF基因。经克隆测序后分析表明,克隆得到的启动子和开放阅读框的大小和核苷酸序列与原载体上的一致,全长为480 bp和2 000 bp。首先把trpc启动子连接到植物表达载体pCAMBIA1304-35S-OCS上。经过转化、PCR鉴定和连接载体的双酶切后,经电泳检测得到了与预测大小相同的目的条带。然后把连接开放阅读框ORF的质粒和已连接启动子的质粒,采用双酶切后连接,转化大肠杆菌,挑选10个克隆经过夜摇菌提取质粒双酶切后,经琼脂糖凝胶电泳检测获得预期大小的目的片段。表明成功地构建了真菌表达载体1304-P-ORF。该载体在真菌中的筛选标记基因为潮霉素B,是含有构巢曲霉 trpc启动子,章鱼碱合成酶基OCS基因作为终止子。将质粒1 304-P-ORF转入农杆菌GV3101和GAL-1对转化的菌落通过PCR鉴定,证明目的基因已转入。扩繁菌落,用于以下后续试验的遗传转化。图1~3

M:DNA markerⅢ;1:阳性对照;2、3:质粒酶切

M:DNA marker 5K;6:阳性对照;1-5:质粒酶切
2.2 潮霉素对黄萎病菌菌落生长速度的影响
将直径0.5 cm的黄萎病菌菌饼接种于8种不同的潮霉素浓度的PDA培养基中(3次重复),在25℃的恒温箱中培养8 d后,测定每个浓度下的菌落直径。研究表明,随着培养基中潮霉素B的浓度逐渐升高,菌落的生长速率逐渐减小。当潮霉素B的浓度达到30 μg/mL时,菌落停止生长,在这个浓度下两种棉花黄萎病菌的生长完全受到了抑制。表1
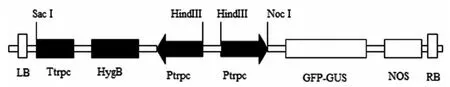
图3 1304-P-ORF载体构建示意
表1 不同潮霉素浓度对黄萎菌病菌落生长抑制情况
Table 1 The inhibitory effect of differentverticillumdahliacolony growth under the different concentrations of hygromycin

黄萎菌菌株VD-Strain潮霉素浓度Concentrationofhygromycin(μg/mL)0102030405070100VD-12 9±0 021 5±0 060 8±0 030±00±00±00±00±0VD-2782 8±0 021 5±0 030 6±0 070±00±00±00±00±0
2.3 农杆菌AGL-1和GV1303对黄萎病菌转化效率的影响
农杆菌的类型直接影响黄萎病菌的转化效率。能够转化丝状真菌的农杆菌有很多种包括AGL-1、EHA105、LBA1100、LBA4401、GV3101等,它们之间对转化受体的毒性有着明显地差异。一般而言,农杆菌对转化的受体材料具有一定的选择性,农杆菌毒性越强,对材料中T-DNA的插入效率也越高,但对受体材料的毒害越强,在进行筛选时,受体材料的成活率也越低,从而对受体的转化效率降低。应用潮霉素B和羧苄青霉素筛选时,农杆菌的抗性越强,最终农杆菌斑干扰转化子的纯度和增加筛选转化子的难度。研究表明,农杆菌菌株AGL-1对两种非落叶型新疆棉花黄萎病菌的转化效率显著高于农杆菌菌株GV3101。图4
2.4 转基因黄萎病菌的分子鉴定
以转接4~5代的阳性黄萎病菌VD-1和VD-278遗传稳定的转化子基因组DNA为模板,以GFP和潮霉素B基因特异性引物进行PCR分子检测,结果表明:4个转化子中均扩增出扩增出243 bp左右的特异性GFP基因片段以及900 bp的特异性潮霉素B基因片段,野生菌株中没有扩增出相应的基因片段,证明GFP-GUS融合基因和潮霉素B抗性基因已整合到转化子基因组中。将转化子继续进行培养,选取部分菌落的菌丝和孢子进行GUS染色,研究表明,GFP-GUS融合基因已经被整合到棉花黄萎病菌的基因组中,并能够在构巢曲霉色氨酸启动子(Ptrpc)调控下正常表达。图5

M:DNA marker 5K;1、2、4、5:潮霉素B基因;5、7-9:GFP基因PCR结果;3:未转化菌株;a、b未转化菌丝和孢子染色结果;c、d转基因孢子和菌丝染色结果
3 讨 论
棉花黄萎病菌(Verticilliumdahliae)不能识别CaMV35S启动子,植物表达载体不能直接用于黄萎病菌的遗传转化[14]。目前,常见的真菌启动子有构巢曲霉的 GPD 启动子、trpc启动子和偃麦草核菌(PyrenopHora tritici-repentis)的 ToxA 启动子等[15]。实验中采用trpc启动子,NOS终止子、HygB为筛选标记、绿色荧光蛋白GFP和GUS为报告基因,以植物表达载体pCAMBIA1304为框架构建成真菌表达载体,通过农杆菌介导的方法把GFP-GUS和抗性筛选基因HygB插入到黄萎菌基因组中,并在黄萎菌中成功的表达。表明构巢曲霉色氨酸启动子Ptrpc能被黄萎菌所识别。
棉花黄萎病菌为一种土传真菌病害,侵染植物主要从根部或伤口进入体内,病原菌在植物体内的移动主要是依靠植物的水分运输系统,孢子随着植物水分和养分的运输,移动到植物的每个组织中。迄今为止,国内外对V.dahliae致病性研究多采用纸钵撕底蘸根法、针刺接种法或其它相类似的方法[16-19],这些方法只能从棉花发病的表型上判断黄萎病菌对植株的致病性,不能从机理上解释棉花发病的原因。从生菜、马铃薯、棉花中分离的黄萎病菌已经被成功的用荧光所标记[19]。新疆棉花黄萎病菌属于大丽轮枝菌,在不同地区已经产生了许多生理小种,研究使用的非落叶型菌株VD-1和VD-278是近期从新疆北疆棉花生产病区分离并鉴定的菌株,VD-1为菌核型,VD-278为中间型,可作为新疆北疆棉花抗性鉴定标准菌株之一。高兴喜等[20]进行了对木霉用农杆碱性菌株AGL-1遗传转化成功,而章鱼碱性农杆菌LBA4404却转化失败。Eynck等采用农杆菌介导法将 pGV04 载体成功地转入大丽轮枝菌,获得了稳定表达GFP的大量转化子[21]。在多数前人研究大丽轮枝菌主要针对落叶型黄萎病菌,对非落叶型黄萎病菌研究较少。因此,研究通过用农杆菌AGL-1和GV3101介导的孢子转化体系将绿色荧光蛋白GFP和GUS基因转入新疆非落叶型黄萎病菌VD-1和VD-278,成功获得了阳性转化子,发现农杆菌AGL-1对新疆非落叶型黄萎病菌的转化效率显著高于GV3101。这表明农杆菌的毒性和其转化寄主之间的相互识别和感应,可以在提高转化效率时选择农杆菌的类型。
研究构建的绿色荧光标记载体1304-P-ORF通过农杆菌介导的转化,其T-DNA区可稳定整合到新疆棉花黄萎病菌菌株VD-1和VD-278的基因组中,挑选GFP-GUS表达量高与野生菌株致病性相似的、并能进行性稳定的遗传表达,通过GUS组织染色,被标记菌株的菌丝体和分生孢子呈现出明显的蓝色。转GFP-GUS基因的黄萎病菌的获得为深入研究棉花黄萎病入侵的机理奠定了基础,能够较为直观的了解新疆非落叶型黄萎菌的致病过程,为黄萎病菌在大田防治中提供一个理论基础。
4 结 论
构建了含有GFP-GUS融合基因的真菌表达载体,并通过农杆菌介导转入两株致病性不同的非落叶型黄萎病菌,阳性转化子的孢子和菌丝,通过GUS组织化学染色,都能表现出蓝色,表明GUS-GFP融合基因成功的整合到新疆棉花黄萎病菌的基因组中,并能稳定的遗传表达。在农杆菌介导转化两株非落叶型的新疆黄萎病菌时,选用启动子的表达、筛选抗生素的浓度、农杆菌的类型等诸多因素影响非落叶型黄萎病菌。弱毒菌株一般都为非落叶型黄萎病菌,现在在病原菌中又出现了中间型的菌株,在弱毒株转变为强毒株的过程中,中间型的菌株成为一个过渡类型,其转变过程是多方面因素决定的,但是转变机理未知,通过转基因的非落叶型黄萎病菌能直观的了解菌株之间的转化过程。
References)
[1] 刘学堂,宋晓轩.棉花黄萎病菌的研究及最新进展[J].棉花学报,1998,10(1):6-13.
LIU Xue-tang, SONG Xiao-xuan. (1998). The research and the latest progress of cotton verticillium wilt[J].CottonScience, 10(1): 6-13. (in Chinese).
[2] Adams S. S Rouse D. I Bowden R. Performance of alternative versions of POTWIL: a computer model that simulates the seasonal growth of Verticillium-infected potato ,Am.PotatoJ, 1987, 64: 429-435.
[3] 李淑英,吴德祥,路羲结,等.棉花黄萎病致病机理及抗病育种研究进展[J].安徽农业科学, 2001, 29(4): 477-479.
LI Shu-ying, WU De-xiang, LU Xi-jie, et al. (2001). Advanceed researches on the mechanis of virulence of Verticillum dahliae and resistance breeding in cotton [J].JournalofAnhuiAgriculturalSciences, 29(4): 477-479. (in Chinese).
[4] Garas, N. A. (1986). Relationship of cultivar resistance to distribution of verticillium dahliae in inoculated cotton plants and to growth of single conidia on excised stem segments.Phytopathology, 76(10):1,005-1,010.
[5] Weller, R. (2003). Nitric oxide: a key mediator in cutaneous physiology.Clinical&ExperimentalDermatology, 28(5):511-514.
[6] Andrie, R. M., & Martinez, J. P. L. M. (2005). Development of toxa and toxb promoter-driven fluorescent protein expression vectors for use in filamentous ascomycetes.Mycologia, 97(5):1,152-1,161.
[7] Vallad, G. E., & Subbarao, K. V. (2008). Colonization of resistant and susceptible lettuce cultivars by a green fluorescent protein-tagged isolate of verticillium dahliae.Phytopathology, 98(8):871-885.
[8] Hooykaas, P. J. J., Roobol, C., & Schilperoort, R. A. (1979). Regulation of the transfer of ti plasmids of agrobacterium tumefaciens.JournalofGeneralMicrobiology, 110(1):99-109.
[9] Bundock, P. ,., Dulk-Ras, A. D., Beijersbergen, A.,& Hooykaas, P. J. (1995). Trans-kingdom t-dna transfer from agrobacterium tumefaciens to saccharomyces cerevisiae.EmboJournal, 14(13):3,206-3,214.
[10] Rauyaree, P., Ospina-Giraldo, M. D., Kang, S., Bhat, R. G., Subbarao, K. V., & Grant, S. J., et al. (2005). Mutations in vmk1, a mitogen-activated protein kinase gene, affect microsclerotia formation and pathogenicity in verticillium dahliae.CurrentGenetics, 48(2):109-116.
[11] Martyn, R. D. (1991). Resistance to races 0, 1, and 2 of fusarium wilt of watermelon in citrullus sp. pi-296341-fr.HortscienceAPublicationoftheAmericanSocietyforHorticulturalScience, 26(4):429-432.
[12] Mullins, E. D., Chen, X.,Romaine, P.,Raina, R.,Geiser, D. M., & Kang, S. ,. (2001). Agrobacterium-mediated transformation of fusarium oxysporum: an efficient tool for insertional mutagenesis and gene transfer.Phytopathology, 91(2):173-180.
[13] Huang, H. C., & Hanna, M. R. (1991). An efficient method to evaluate alfalfa cultivars for resistance to verticillium wilt.CanadianJournalofPlantScience, 71(3):871-875.
[14] 徐旗荣.棉花黄萎病菌T-DNA插入突变体表型特征及侧翼序列分析[D].北京.中国农业科学院生物技术研究所博士论文,2009.
XU Qi-rong. (2009).PhenotypecharacteristicsandflankingsequenceanalysisofT-DNAinsertionalmutantsonverticilliumdahliae[D]. PhD Dissertation. Biotechnology Research Institute, Beijing. (in Chinese).
[15] 赵风轩.绿色荧光蛋白标记的大丽轮枝菌的获得及其在棉花中侵染过程的研究[D]. 北京.中国农业科学院生物技术研究所硕士论文, 2012.
ZHAO Feng-xuan. (2012).Productionofverticilliumdahliaeklebtaggedbygreenfiuorescenceproteinanditsinfectionprocessincotton[D]. Master Dissertation. Biotechnology Research Institute, Beijing. (in Chinese).
[16] Sink, K. C., & Grey, W. E. (1999). A root-injection method to assess verticillium wilt resistance of peppermint ( mentha × piperita l.) and its use in identifying resistant somaclones of cv. black mitcham.Euphytica,106(3):223-230.
[17] 马 平, Huang H C,李社增,等.一种新的棉花黄萎病快速接种技术及其在病原菌致病力和寄主抗病性鉴定上的应用[J]. 植物病理学报, 2004, 34(6): 536-541.
MA Ping, HUANG H C , LI She-zeng, et al. (2004). A new inoculation method forVerticilliumwilton cotton and its application in evaluating pathogenesis and host resistance [J].ActaPhytopathologicaSinica, 34(6): 536-541. (in Chinese).
[18] 王省芬,马峙英.一种新的棉花黄萎病抗性鉴定方法[J].棉花学报,2002, 14(4): 231-233.
WANG Xing-fen, MA Chi-ying. (2002). A new method for indification of cotton Verticillium wilt resistance [J].CottonScience, 14(4): 231-233. (in Chinese).
[19] 陈天子,袁洪波,杨郁文.等.农杆菌介导转化大丽轮枝菌的体系优化[J].棉花学报,2011,23(6):507-514.
CHEN Tian-zi, YUAN Hong-bo, YANG Yu-wen, et al. (2011). Optimization of Agrobacterium tumefaciens-mediated transformation ofVerticilliumdahile[J].CottonScience, 23(6): 507-514. (in Chinese).
[20] 高兴喜,杨谦.根癌农杆菌介导的CryIA(b)基因在哈茨木霉菌中的转化[J].科学通报,2004,49(21):2 193-2 197.
GAO Xing-xi, YANG Qian. (2004). CryIA(b) gene transformationTrichodermaharzianumbyAgrobacteriumtumefaciens-mediated transformation[J].ChineseScienceBulletin, 49(21): 2,193-2,197.(in Chinese).
[21] Eynck, C., Koopmann, B., Grunewaldt-Stoecker, G., Karlovsky, P., & Tiedemann, A. V. (2007). Differential interactions of verticillium longisporum and v. dahliae with brassica napus detected with molecular and histological techniques.EuropeanJournalofPlantPathology, 118(3):259-274.
Fund project:Ministry of Agriculture transgenic major projectsenvironmental safety assessment of transgenic cotton technology(2016ZX08011)
dGFP-GUSGenes Tagged ofVerticilliumDahliaeof Cotton in Xinjiang
KONG De-zhen, HUA Dong-lai ,WANG Xiu-zhen, LIU Bu-cang, ZHU Jian-bo, WANG Ai-ying
(CollegeofLifeScience,ShiheziUniversity,ShiheziXinjiang832000,China)
【Objective】 In order to analyze theVerticilliumdahliaeingression mechanism.【Method】A novel vector 1304-P-ORF was constructed from the plasmids of PUCCATPH, pCAMBIA1304, which includedGFP-GUSgene driven by the trpc promoter, which induced wild-type agrobacterium tumefaciens AGL-1 and GV3101.Vector 1304-P-ORF was transformed intoVerticilliumdahliaestrain VD-1 and VD-278 by agrobacterium tumefaciens-mediated transformation (ATMT).【Result】The result showed that screening concentration of hygromycin was 30 mg/ml, and agrobacterium AGL-1 to conversion efficiency was 40% higher than GV1301 toVerticilliumdahliae. 2 independent strains of T1generation of transgenic VD-1 and 6 independent strains of T1generation VD-278 were screened on PDA medium containing hygromycin.GUSenzyme could be detected in spore and hyphae ofVerticilliumdahliaeby tissue staining.GFPand hygromycin genes were confirmed by PCR amplification by using DNA of transgenic strains, which indicated thatGFP-GUSand hygromycin genes had been successfully transformed into transgenic strains.【Conclusion】The study laid foundations for further using ofGFP-GUSgene and genetic transformation system of XinjianngVerticilliumdahliae, which will benefit a lot in further study ofVerticilliumdahliaeinfection of cotton.
Ptrpc promoter; ATMT;GFP-GUS; cottonVerticilliumdahliae
10.6048/j.issn.1001-4330.2016.01.001
2015-05-08
农业部转基因重大专项“转基因棉花环境安全评价技术”(2016ZX08011)
孔德真(1987-),男,甘肃临夏人,硕士研究生,研究方向为环境生物技术,(E-mail)kongdezhen1746@163.com
王爱英(1972-),女,山东成武人,副研究员,研究方向为环境生物技术以及安全性评价,(E-mail)way-sh@126.com
S435.62
A
1001-4330(2016)01-0001-08
