玉米珍黄色素稳定性的研究
2016-04-13付金玲
苟 丽,曹 洁,付金玲
(文山学院 化学与工程学院,云南 文山 663099)
玉米珍黄色素稳定性的研究
苟 丽,曹 洁,付金玲
(文山学院 化学与工程学院,云南 文山 663099)
以玉米珍为原料,用95%乙醇溶液浸提提取玉米黄色素,以吸光度为评价指标,研究了玉米黄色素的稳定性。研究结果表明:玉米黄色素在449 nm处有最大吸收,耐光性极差,具有一定的耐热性、耐氧化还原性,在弱酸及碱性环境下稳定性很好,但在强酸条件下不稳定,苯甲酸钠、柠檬酸、亚硝酸钠等食品添加剂,K+、Na+、Zn2+、Mg2+、HCO3σ、Clσ、NO3
玉米珍;黄色素;稳定性;吸光度
合成食用色素种类多,稳定性好[1]。然而,随着科学技术的发展,特别是医学、毒理学的发展,越来越多的食用合成色素被发现不利于人体健康。但存在于动物体、植物体中的天然色素作为食用色素则比较安全[2]。所以,合成食用色素有可能完全被无毒天然食用色素取代[3]。
玉米(Zea.maysL)为禾本科玉米属一年生草本植物。玉米黄色素的主要成分为玉米黄素、隐黄素、叶黄素等[4-5],在玉米籽粒中含量约为0.01~0.9 mg/ 100 g[6],因其具有生物活性,如抗氧化性,对癌症、心血管疾病、眼部疾病等有一定的治疗和预防作用。因此,玉米黄色素可用于食品、饮料、医药、保健等领域[7]。本研究以95%的乙醇为溶剂浸提玉米黄色素,用分光光度法测定玉米黄色素在多因素影响下的稳定性。为进一步利用玉米黄色素提供依据。
1 材料、仪器及试剂
1.1 材料
玉米珍、低钠盐、海藻碘盐、螺旋藻盐、雪晶盐、鸡蛋均购于文山百信超市。
1.2 仪器
紫外分光光度计(UV-2550,日本津岛);可见分光光度计(V-1100D,上海美谱达仪器有限公司);型恒温水浴锅(W201,上海申顺生物科技有限公司);分析天平(XT-220A,瑞士普利赛斯设备有限公司)。
1.3 试剂
95%乙醇、H2O2(30%)、抗坏血酸、蔗糖、无水碳酸钠、无水葡萄糖、可溶性淀粉、柠檬酸、碳酸氢钠、盐酸及氢氧化钠等都是分析纯;明胶为生化试剂。
2 实验方法
2.1 玉米黄色素的制备
用优质玉米珍作原料,以料液比为1∶8与95%的乙醇浸提剂混合后,以HCl和NaOH调节其pH值为7,在75 ℃下于恒温水浴锅中提取2 h后抽滤,抽滤多次至浸提液透明且无沉淀即得玉米黄色素提取液[8]。
2.2 玉米黄色素的光谱性
用紫外分光光度计扫描,测出玉米黄色素吸收峰所对应的最大吸收波长,该波长即为以下测定的波长。
2.3 玉米黄色素的稳定性研究
在保持玉米黄色素的浓度相同的条件下,在最大波长下测定不同光照条件、温度、pH值、氧化剂与还原剂、部分食品添加剂、淀粉、蛋白质、金属离子、糖类、阴离子、食用盐、明胶、味精对玉米黄色素稳定性的影响。色素稳定性以吸光度为评价指标。
3 结果与讨论
3.1 玉米黄色素的光谱性
取一定量的玉米黄色素提取液,用95%乙醇定容至25 mL,用紫外-可见分光光度计扫描,测出玉米黄色素吸收峰所对应的最大吸收波长,该波长为以下测定波长。结果见图1。

图1 玉米黄色素的紫外光谱图
由图1可以看出,玉米黄色素在449 nm下有最大吸收,以下将449 nm作为测定波长。
3.2 玉米黄色素溶液在光照条件下稳定性
分别取等量的色素提取液于容量瓶中,用95%乙醇稀释至刻度,分别在日光直射、自然光照射及黑暗条件下放置不同时间后,在449 nm处测其吸光度。结果见表1。

表1 玉米黄色素溶液光照不同时间下稳定性
由表1可知,光照对玉米黄色素有很大的影响。在阳光直射下,随着放置时间的增加,玉米黄色素溶液由亮黄色变为黄绿色再变为无色,放置5 h后色素吸光度就降为0.000;而在自然光照射和黑暗条件下,随着放置时间的增加,玉米黄色素溶液的颜色无明显变化,但黑暗条件下的色素稳定性高于自然光照射条件下的。所以,玉米黄色素在使用过程中应避免阳光直射,且应尽量避光保存。
3.3 玉米黄色素溶液在不同温度下的稳定性
移取一定量的色素提取液于容量瓶中,以95%乙醇稀释至刻度配成色素实验液,分别在15 ℃、30 ℃、45 ℃、60 ℃、75 ℃、90 ℃下的恒温水浴锅中恒温10 min后,在449 nm处分别测不同温度下其吸光度,并观察其颜色变化。结果见表2。
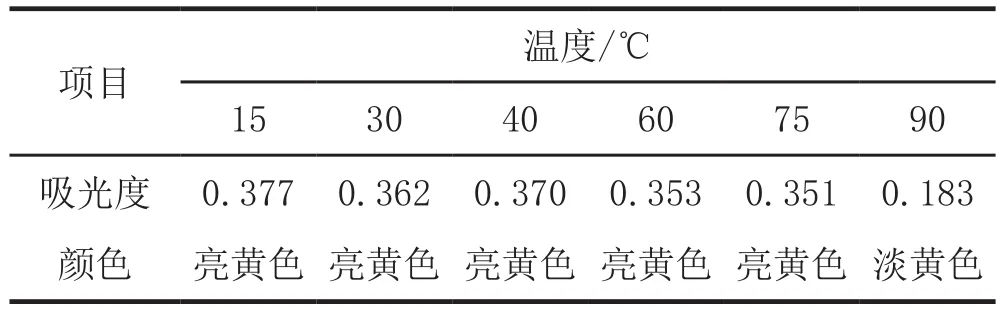
表2 玉米黄色素溶液在不同温度下的稳定性
由表2可知,温度对玉米黄色素有一定的影响。接近室温的色素溶液的吸光度值较较高温度的大,但15 ℃~75 ℃之间色素溶液的吸光度变化不大于0.03,而90 ℃时色素溶液的吸光度变为了0.183,吸光度下降值较大,且颜色由亮黄色变为了淡黄色,说明高温对玉米黄色素的稳定性影响极大。所以,玉米黄色素具有一定的耐热性,但是在使用玉米黄色素及用玉米黄色素着色食品的过程中,应避免较高温度。
3.4 玉米黄色素溶液在不同pH值下的稳定性
分别移取等量的色素提取液于容量瓶中,用95%乙醇稀释至刻度,用HCl和NaOH溶液分别调其pH值为1、3、5、7、9,静置5 min后,在449 nm处分别测定其吸光度,并观察颜色变化。结果见表3。
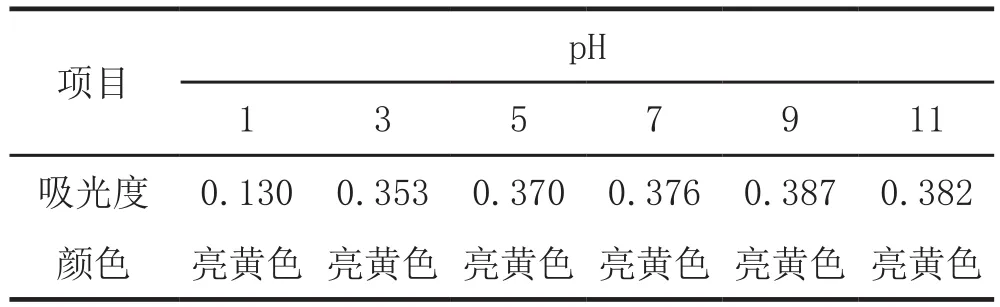
表3 玉米黄色素溶液在不同pH值时的稳定性
由表3可知,玉米黄色素随pH值的增大颜色无明显变化,但在pH值为1时色素溶液的吸光度较其它pH值小,而其它pH值下色素溶液的吸光度值变化不大。所以,pH值对玉米黄色素的稳定性有一定的影响,在使用玉米黄色素的过程中应避免在强酸性环境中使用。
3.5 玉米黄色素溶液在不同浓度的氧化剂和还原剂中的稳定性
以H2O2为氧化剂,Vc及Na2SO3为还原剂。分别配制色素浓度相同而H2O2、Vc、 Na2SO3浓度不同的色素实验液,在449 nm下于不同时刻分别测定其吸光度。结果见表4、表5和表6。

表4 玉米黄色素溶液在不同浓度的H2O2中的稳定性
从表4可以看出,色素实验液在H2O2存在下吸光度有所变化,但H2O2浓度低于12%时色素溶液的吸光度变化不大,而当H2O2浓度为12%时色素溶液的吸光度明显增大。随着H2O2浓度的增加和摆放时间的增加,色素溶液的颜色无明显变化。所以,玉米黄色素在H2O2存在下在一定的范围内稳定的,可见玉米黄色素在一定范围内有一定的耐氧化性。

表5 玉米黄色素溶液在不同浓度的Vc中的稳定性
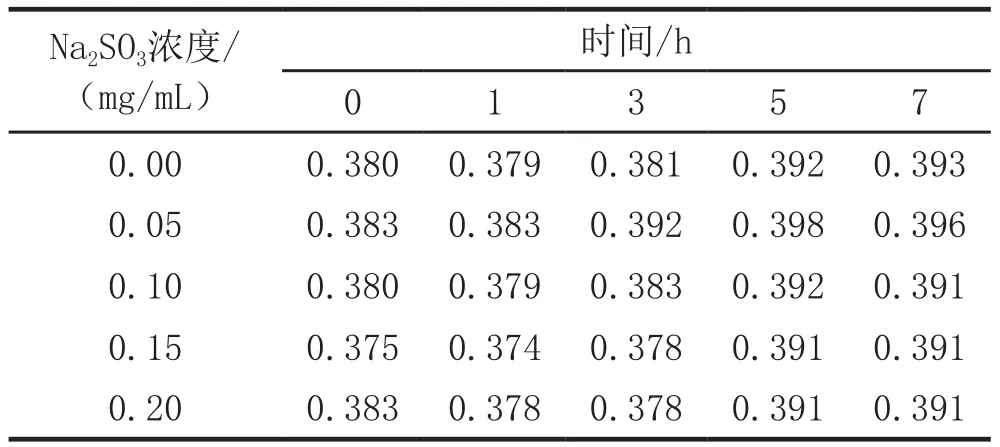
表6 玉米黄色素溶液在不同浓度的Na2SO3中的稳定性
由表5,表6可知,加了还原剂后的色素溶液的吸光度有所变化,但变化值均不大于0.03,且随着还原剂浓度的增加和摆放时间的延长,色素溶液的颜色无明显变化。所以,Vc、Na2SO3对玉米黄色素的稳定性影响不大,即玉米黄色素具有一定的耐还原性。固玉米黄色素可用于含Vc及Na2SO3的食品中。
3.6 玉米黄色素溶液在部分食品添加剂中的稳定性
分别配制苯甲酸钠、柠檬酸、亚硝酸钠的浓度为0.00 mg/mL、0.05 mg/mL、0.10 mg/mL、0.15 mg/mL、0.20 mg/mL而玉米黄色素浓度相同的色素溶液,放置不同时间于449 nm处分别测定其吸光度。结果见表7、表8、表9。

表7 玉米黄色素溶液在不同浓度的苯甲酸钠中的稳定性
由表7可以看出,随着苯甲酸钠浓度的增大和放置时间的增加,色素溶液的吸光度值有所降低,但变化的幅度均不是很大。且色素溶液的颜色无明显变化。所以苯甲酸钠对玉米黄色素稳定性的影响很小。

表8 玉米黄色素溶液在不同浓度的柠檬酸中的稳定性
由表8可知,与不加柠檬酸的色素溶液比较,含柠檬酸浓度为0.05 mg/mL时色素溶液的吸光度有所增大,而当柠檬酸浓度大于0.05 mg/mL时,色素溶液的吸光度有所降低,但变化值均不是很大。所以柠檬酸对玉米黄色素稳定性的影响不大。

表9 玉米黄色素溶液在不同浓度亚硝酸钠中的稳定性
由表9可以看出,与不加亚硝酸钠的色素溶液比较,加了亚硝酸钠的色素溶液的吸光度值有所降低,但降低值均不大于0.03。且色素溶液的颜色无明显变化。所以,亚硝酸钠对玉米黄色素稳定性的影响不大。
3.7 玉米黄色素溶液在明胶中的稳定性
分别配制明胶浓度为0.00 mg/mL、0.05 mg/mL、0.10 mg/mL、0.15 mg/mL、0.20mg/mL而玉米黄色素浓度相同的色素溶液,放置不同时间于449 nm处分别测定其吸光度。结果见表10。

表10 玉米黄色素溶液在不同浓度的明胶中稳定性
由表10可知,与不加明胶的色素溶液比较,加了明胶的色素溶液的吸光度随着明胶浓度的增大依次升高,但在相同的明胶浓度下,随着摆放时间的延长,色素溶液的吸光度降低。从整体看,加了明胶的色素溶液的吸光度较对照组高。明胶对色素有增色作用。
3.8 玉米黄色素在不同金属离子溶液中的稳定性
分别配制金属离子浓度为0.1 mg/mL而的色素浓度相同的溶液;在449 nm下分别测定其吸光度并观察其颜色变化。结果见表11。

表11 玉米黄色素在不同金属离子溶液中的稳定性
由表11可知,与对照相比,加了K+、Na+、Fe2+、Al3+、Cu2+、Zn2+、Mn2+、Mg2+的色 素 溶 液 的色素残存率分别为99.7%、99.5%、84.7%、91.8%、93.4%、97.9%、94.9%、98.4%。Fe2+对玉米黄色素的影响大,其次是Al3+、Cu2+、Mn2+,而K+、Na+、Zn2+、Mg2+对玉米黄色素的稳定性基本无影响。所以,在使用、运输及保存玉米黄色素的过程中应避免使用铁铝、铜、锰制品。
3.9 玉米黄色素在不同糖类中的稳定性
分别配制蔗糖、葡萄糖浓度为0.0 mg/mL、0.2 mg/mL、0.4 mg/mL、0.6 mg/mL、0.8 mg/mL而玉米黄色素浓度相同的色素溶液,放置不同时间于449 nm处分别测定其吸光度。结果见表12、表13。
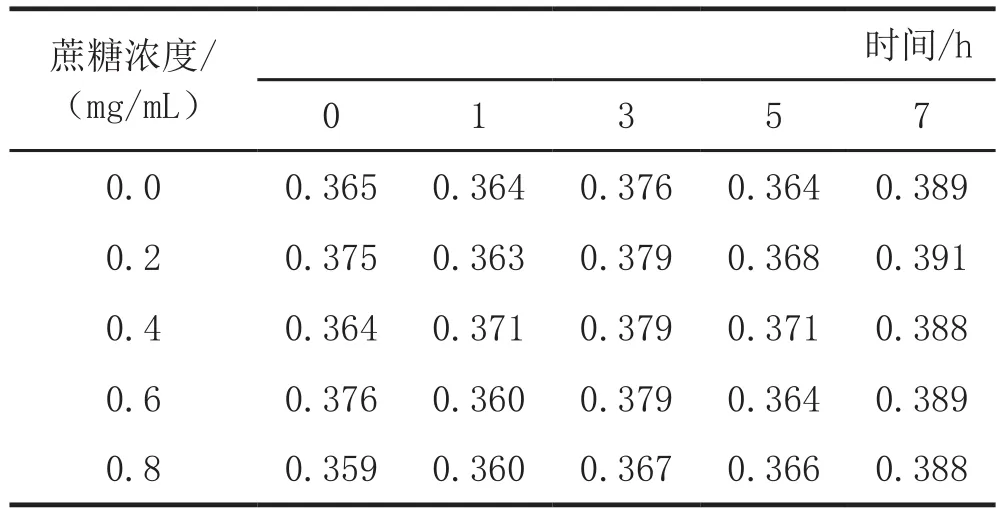
表12 玉米黄色素在不同浓度的蔗糖中的稳定性

表13 玉米黄色素在不同浓度的葡萄糖的稳定性
由表12和表13可以看出,与对照组相比,加了蔗糖、葡萄糖的色素溶液的吸光度有所变化,但变化值均不大。所以蔗糖、葡萄糖对玉米黄色素稳定性的影响不大。玉米黄色素可用于含蔗糖、葡萄糖的食品中。
3.10 玉米黄色素在阴离子中的稳定性
分别配制阴离子浓度均为为0.1 mg/mL且玉米黄色素浓度相同的色素溶液,在449 nm下分别测定其吸光度并观察颜色变化。结果见表14。

表14 玉米黄色素在阴离子中的稳定性
由表14可知,与对照色素溶液相比,加了阴离子的色素溶液的吸光度均有所变化,但加了和的色素溶液的吸光度变化尤为突出,有一定的增色作用,而其它变化值均不大。
3.11 玉米黄色素在不同的食用盐中的稳定性
分别配制食用盐的浓度均为0.3 mg/mL且玉米黄色素的浓度相同的色素溶液,在449 nm下每隔一段时间分别测定其吸光度。结果见表15。

表15 玉米黄色素在不同的食用盐中的稳定性
由表15可以看出与对照组相比,加了食用盐的色素溶液的吸光度总体上增大,但变化值均不大于0.03,所以食用盐对玉米黄色素稳定性的影响不大。
3.12 玉米黄色素在不同浓度的鸡蛋清中的稳定性
分别配制鸡蛋清浓度为0 mg/mL、2 mg/mL、4 mg/mL、6 mg/mL、8 mg/mL而玉米黄色素浓度相同的色素溶液,放置不同时间于449 nm处分别测定其吸光度。结果见表16。

表16 玉米黄色素在不同浓度的蛋白质中的稳定性
从表16可以看出,与对照组相比,加了蛋白质的色素溶液的吸光度随着蛋清含量的增加和作用时间的延长而增大,且增幅很大。不加蛋清的色素溶液的颜色为亮黄色;当蛋白质含量为2 mg/mL时,色素溶液为黄色且微浑;当蛋白质含量增至4 mg/mL及以后,色素溶液为黄色但浑浊且摆放后出现沉淀,可能是由于随着蛋清浓度的增大,逐渐超于饱合状态而变浑浊至出现沉淀。因此,在添加蛋清时应严格控制浓度不影响玉米色素的亮黄色。
3.13 玉米黄色素在不同浓度的味精中的稳定性
分别配制味精浓度为0.00 mg/mL、0.05 mg/mL、0.10 mg/mL、0.15 mg/mL、0.20 mg/mL而玉米黄色素浓度相同的色素溶液,放置不同时间于449 nm处分别测定其吸光度。结果见表17。

表17 味精对玉米黄色素稳定性的影响
由表17可以看出,随着味精浓度的增加和摆放时间的延长,色素溶液的吸光度有所变化,但变化值均不大于0.03,色素溶液的颜色无明显变化。所以味精对玉米黄色素的稳定性几乎无影响,在使用玉米黄色素的同时可以使用味精。
3.14 玉米黄色素在不同浓度淀粉中的稳定性
分别配制淀粉浓度为0.0 mg/mL、0.1 mg/mL、0.3 mg/mL、0.5 mg/mL、0.7 mg/mL而玉米黄色素浓度相同的色素溶液,放置不同时间于449 nm处分别测定其吸光度。结果见表18。

表18 玉米黄色素在不同浓度淀粉中的稳定性
由表18可知,与未加淀粉的色素溶液相比,随着淀粉浓度的增加及摆放时间的延长,色素溶液的吸光度逐渐升高,且升高值较大。说明淀粉对玉米黄色素有一定的增色作用。
4 结论
玉米黄色素在449 nm处有最大吸收;耐光性差,具有一定的耐热性,但是高温对玉米黄色素的稳定性影响大;具有耐还原性,在一定浓度范围内具有耐氧化性;玉米色素应避免在强酸性环境中使用,适宜在弱酸性、中性条件下使用;对苯甲酸钠、柠檬酸、亚硫酸钠、葡萄糖、蔗糖、食用盐、味精、K+、Na+、Zn2+、Mg2+较 稳 定;对Fe2+、Al3+、Cu2+、Mn2+不稳定;明胶、淀粉、蛋清、CO32-、SO4
2-对色素有一定的增色作用。
参考文献:
[1] 崔凌飞,王遂.玉米皮色素提取及其稳定性研究[J].食品科学,2002(5):66-70.
[2] 赵吉寿,俸艳芳,颜莉.天然食用玉米黄色素提取与性质研究[J].云南民族学院学报(自然科学版),1995(1):41-45.
[3] 张立云,温路新,尹宝霖,等.玉米黄色素的提取工艺研究[J].聊城师院学报(自然科学版),2000(2):53-56.
[4] 林泽华,任娇艳.玉米黄色素提取工艺及生物活性研究进展[J].中国食品添加剂,2014(2):214-219.
[5] 田龙,鲁云风.玉米黄色素的超声强化提取及其稳定性研究[J].中国食品添加剂,2006(6):96-101.
[6] 张智,王婷婷,邹心东,等.天然食品添加剂玉米黄色素的研究进展[J].科技创新导报,2010(16):12.
[7] 郎繁繁,董文宾,修秀红.玉米黄色素的提取工艺及应用研究现状[J].粮油食品科技,2014(1):29-31.
[8] 黄新辉,李跟深,马淑惠,等.玉米黄色素的稳定性研究[J].化学与生物工程,2006(6):38-40.
Extraction and Stability Study of Maize Yellow Pigment
GOU Li, CAO Jie, FU Jinling
(School of Chemistry and Engineering, Wenshan University, Wenshan Yunnan 663099, China)
This paper studies the stability of maize yellow pigment extracted from ground maize using 95% ethanol with absorbance as evaluation index. The results of the study show that the corn yellow pigment has characters that maximum absorption is at 449nm, light fastness is poor, it has some heat resistance and oxidation of reducing, stability is very good in weak acid and alkaline environment. However, it is very unstable in strong acid condition. In addition, sodium benzoate, citric acid, sodium nitrite and other food additives, K+, Na+, Zn2+, Mg2+, HCO3-, Cl-, NO3-, HPO42-, OH-have less effect on the stability of maize yellow pigment. To the contrary, Fe2+, Al3+, Cu2+, Mn2+have more effect. And gelatin, protein, starch, CO32-and SO42-have an effect on the pigment.
maize yellow pigment; stability; absorbance
TS264.4
A
1674-9200(2016)06-0025-06
(责任编辑 张 铁)
2016-09-26
文山学院“有机化学及实验”精品课程建设项目(A2010202)。
苟丽,女,云南文山人,文山学院化学与工程学院高级实验师,主要从事分析化学研究;曹洁,女,壮族,云南广南人,文山学院化学与工程学院助教,硕士,主要从事化学分析测试研究;付金玲,女,云南保山人,文山学院化学与工程学院2011级化学2班学生。
σ、HPO4
2-、OHσ等离子对玉米黄色素的稳定性影响不大,Fe2+、Al3+、Cu2+、Mn2+、对玉米黄色素的稳定性有较大影响。明胶、淀粉、蛋白质、CO32-、SO42-对色素有一定的增色作用。
