基于星点设计-响应面法优化藜麦凝集素的提取工艺
2016-04-13郭晓恒彭镰心
雨 田,郭晓恒,杨 杭,严 潇,赵 钢,彭镰心,邹 亮*
(1.成都大学基础医学与护理学院,成都四川610106;2.大理大学药学与化学学院,大理云南671000)
基于星点设计-响应面法优化藜麦凝集素的提取工艺
雨 田1,郭晓恒1,杨 杭2,严 潇1,赵 钢1,彭镰心1,邹 亮1*
(1.成都大学基础医学与护理学院,成都四川610106;2.大理大学药学与化学学院,大理云南671000)
为进一步开发利用藜麦的生物活性,利用星点设计-响应面法优选藜麦凝集素的提取工艺。以凝血活性为响应值,在单因素试验的基础上设计响应面试验,优化藜麦凝集素提取条件。结果表明:藜麦凝集素的最佳提取条件为pH 7.2,液料比15∶1(mL∶g),提取温度17℃,提取时间14.3h,该条件下,凝集素血凝活性实为3.612 36。
藜麦;凝集素;星点设计-响应面法;提取工艺
藜麦(Chenopodiumquinoawilld),又称南美藜,原产于南美洲安第斯山区,是唯一一种单体植物,可满足人体营养需求。中国于1987年开始进行藜麦的引种试验研究,并于1993年在西藏地区获得小面积试种成功[1]。目前,在山西、四川和青海等地均开展藜麦小规模种植。藜麦营养成分丰富,其中可利用蛋白质的含量明显高于普通谷物[2]。有研究表明,藜麦中总蛋白质的含量为155.7g/kg[3]。此外,还含有多种氨基酸、淀粉、脂肪、矿物质和维生素。藜麦的药用活性成分包括多酚类、黄酮类、皂苷和凝集素。目前,关于藜麦各种营养成分和多种活性成分的研究均有较多报道,但藜麦凝集素相关的研究较少。
植物凝集素(Lectin)是一种从各种植物、无脊椎动物和高等动物中提纯的糖蛋白或结合糖的蛋白,因其能凝集红血球(含血型物质),故名凝集素。近年来已有研究发现,多种植物凝集素对肿瘤细胞具有抑制作用[4]。从目前研究现状看,植物凝集素的提取分离、结构解析、抗肿瘤、抗病毒分子机制及其在农业上的应用研究将成为未来几年该领域的热点[5]。藜麦作为一种新型杂粮,除具有丰富的营养功能外,还有较高的药用价值,藜麦凝集素的提取开发将为藜麦生物活性的进一步研究奠定基础。
目前,正交试验是筛选植物凝集素提取工艺的主要方法,正交试验设计的考察因素有液料比、溶液pH、提取温度和提取时间等,各个因素根据实际需要设置不同水平。作为一种广泛使用的多因素多水平试验设计方法,正交试验一直用于植物凝集素提取工艺的筛选。响应面法是基于单因素试验结果设计的响应面试验,可通过方程拟合,预测最佳试验条件,能够更加直观和准确地体现各因素间的交互作用。响应面法比正交试验更具有直观性、全面性和准确性。凝集素的提取率可以通过凝血活性来反映,即同一浓度的提取溶液,凝血活性越强则其中凝集素的含量越高。因此,选择凝血活性作为考察指标,更具有实际意义和可操作性。综上,笔者选用PBS缓冲液提取藜麦凝集素,以凝血活性为响应值,基于星点设计-响应面法[6-7]优化藜麦凝集素的提取工艺。
1 材料与方法
1.1 材料
试验兔(成都学院基础医学与护理学院动物实验室),藜麦(山西稼祺藜麦开发有限公司),肝素钠注射液(成都市海通药业生产,生产批号:141004)。
仪器:FW-100多功能粉碎机(北京中兴伟业仪器有限公司制造),CP224C电子天平(奥豪斯仪器上海有限公司制造),H H-4数显恒温水浴锅(常州奥华仪器有限公司制造),HC-2517高速离心机(安徽中科中佳科学仪器有限公司制造)。
1.2 凝集素的粗提
取藜麦100g,用高速万能粉碎机在26 000r/min的转速下粉碎60s,过100目筛,于60℃下烘干至恒重,备用。用电子天平精密称取0.2g藜麦粉末,在不同的提取条件下(不同pH、液料比、提取温度、提取时间)提取,提取后的溶液在高速离心机上以4 000r/min的转速离心10min,收集上清液,作为凝集素粗提液。
1.3 2%新鲜红细胞悬液的制备
参照文献[8]的方法,取新鲜兔血1mL于事先用肝素钠注射液润洗的离心管中,在4 000r/min转速下离心10min,弃去上清液,加入生理盐水1mL,混匀,继续离心10min,连续操作4次,收集底部红细胞,根据红细胞体积,加入相应体积生理盐水配制成2%红细胞悬液,备用[8]。
1.4 凝血活性的检测
在96v孔板上,用移液枪加入40μL凝集素提取液,用生理盐水将凝集素溶液进行等量倍比稀释,混合均匀,加入40μL 2%红细胞悬液,静置2h后,观察红细胞凝集效果。红细胞在v型孔板底部呈网状,不下沉则凝血效果较好;若在v型孔板底部呈点状,则凝血效果较差或无凝血效果。用产生凝血效果最大稀释倍数的对数值表示凝血活性[9-10]。
1.5 单因素试验考察
1.5.1 pH 控制液料比为20∶1(mL∶g,下同),提取时间5h,提取温度60℃,考查pH分别为5.8、6.5、7.2、8.0和8.6时的凝血活性。
1.5.2 液料比 控制pH 6.5,提取时间5h,提取温度60℃,考查液料比分别为10∶1、15∶1、20∶1、25∶1和30∶1时的凝血活性。
1.5.3 提取温度 控制pH 6.5,液料比为15∶1,提取时间5h,考查提取温度分别为10℃、20℃、30℃、40℃和50℃时的凝血活性。
1.5.4 提取时间 控制pH 6.5,液料比为15∶1,提取温度为20℃,考查提取时间分别为5h、10h、 15h和20h的凝血活性。
1.6 响应面试验设计
在单因素试验的基础上,以提取液pH值、提取液料比、提取温度、提取时间4个因素为自变量,根据Design Expert 8.0.6响应面软件设计出星点(中心)设计表,其因素水平见表1。
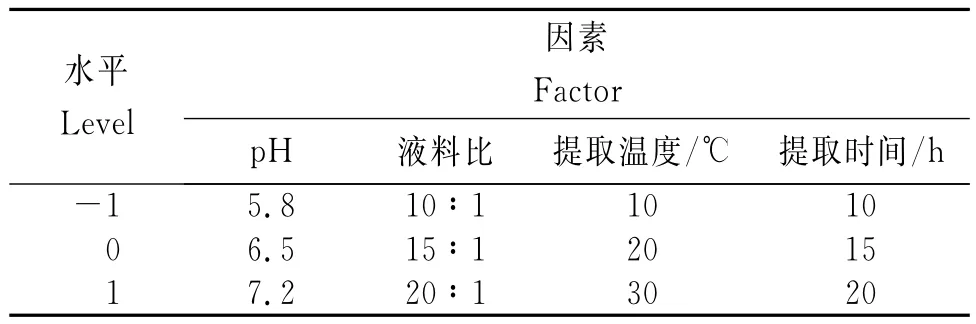
表1 藜麦凝集素提取的响应面试验因素及水平Table 1 The factor and level of response surface experiment for extraction ofC.quinoalectin
1.7 回归模型的建立
Design-Expert软件程序对响应面试验结果进行二次回归响应面分析,3个因子经过拟合建立多元二次回归响应面回归模型。
1.8 响应面分析
根据回归方程绘出等高线图、3D响应面图,从响应面图观察各独立变量之间的交互作用对响应值的影响,分析pH、液料比、提取时间及提取温度对藜麦凝集素凝血效果影响的交互作用。
2 结果与分析
2.1 不同因素提取藜麦凝集素的凝血活性
由图1可知,不同pH、料液比、提取温度和提取时间的藜麦凝集素凝血效果变化。
2.1.1 pH 随着pH的升高,藜麦凝集素的凝血效果呈先升高后下降趋势,在提取缓冲液pH为6.5时,其凝血效果最佳,随后逐渐降低,因此藜麦凝集素的提取pH 6.5为宜。
2.1.2 液料比 随着液料比的升高,藜麦凝集素凝血效果呈先升高后降低再升高趋势,在液料比为15∶1时的凝血效果最佳。考虑成本等因素,藜麦凝集素提取的料液比以15∶1为宜。
2.1.3 提取温度 随着温度的升高,藜麦凝集素凝血效果呈先升高后下降,最后趋于平稳的变化趋势。在20℃时,其凝血效果最佳,故提取温度以20℃为宜。
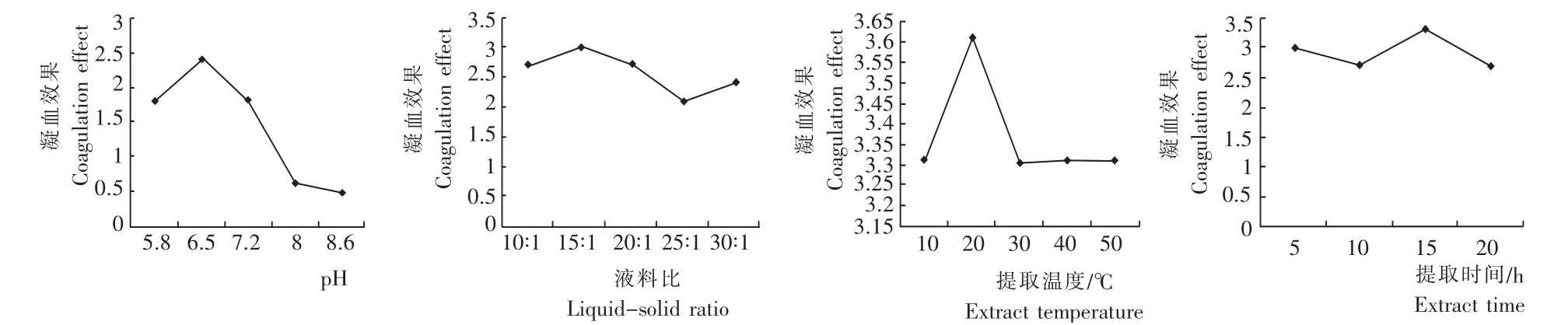
图1 不同pH、液料比、提取温度和提取时间藜麦凝集素的凝血效果Fig.1 Effect of different pH,liquid to solid ratio,temperature and extraction time on blood coagulation ofC.quinoalectin
2.1.4 提取时间 随着提取时间的延长,藜麦凝集素的凝血效果呈先下降后升高再下降的变化趋势,提取时间为15h时,其凝血效果最佳,故提取时间以15h为宜。
2.2 藜麦凝集素提取工艺的优化
2.2.1 回归模型的建立 由表2可知响应面试验提取藜麦凝集素各处理的凝血效果。通过分析,预测模型为y=3.13+0.18A+0.075B+0.050C-0.11D+0.075AB-0.30AC+0.23BC+0.075BD+0.28A2+0.053B2-0.40C2-0.40D2-0.15A2B+0.49B2D-1.13A2B2
由方差分析可知,模型的F=4.71,P<0.001,试验模型极显著,在统计学上有意义。失拟项用来表示模型与试验拟合程度,即二者差异程度。失拟项P>0.05,对模型有利,无失拟因素存在。因此可用该回归方程代替试验对试验结果进行分析。
因素A的P值小于0.05,因素B、C、D的P值均大于0.05,说明在一次项中,提取液pH对凝集活性影响显著,其余3个因素(液料比、提取温度、提取时间)对凝集素凝血活性不显著;二次项A2、C2、D2的P值均小于0.05,说明其对凝集活性影响显著;交互项AC、B2D、A2B的P值均小于0.05,对凝集素活性有显著影响。故4个因素对凝集素血凝活性的影响并非简单的线性关系,二次项、交互项均有显著影响。
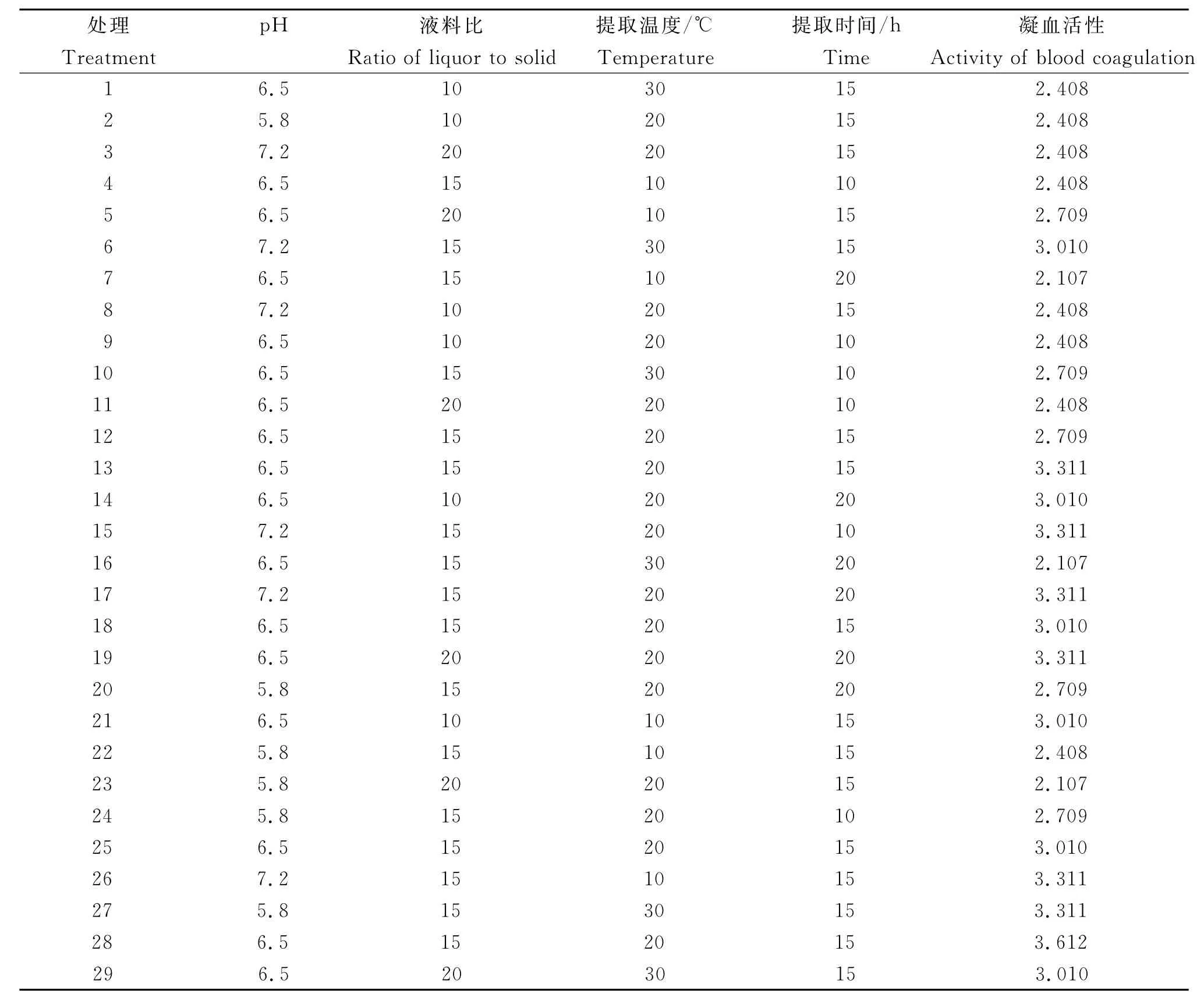
表2 藜麦凝集素的响应面试验结果Table 2 Results of response surface analysis ofC.quinoalectin
2.2.2 各因素间的交互作用 从图2~5看出,在所选择的范围内,均存在极点,响应面3D曲线比较平坦,与试验数据得出的结果一致。液料比、提取温度、提取时间对凝集素血凝活性影响的显著性较小。
2.2.3 最佳工艺验证 由响应面试验结果预测最佳提取条件为pH 7.2,液料比14.82,提取温度16.76℃,提取时间14.28h,根据响应面预测的最佳提取条件,凝集素血凝活性为3.633 33。结合实际实验操作的可行性,将实际最佳提取条件调整为pH 7.2,液料比15,提取温度17℃,提取时间14.3h。照此条件进提取,凝集素血凝活性实际测定值为3.612 36,实际偏差仅0.577%,故此模型预测可行,有实际的指导意义。
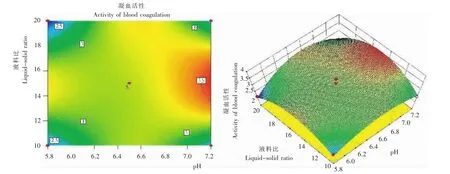
图2 pH与液料比交互作用的藜麦凝集素凝血活性Fig.2 Effect of pH value and ratio of liquor to solid interaction on blood coagulation activity ofC.quinoalectin
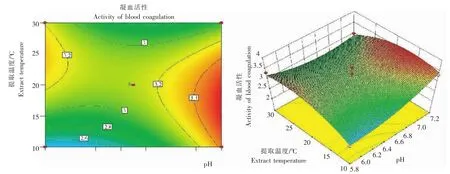
图3 pH与提取温度交互作用的藜麦凝集素凝血活性Fig.3 Effect of pH value and temperature interaction on blood coagulation activity ofC.quinoalectin
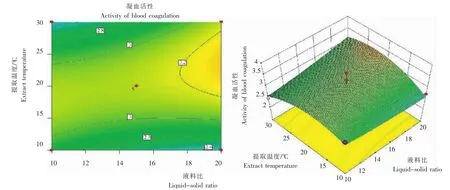
图4 液料比与提取温度交互作用的藜麦凝集素凝血活性Fig.4 Effect of temperature ratio of liquor to solid interaction on blood coagulation activity ofC.quinoalectin
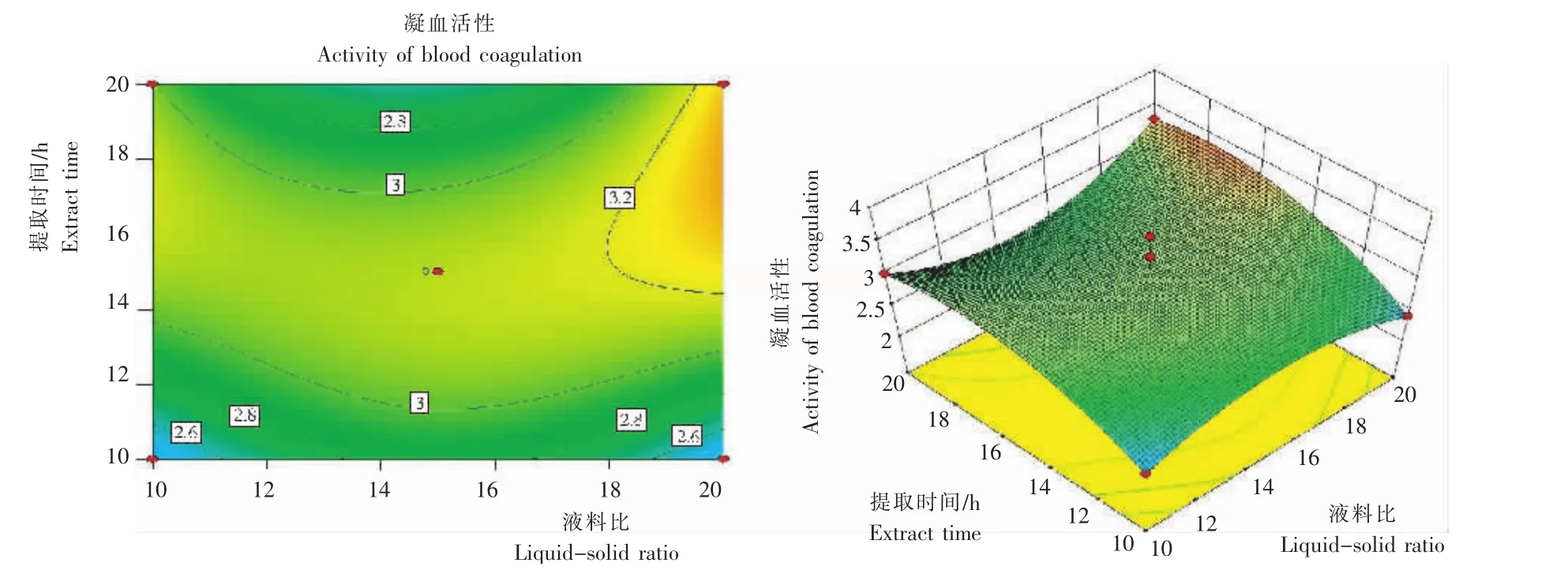
图5 液料比与提取时间交互作用的藜麦凝集素凝血活性Fig.5 Effect of extraction time and ratio of liquor to solid interaction on blood coagulation activity ofC.quinoalectin
3 结论与讨论
试验在藜麦凝集素提取的单因素试验基础上,基于Box-Behnken星点设计-响应面法优化,利用Design-Expert 8.0.6优化藜麦凝集素最佳提取条件,并结合实际操作确定最佳提取工艺为pH 7.2,液料比15∶1,提取温度17℃,提取时间14.3h。该条件下,凝集素血凝活性实为3.612 36,提取效果最佳,实际测定值与理论预测值的偏差仅0.577%,表明此预测切实可行,具有实际指导意义。
目前,国内外学者对藜麦有一定的研究,其多种化学成分的研究均有报道,如总多酚[11]、皂苷[12-14]、黄酮[15]、多糖[16]、蛋白质氨基酸[17]和矿物质营养素等。但针对藜麦凝集素尚缺乏较深入的研究。凝集素作为一种具有抗肿瘤、抗病毒等多种重要药理作用的生物活性物质,具有较高的研究开发价值。
[1]王晨静,赵习武,陆国权,等.藜麦特性及开发利用研究进展[J].浙江农林大学学报,2014(2):296-301.
[2]LAMACCHIA C,CHILLO S,LAMPARELLI S,et al.Amaranth,quinoa and oat doughs:Mechanical and rheological behaviour,polymeric protein size distribution and extractability[J].Journal of food engineering,2010,96(1):97-106.
[3]陈毓荃,高爱丽,贡布扎西.南美藜种子蛋白质研究[J].西北农业学报,1996(3):46-51.
[4]鲍锦库.植物凝集素的功能[J].生命科学,2011(6):533-540.
[5]HE S,SHI J,WALID E,et al.Extraction and purification of a lectin from small black kidney bean(Phaseolus vulgaris)using a reversed micellar system[J].Process Biochemistry,2013,48(4):746-752.
[6]ANNADURAI G,SHEEJA R Y.Use of Box-Behnken design of experiments for the adsorption of verofix red using biopolymer[J].Bioprocess engineering,1998,18(6):463-466.
[7]FERREIRA S L C,BRUNS R E,FERREIRA H S,et al.Box-Behnken design:An alternative for the optimization of analytical methods[J].Analytica chimica acta,2007,597(2):179-186.
[8]李丹彤,李 悦,尹建鹏,等.海带凝集素提取工艺研究[J].水产科学,2014(5):296-300.
[9]邓政东,程爱芳,郑廷金.猴头菇凝集素的提取工艺研究[J].北方园艺,2014(24):133-135.
[10]邓政东,程爱芳,蒲玉婷.黑木耳凝集素的提取工艺[J].江苏农业科学,2015(3):259-260.
[11]PASKO P,BARTON H,ZAGRODZKI P,et al.Anthocyanins,total polyphenols and antioxidant activity in amaranth and quinoa seeds and sprouts during their growth[J].Food Chem,2009,115(3):994-998.
[12]WOLDEMICHAEL G M,WINK M.Identification and biological activities of triterpenoid saponins from Chenopodium quinoa[J].Agric Food Chem,2001,49(5):2327-2332.
[13]BRADY K,HOC T,ROSEN R T,et al.Effects of processing on the nutraceutical profile of quinoa[J].Food Chem,2007,100(3):1209-1216.
[14]STUARDO M,MARTIN R S.Antifungal properties of quinoa(ChenopodiumquinoaWilld.)alkali treated saponins against Botrytis cinerea[J].Ind Crops Prod,2008,27(3):296-302.
[15]ZHU Nanqun,SHENG Shuqun,LI Dajie,et al.Antioxidative flavonoid glycosides from quinoa seeds(ChenopodiumquinoaWilld.)[J].FoodLipids,2001,8(1):37-44.
[16]CORDEIRO L M C,REINHARDT V D,BAGGIO C H,et al.Arabinan and arabinan-rich pectic polysaccharides from quinoa(Chenopodiumquinoa)seeds:structure and gastroprotective activity[J].Food Chem,2012,130(4):937-944.
[17]陈毓荃,高爱丽,贡布扎西.南美藜种子蛋白质研究[J].西北农业学报,1996,5(3):43-48.
(责任编辑:孙小岚)
Optimization of Extraction Technology ofChenopodiumquinoaLectin Based on Central Composite Design/Response Surface Method(CCD-RSM)
YU Tian1,GUO Xiaoheng1,YANG Hang2,YAN Xiao1,ZHAO Gang1,PENG Lianxin1,ZOU Liang1*
(1.CollegeofBasicSciences&Nursing,ChengduUniversity,Chengdu,Sichuan610106;2.CollegeofPharmacy andChemistry,DaliUniversity,Dali,Yunnan671000,China)
The extraction technology of lectin fromC.quinoais optimized by Central Composite Design-Response Surface Methodology(CCD-RSM)to further develop and utilize biological activity ofC.quinoa.Results:The optimum extraction conditions for lectin extraction fromC.quinoainclude pH 7.2,15∶1(mL∶g)of liquid-solid ratio,17℃and 14.3h.The blood coagulation activity of lectin extracted fromC.quinoacan reach 3.612 36under the optimum extraction conditions.
Chenopodiumquinoa;lectin;CCD-RSM;extraction technology
S643.9
A
2016-02-17;2016-8-31修回
食品加工四川省重点实验室项目“藜麦果素酒的制备工艺研究”(15-S08)
雨 田(1981-),女,讲师,从事中药物质基础和质量标准化研究。E-mail:yutian@cdu.edu.cn
*通讯作者:邹 亮(1979-),男,教授,博士,从事中药质量标准化研究。E-mail:zouliang@cdu.edu.cn
1001-3601(2016)09-0398-0120-05
