基于SSR标记的粒用高粱资源遗传多样性及群体结构
2016-04-13周棱波张国兵邵明波张立异
高 旭,周棱波,张国兵,邵明波,张立异
(贵州省旱粱研究所,贵州贵阳550006)
基于SSR标记的粒用高粱资源遗传多样性及群体结构
高 旭,周棱波,张国兵,邵明波,张立异
(贵州省旱粱研究所,贵州贵阳550006)
为粒用高粱资源的科学利用和新品种选育提供参考,利用SSR分子标记对156份全国籽粒高粱进行全基因组基因分型。结果表明:33个SSR分子标记的扫描共获得186条多态性DNA条带。多态指数(PIC,polymorphism information content)值为0.01~0.73,平均值为0.45。材料间遗传相似系数GS(Genetic Similarity)变异范围为0.15~0.9,平均值为0.53。NJ(Neighbor Joining)聚类分析和主坐标分析(PCOA,Principal-Coordinates Analysis)将156份高粱资源划分为3个类群:类群I为来源于贵州、四川和云南的56份南方高粱;类群Ⅱ包含的48份全部是北方高粱,来源于辽宁、内蒙古、山西、北京和河北等地;类群Ⅲ包含52个南方和北方的高粱,来源于黑龙江、吉林、陕西、山东、湖北和云南等地。
籽粒高粱;分子标记;遗传多样性;群体结构
高粱(SorghumbicolorL.Moench)属于禾本科(Gramineae)高粱属(Sorghum)植物,是全世界种植的第五大禾谷类作物。由于高粱具有光合效率高、抗旱、抗涝、耐盐碱、耐瘠薄等多重抗逆性和适应性,因此被作为C4作物的模式作物进行研究。高粱栽培历史久远,分布区域广泛,在全世界范围内均有分布,其中主要分布于热带干旱和半干旱地区[1-3]。根据用途的不同,高粱栽培品种一般分为3种类型:甜高粱(能源用)、饲料高粱(饲用)以及作为粮食的籽粒高粱(食用)。在籽粒高粱中又将直链淀粉含量在0~5%的称为糯高粱[4],主要用作酿酒。在贵州,糯高粱是酿造茅台酒和习酒等酱香型高档白酒的主要原料之一,因而具有重要的经济价值。
遗传多样性是作物改良的基础,而杂种优势群的准确划分是选育优良组合,提高作物育种效率的前提。因此调查主要种质资源的遗传多样性,对选择杂交亲本、建立杂种优势群和改良品种等提供了重要的理论依据。同时,高粱的进化和适应不同环境的能力除取决于种内遗传变异的大小外,还依赖于种群的遗传结构是否丰富[5-6]。因此,评估籽粒高粱的遗传变异程度和特性,对籽粒高粱的新品种选育和种质资源保护具有重要意义。DNA分子标记作为常规技术,已经广泛地应用于高粱的遗传多样性和遗传群体结构的研究[7-8]。目前,在高粱研究中通常使用的分子标记主要有限制性片段长度多态性(Restriction fragment length polymorphism,RFLP)、随机扩增多态性DNA(Random amplified polymorphism DNA,RAPD)、扩增性片段长度多态性(Amplified fragment length polymorphism,AFLP)、简单重复序列(Simple sequence repeats,SSR)、单核苷酸多态性(Single nucleotide polymorphism,SNP)及多样性微阵列技术(Diversity Array Technology,DArT)等。Sinha等[9]利用RAPD标记调查了40个高粱资源的遗传多样性,聚类分析形成5个类群,在籽粒高粱和饲料高粱之间存在非常高的遗传差异。Barro等[10]利用28个农艺性状和29个SSR标记调查西非布基纳法索的124个高粱地方品种进行群体聚类分析并不能清楚地区分不同的类群。张晗等[11]年利用SSR标记,对国内外253份高粱品种进行的遗传多样性分析发现,中国高粱与国外高粱之间存在明显的遗传分化。Wang等[12]利用41个SSR标记调查了142个高粱亲本资源,群体结构分析显示形成了Kafir、Kaoliang、Feterita、Shallu、Hegari、Milo和Durra 7个亚群。Morris等[13]采用GBS技术获得的265 000SNP位点,对全世界970份高粱资源进行遗传多样性分析显示,根据地理来源和表型类型形成不同的群体结构。Bouchet[14]利用DArT标记对177份的高粱材料扫描,同时利用SSR、RFLP等不同的标记进行扫描,通过聚类比较获得一致的结果。
糯高粱是酿造贵州茅台等酱香型白酒的主要原料之一。近年来,由于贵州酒用糯高粱出现了育种资源匮乏、栽培品种单一并不断退化的问题,已经影响了酒用原料的供给,故扩展育种资源,选育优质高产的新品种已迫在眉睫。因此,笔者拟采用SSR分子标记对156份全国籽粒高粱资源进行基因分型,通过聚类分析和PCOA分析调查其遗传多样性和群体结构,构建籽粒高粱的杂种优势群,为提高酱香型白酒用糯高粱新品种的育种效率提供理论依据。
1 材料与方法
1.1 材料
供试的156份全国籽粒高粱材料,来源于辽宁、山西、贵州和四川等14个省(市区)。其中,南方72份,北方84份(表1)。这批高粱资源组成数量较大,农艺性状表型差异较大。就品质而言,糯高粱有82份,主要来源于南方;粘高粱有74份,主要来源于北方。株高1~3m,差异较大,株高较高的有红缨子等,也高较矮有河北农业大学选育的河农16等。穗型结构差异亦较大,从直立小穗型到侧弯长披散穗型。

表1 156份全国籽粒高粱名称及来源Table 1 Name and source of 156grain sorghum germplasm resources
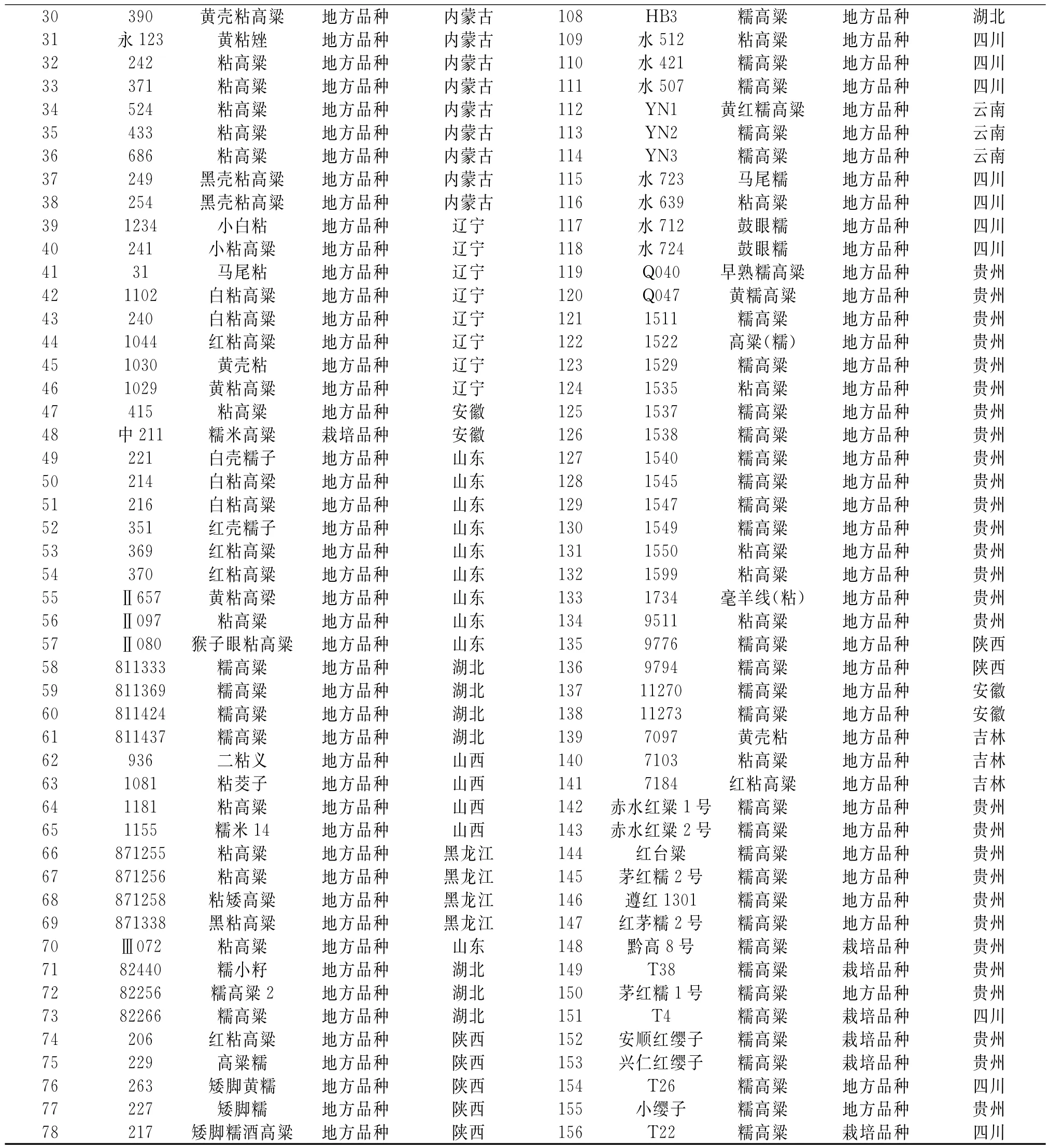
续表1
1.2 DNA的提取
DNA的提取参照陈宏[15]CTAB法,核算蛋白测定仪检测DNA的浓度,并用0.8%琼脂糖凝胶电泳检测纯度,-20℃冰箱中备用。
1.3 SSR标记的选择
选用的33个SSR标记选标记位点覆盖高粱1~10染色体,自Graingenes(http://www.graingenes.org)公布的引物序列,由贵州省旱粮研究所高粱研究中心设计,经过多次筛选与鉴定,适用于中国籽粒高粱研究。
1.4 SSR-PCR扩增
在Applied Biosystems Veriti型PCR仪上进行扩增反应。SSR扩增体系为10μL体系:50ng/μL DNA 1μL,10×buffer 1μL,2.5mmol/L Mg2+0.6μL,10mmol/L dNTP 0.15μL,2.5μmol/L primer R 0.4μL,2.5μmol/L primer L 0.4μL,Tap DNA聚合酶0.1μL,ddH2O补水至10μL。PCR反应程序:94℃预变性3min,94℃变性45s,50~60℃退火1min,72℃延伸2min,35个循环,72℃后延伸10min(退火温度因不同的标记而异)。根据所用分子标记的不同类型,扩增产物选用聚丙烯酰胺凝胶电泳进行检测。
1.5 统计分析
对于多态性扩增条带的记录,按照在相同迁移位置上,有带记为1,无带记为0,缺失记为9的方法,建立数据库。利用SSR分子标记对高粱种质的带型读取遗传多样性,每个标记的多态性信息含量(PIC,Polymorphism index contents)指数的计算公式为PIC=1-∑(Pi)2,其中Pi是群体中含有第i个等位基因的比例[16]。利用NTSYSpc V2.0软件[17],计算各材料间Jacard遗传相似系数(GS,Genetic similarity),计算公式为GS=2Nij/(Ni+Nj)。其中,Nij为材料i和j共有的扩增片段总数,Ni为材料i中出现的扩增片段数目,Nj为材料j中出现的扩增片段数目。NJ聚类分析和PCoA分析利用统计分析用软件DARwin6、NTSYS-pc V 2.0和SPSS13.0完成。
2 结果与分析
2.1 SSR分子标记的多态性
利用分布在高粱全基因组的33个SSR分子标记,对156份籽粒高粱资源进行扫描共获得186条多态性DNA条带,SSR引物中最少扩增多态性片段为1条,最多扩增5条,平均扩增3.6条。经统计分析,PIC值为0.01~0.73,平均值为0.45,说明位点等位变异显示出良好的多态性。其中,PIC值在0.6以上的标记有txp12、txp96、txp130和SM02004,多态性条带均在4条以上。
2.2 群体遗传多样性
根据扩增的多态性位点数据,经统计分析相似性系数变异范围为0.15~0.9,平均值为0.53± 0.12。品种1131和733间的遗传相似性系数最大,说明亲缘关系最近;而品种09794和227间的相似性系数最小,说明亲缘关系最远。经NJ聚类分析(图1),全国籽粒高粱资源聚集形成了3个类群。类群Ⅰ包含56个南方高粱材料,由贵州、四川和云南的高粱品种组成,其又可划分为4个亚群,其中1个亚群主要由云南高粱组成,1个亚群主要由贵州高粱组成。而另外2个亚群则包含西南不同地区的材料。类群Ⅱ由48个北方高粱品种组成,主要来源于辽宁、内蒙古、山西、北京和河北等地区,类群II中又包括了3个亚群,其中1个亚群主要由辽宁的高粱品种组成,另1个亚群主要包含山西、北京和河北的高粱,而第3个亚群中的高粱主要来源于内蒙古和辽宁。类群Ⅲ包含52个南方和北方的高粱,主要来源于黑龙江、吉林、陕西、山东、湖北和云南等地;类群Ⅲ中形成了7个亚群,其中2个亚群是陕西高粱,2个亚群主要是云南高粱,1个亚群是山东高粱。类群Ⅲ材料地理分布不一致的原因是由于各个高粱育种单位之间的种质资源交流,开展杂交选育,导致遗传物质发生交换。

图1 156个籽粒高粱的NJ聚类图Fig.1 NJ dendrogram of 156grain sorghum germplasm resources
2.3 群体的遗传结构
从图2看出,第一主坐标(PCo-1)和第二主坐标(PCo-2)分别解释14.2%和9.1%的群体遗传变异。材料间的位置远近情况反映材料间的亲缘关系,相距越远,则说明亲缘关系越远。与聚类分析结果相似,PCOA分析将籽粒高粱资源明确地划分为3个类群;类群I位于图的左侧,与其余2个类群清晰地区别开来,包含的56份材料几乎均为南方高粱材料。类群II和类群III较接近,类群II位于图的右上侧,由来源于北方的48份高粱材料组成;类群III位于图的右下方,由52份来源于北方和南方的高粱材料组成。在以南方高粱资源为主的类群I中,还包含6份北方高粱,基本上处于类群I的边缘。而在类群III中,南方和北方高粱呈混合分散的状态。由于北方高粱几乎都是粘高粱,而南方高粱基本山是糯高粱,故类群I绝大多数由糯高粱组成。类群II主要是由粘高粱组成,而类群III则由剩余糯高粱和粘高粱共同组成。

图2 156份全国籽粒高粱资源的PCOA分析聚类Fig.2 PCOA dendrogram of 156grain sorghum germplasm resources
3 结论与讨论
以国酒茅台为龙头的酿造业是贵州省的传统支柱产业和特色优势,而酿造茅台酒等酱香型高档白酒的主原料是优质糯高粱。近年来,由于贵州种植的酒用糯高粱品单一,红缨子等主栽品种的穗型和株型不仅限制了产量的提高,也不利于机械化生产,已影响了贵州特色高效山地农业的生产。加之,随着人民生活水平的提高,膳食结构的变化,对糯高粱需求量不断增加[4,18-21]。因此,利用分子遗传学研究手段,调查来源于全国的籽粒高粱遗传多样性和群体结构,构建籽粒高粱杂种优势群,为解决糯高粱存在的种质资源贫乏、产量水平低下等问题的解决提供理论依据。
3.1 高粱的遗传多样性
张晗等[11]指出,我国的高粱遗传多样性并不丰富的弊端,且明显低于东非、北美和南亚高粱。Li等认为,中国高粱人工育种过程中曾经遇到严重的母本瓶颈和单倍体育种,中国高粱种原遗传背景狭隘[22]。Mofokeng等在2014对南非的103个地方品种和育种品系的研究中,揭示了南非高粱种质资源具有较高的遗传多样性[23]。这说明世界范围内的高粱具有较高的遗传多样性,这对高粱的育种工作提供了更多的可能性。然而,我国高粱来源比较复杂,高粱品种资源缺乏准确完整的系谱资料,导致很多材料亲缘关系不甚明晰,同时随着高粱育种工作的进行,对其遗传背景的追踪也有待持续研究。本项研究利用分子标记进行全基因组扫描,根据SSR多态性分析,说明位点等位变异显示出良好的多态性,本研究结论在一定程度上证实了扩增多态性与PIC值呈一定相关性,这与陈英等,冯国郡等的研究结论一致[18-19],并且显示了全国籽粒高粱较为丰富的遗传多样性。并且根据聚类分析和主坐标分析都清晰地显示156份全国籽粒高粱根据地理来源的远近,聚集形成3个类群,来源于西南区的糯高粱聚集形成类群Ⅰ,来源于东北和华北地区的高粱形成类群Ⅱ,而剩余地区的高粱聚集形成了类群Ⅲ。在其他的研究中也有相似的报道。余传涨等[4]利用52个SSR标记调查了41个高粱品种的遗传多样性,通过聚类分析将这些高粱分为籽粒高粱和甜高粱2个类群。Bouchet等[24]利用AFLP、SSR以及DArT标记调查了177个全世界的高粱地方品种的核心资源,发现3种标记都能将这些划分为6个类群,并证实先前的进化假设。Sinha等[9]调查40个高粱种质资源的遗传多样性,通过聚类分析形成5个类群,显示了在籽粒高粱和饲料高粱间存在非常高的遗传差异。Morris等[25]对全世界970份高粱资源开展了遗传多样性分析显示,根据地理来源和表型类型形成10个不同群体结构。
3.2 杂种优势群
在高粱的研究中,由于重视其产量、品质、农艺性状等作物形态学上的特征,以致育种工作者通常采用不同品种间杂交的育种方式,侧重于筛选品质、产量和抗性等符合育种目标的品种,在提高高粱产量及品质的同时却导致了高粱材料的遗传多样性下降。因此,通过对种间的亲缘关系研究,了解杂交优势群体对育种工作有效性判断尤为重要。番兴明等[26]利用SSR标记将优质蛋白玉米自交系划分为个5群,通过遗传距离的远近情况推断出了杂种优势群。许崇香等[27]利用SSR标记研究了25个玉米自交系的遗传变异,初步进行了杂种优势群划分。李新海等[28-31]也在对玉米的杂种优势群体有较为详尽研究,但在高粱中相关研究较少,为预测澳大利亚杂交高粱的杂种优势,Jordan等[31]调查了70个自交系及来源于其162个杂交种的遗传多样性,研究结果证实在高粱中利用遗传多样性可一定程度上预测杂种优势。本研究发现,在类群I中,如编号为125~130号,142~156号等贵州糯高粱资源,聚集紧凑的贵州糯高粱资源遗传相似性极高,这与我们之前对贵州糯高粱的研究结论相一致[20]。结合国内多省籽粒高粱(粘高粱和糯高粱)的分群情况,根据籽粒高粱中的遗传距离的大小,揭示了3个杂种优势群体,为贵州省酒用糯高粱的杂交育种的亲本选择提供了理论依据。
[1]郭晓丽,时丽冉,王广才,等.干旱胁迫对不同高粱品种生理特性的影响[J].江苏农业科学,2014,42(2):91-93.
[2]ЛКИванюкович,董 钻.高粱的历史和起源[J].植物学杂志,1980,65(7):1014-1020.
[3]卢庆善.高粱学[M].北京:中国农业出版社,1998.
[4]余传涨,翟国伟,邹桂花,等.41个高粱品种遗传多样性的SSR标记检测[J].江苏农业学报,2010,26(2):248-253.
[5]GRANT V.The Evolutionary Process:A Critical Study of Evolutionary Theory(2nd ed.)[M].New York:Columbia University Press,1991.
[6]MILLAR C I,LIBBY W J.Strategies for conserving clinal,ecotypic,and disjunct population diversity in widespread species,In Falk D.A.And K.E.Holsinger(eds.)Genetics and Conservation of Rare plants[M].New York:Oxford University Press.1991:149-170.
[7]SCHLOTTERER C.The evolution of molecular markers-just a matter of fashion[J].Nature Reviews Genetics,2004,5(1):63-69.
[8]KASOMA C,LUNGU D,MWEETWA A,et al.Microsatellite Marker Applications in the Assessment of Sorghum Genetic Diversity[C]//International Conference on Advances in Agricultural,Biological and Environmental Sciences,2015.
[9]SINHA S,KUMARAVADIVEL N,EAPEN S.RAPD Analysis in Sorghum[Sorghum bicolor(L.)Moench]Accessions[J].International Journal of Bio-resource and Stress Management,2014,5(3):381-385.
[10]BARRO K C,SAGNARD F,CHANTEREAU J,et al.Genetic structure among sorghum landraces as revealed by morphological variation and microsatellite markers in three agroclimatic regions of Burkina Faso[J].Theoretical &Applied Genetics,2010,120(8):1511-1123.
[11]张 晗,王建成,王东建,等.中国高粱地方品种遗传多样性评价及中外高粱遗传变异水平比较[J].作物学报,2011,37(2):224-234.
[12]WANG L M,JIAO S J,JIANG Y X,et al.Genetic Structure Analysis of Sorghum Parent Lines Based on SSR Markers[J].Cereal Research Communications,2013,41(3):359-365.
[13]MORRIS G P,RAMUB P,DESHPANDEB S P,et al.Population genomic and genome-wide association studies of agroclimatic traits in sorghum[J].PNAS,2013,110(2):453-458.
[14]BOUCHET S,POT D,DEU M,et al.Genetic structure,linkage disequilibrium and signature of selection in Sorghum:lessons from physically anchored DArT markers[J].PLoS One,2012,7(3):e33470.
[15]陈 宏.基因工程试验技术[M].北京:中国农业出版社,2005.
[16]SMITH J S C,CHIN E C L,SHU H,et al.An evolu-tion of the utility of SSR loci as molecular markers in maize(ZeamaysL.):comparisons with data from RFLPs and pedigree[J].Theoretical and Applied Genetics,1997,95:163-173.
[17]RNHLF F J.NTSYS-pc:numerical taxonomy and multivariate analysis system version 2.1[M].New York:Exeter Publications,2000.
[18]陈 英,邱 琳,涂升斌,等.用SSR标记检测杂交籼稻三系亲本的遗传差异[J].应用与环境生物学报,2009,15(5):585-590.
[19]冯国郡,叶 凯,李桂英,等.新疆甜高粱种质资源遗传多样性的SSR分析[J].植物遗传资源学报,2012,13(4):549-554.
[20]肖 松,周棱波,张国兵,等.酱香型白酒用糯高粱种质遗传多样性分析[J].江苏农业科学,2016,44(4):45-49.
[21]董怀玉,徐秀德,姜 钰,等.高粱糯质资源创新及其利用研究[J].植物遗传资源学报,2007,8(3):321-324.
[22]LI R,HAN Z,ZHOU X,et al.Genetic diversity in Chinese sorghum landraces revealed by chloroplast simple sequence repeats[J].Genetic Resources and Crop Evolution,2010,57(1):1-15.
[23]MOFOKENG A,SHIMELIS H.A genetic diversity analysis of South African sorghum genotypes using SSR markers[J].South African Journal of Plant &Soil,2014,31(3):145-152.
[24]BOUCHET S,POT D,DEU M,et al.Genetic Structure,Linkage Disequilibrium and Signature of Selec-tion in Sorghum:Lessons from Physically Anchored DArT Markers[J].PloS One,2012,7(3):e33470.
[25]MORRIS G P,RHODES D H,BRENTON Z,et al.Dissecting genome-wide association signals for lossof-function phenotypes in sorghum flavonoid pigmentation traits[J].G3(Bethesda,Md.),2013,3(11):2085-2094.
[26]番兴明,张世煌.根据SSR标记划分优质蛋白玉米自交系的杂种优势群[J].作物学报,2003,29(1):105-110.
[27]许崇香,闵 丽,安英辉,等.利用SSR标记划分黑龙江省中早熟玉米自交系杂种优势群的研究[J].玉米科学,2011,19(2):45-49.
[28]李新海,袁力行,李晓辉,等.利用SSR标记划分70份我国玉米自交系的杂种优势群[J].中国农业科学,2003,36(6):622-627.
[29]郑淑云,王守才,刘东占.利用SSR标记划分玉米自交系杂种优势群的研究[J].玉米科学,2006,14(5):26-29.
[30]姜 敏,刘欣芳,王 贺,等.利用SSR标记划分辽宁省部分骨干玉米自交系的杂种优势群[J].沈阳农业大学学报,2010,41(1):8-12.
[31]JORDAN D,TAO Y Z,GODWIN I,et al.Prediction of hybrid performance in grain sorghum using RFLP markers[J].Theoretical and Applied Genetics,2003,106(3):559-567.
(责任编辑:刘忠丽)
Genetic Diversity and Population Structure of Grain Sorghum Germplasm Resources Based on SSR Marker
GAO Xu,ZHOU Lingbo,ZHANG Guobing,SHAO Mingbo,ZHANG Liyi
(GuizhouInstituteofUplandCrops,Guiyang,Guizhou550006,China)
The genome of 156grain sorghum germplasm resources was determined by SSR molecular marker to provide a reference for scientific utilization of grain sorghum germplasm resources and breeding of new grain sorghum varieties.Results:186polymorphism DNA bands are obtained by 33SSR molecular markers.The polymorphism information content is 0.01~0.73,with an average of 0.45.The variation range of genetic similarity is 0.15~0.9with an average of 0.53among different germplasm resources.156 grain sorghum germplasm resources are divided into three groups by neighbor-joining(NJ)and principalcoordinates analysis(PCOA).Group I including 56Southern grain sorghum germplasm resources is from guizhou,Sichuan and Yunnan mainly.GroupⅡincluding 48Northern grain sorghum germplasm resources is from Liaoning,Inner Mongolia,shanxi,Beijing and Hebei mainly.GroupⅢincluding 52Southern and Northern grain sorghum germplasm resources is from Heilongjiang,jilin,shaanxi,Shandong,Hubei and Yunnan.
grain sorghum;molecular marker;genetic diversity;population structure
S514
A
2016-08-31;2016-09-03修回
贵州省农业科学院课题[黔农科院院专项(2014)034];贵州省科学技术基金项目“酱香型白酒用高粱种质资源遗传多样性的调查及关键功能基因的发掘”[黔科合J字LKN(2013)26];贵州省科技计划课题“贵州省高粱工程技术研究中心”[黔科合农G字(2012)4004],“酱香型白酒用糯高粱新品种的选育”[黔科合NY(2015)3021-2];贵州省农业科学院课题“黔高7号的示范与推广”[黔农科院院专项(2013)013]
高 旭(1989-),女,研究实习员,硕士,从事作物分子育种研究。E-mail:15005182366@163.com
*通讯作者:张立异(1968-),女,研究员,博士,从事作物分子育种研究。E-mail:lyzhang1997@hotmail.com
1001-3601(2016)09-0371-0013-07
