滴水珠组织培养体系的优化
2016-04-13朱燕燕陈海丽
朱燕燕,罗 睿,陈海丽,刘 丹
(贵州大学生命科学学院,贵州贵阳550025)
滴水珠组织培养体系的优化
朱燕燕,罗 睿*,陈海丽,刘 丹
(贵州大学生命科学学院,贵州贵阳550025)
为缩短滴水珠(Pinelliacordata)的繁殖周期,促进其种质资源的保存与产业化利用,以滴水珠的叶片和叶柄为外植体,研究不同植物激素种类及其配比对滴水珠外植体组织培养的影响。结果表明:叶柄作为外植体较优;愈伤组织诱导及继代培养最优条件为MS+6-BA 2.0mg/L+NAA 1.0mg/L,只需7~15d即可转接;分化及增殖最优条件为MS+6-BA 2.0mg/L+IBA 0.2mg/L,增殖倍数达9.2倍,时间仅需14d;生根培养最优条件为MS+6-BA 0.1mg/L+IBA 0.5mg/L+活性炭0.5g/L,7d即可炼苗移栽。通过对各阶段进行分步优化,繁殖周期缩短为44d,有利于滴水珠的产业化生产。
滴水珠;组织培养;植物激素;再生体系;药用植物
滴水珠(PinelliacordataN.E.Br.)为天南星科(Araceae)半夏属多年生草本植物,主要分布于我国浙江和贵州等地,是我国特有的重要天然药用植物[1]。其块茎含多种氨基酸和生物碱[2](如,吲哚生物碱Neoechinulin A[3])、微量元素[4]及多种化合物,主治毒蛇咬伤[5]及用于肿瘤病人的消肿止痛[6],其凝集素显示出明显的抗虫性[7]。滴水珠对环境要求较高,主要生长在岩石边、岩隙中或岩壁上、林下溪旁以及潮湿草地,以无性珠芽繁殖为主[1]。随生境改变和过度采挖,其自然分布区越来越窄,仅分布于难以采挖的岩隙和岩壁上。因此,人工培育滴水珠种苗是对其进一步开发利用的重要技术,组织培养是培育种苗的关键环节。李伟平等[8]在郁建新[9]研究的基础上,对分化和生根培养基进行了筛选,但是其繁殖周期达89d;虽然王玉娇等[10]通过改变激素配比,得到愈伤组织诱导的最佳组合,但繁殖周期依然没有缩短,甚至更长,达7个多月[11]。因此,笔者拟通过改变激素种类和配比,重新筛选滴水珠组织培养各阶段的最优配方,旨在提高滴水珠的繁殖效率和缩短繁殖周期,为产业化生产提供技术支持。
1 材料与方法
1.1 供试材料
1.1.1 外植体 滴水珠植株采集于浙江省温州市永嘉县,2015年8月盆栽种植于贵州大学植物生理学实验室,待长出新叶后,选取幼嫩的叶柄和叶片备用。
1.1.2 试剂 MS培养基、6-苄基嘌呤、α-萘乙酸、2,4-二氯苯氧乙酸、吲哚丁酸和无水氯化钙等均为分析纯。
1.1.3 其他 栽培基质,按土∶有机肥∶锯末=10∶1∶2混合拌匀。
1.2 试验方法
1.2.1 外植体消毒 用软毛刷刷洗叶柄和叶片表面泥土,洗洁精浸泡30min,流水冲洗2h,再将材料放入超净工作台用75%酒精消毒45s,0.1%的升汞消毒7min,无水乙醇冲洗3次,最后放入培养皿中滤干水分备用。
1.2.2 试验设计 所有培养基均以MS为基础培养基,添加3%蔗糖30g/L+琼脂8g/L,控制pH5.8~6.0。培养条件均为培养温度(25±2)℃,光照强度2 000~2 500lx、光照时间为12h/d。
1)愈伤组织诱导。试验设9个处理(表1),即在基础培养基中分别添加不同配比的6-BA、NAA和2,4-D,以文献[8]中的最佳培养基为对照(CK)。外植体灭菌后,叶柄切成大小为1cm左右的小段,叶片切成1cm×1cm大小,接种于愈伤组织诱导培养基中,每种处理接种48管。
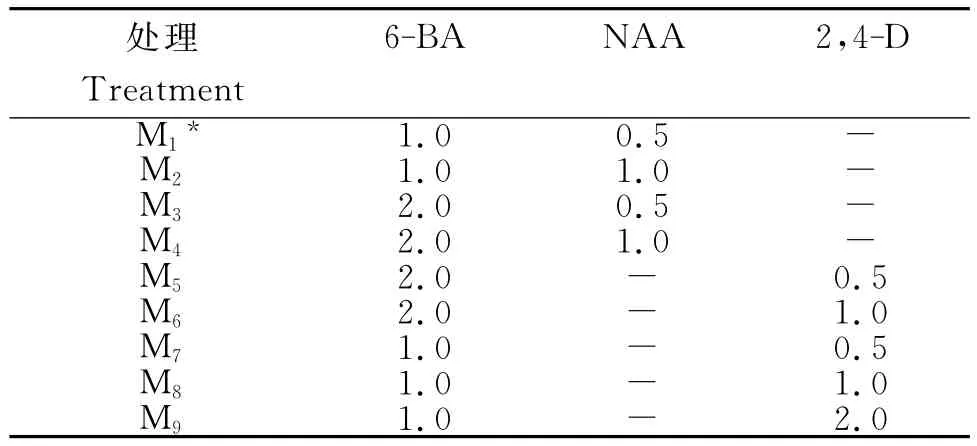
表1 滴水珠愈伤组织诱导培养基不同激素的种类与配比Table 1 Types and proportion of various hormones for callus induction ofP.cordatamg/L
2)不定芽分化与增殖培养。不定芽分化试验设6个处理(表2),即在基础培养基中分别添加不同配比的6-BA、NAA和2,4-D,以文献[8]中的最佳培养基为对照(CK)。不定芽增殖试验设3个处理,在不定芽分化培养基础上选取不定芽分化率较高的培养基、参考文献[8]中分化率高的P1及任意培养基P3等3种进行试验。愈伤组织形成后将其转移至不定芽培养基中进行不定芽分化培养,每种处理接种50个;待不定芽分化出绿色芽点后,将不定芽转接到增殖培养基进行增殖培养,每种处理接种50个。

表2 滴水珠不定芽分化和增殖培养基不同激素的种类与配比Table 2 Types and proportion of various hormones for adventitious bud differentiation and proliferation ofP.cordatamg/L
3)生根培养。试验设2个处理,T1,生根培养基为MS+0.1mg/L 6-BA+0.5mg/L IBA+ 0.5g/L活性炭;T2,生根培养基为1/2MS+NAA 0.25mg/L[8](CK),每种处理接种小苗72个。即待小苗长到一定高度后,转入生根培养基中培养。
4)炼苗和移栽。组培苗生长10d左右,取3批共180株生长健壮、根系形成良好且株高为5~10cm的组培苗,揭开盖子放置3~5d,然后取出组培苗用水洗净根部的培养基,转种于栽培基质,浇透水后置于20~25℃及50%湿度的遮荫环境下培养,每2d浇水1次。
1.3 数据统计分析
采用DPS软件进行统计分析。
愈伤组织诱导率=(产生的愈伤组织数/接种外植体数)×100%
芽分化率=(出现芽的愈伤组织块数/接种的愈伤组织块数)×100%
增殖倍数=(丛生芽总数/接种总苗数)×100
2 结果与分析
2.1 不同激素配比对愈伤组织的诱导效果
从表3可知,1)叶柄外植体。接种叶柄(图示A)外植体在9种培养基中均可诱导产生愈伤组织,M2、M7与M8间诱导率差异不显著,与其他处理间差异显著。其中,M4的诱导率最高,达60%;其次是M3,达55%。在6-BA浓度为1mg/L时,随NAA浓度的升高,愈伤诱导率降低,而2,4-D则相反;当6-BA浓度为2mg/L时,随NAA和2,4-D浓度的升高,愈伤诱导率均升高,且 NAA为1mg/L时,诱导率达最大(图示B)。当6-BA与NAA比值为2∶1时,愈伤组织诱导率均升高;而2,4-D+6-BA组合的诱导效果较6-BA+NAA组合差。2)叶片外植体。接种叶片外植体在9种培养基中,除M2外,其他处理均可诱导产生愈伤组织(图示C),M3与M6,M5与M9处理间差异性均不显著,与其他处理间差异显著。其中,M4诱导率最高,达57%。6-BA浓度为1mg/L,随着2,4-D浓度的增加,诱导率呈先减后增,其他处理则与叶柄的一致。说明,滴水珠叶柄和叶片诱导愈伤组织的最适激素组合为2mg/L 6-BA+1mg/L NAA。
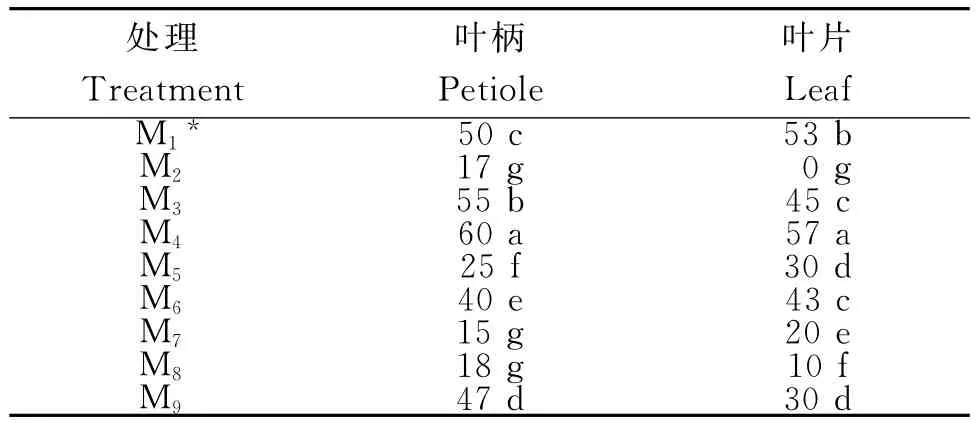
表3 不同激素配比滴水珠不同愈伤组织的诱导培养效果Table 3 Callus induction effects under different hormone combinations %
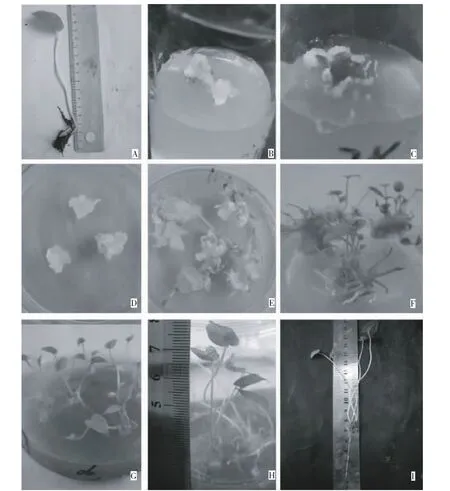
图示 滴水珠组织培养快繁体系的不同阶段Fig. Different stages of rapid propagation system ofP.cordata
2.2 不同激素配比对不定芽分化与增殖培养效果
1)不同激素配比不定芽的分化效果依次为P5(100%)>P1(90%)>P2(70%)>P3(67%)>P6(60%)>P4(45%)。在NAA浓度不变情况下,随6-BA浓度升高,不定芽的分化率不断降低。2mg/L 6-BA+0.2mg/L IBA分化率达100%。经差异显著性分析,P1和P5差异不显著,但二者与其他处理间差异显著;P2与P3差异不显著,但与其他处理间差异显著。P5不定芽7~12d即可进行增殖,且不定芽长势较好(图示E),芽整齐度高。说明,P5(2mg/L 6-BA+0.2mg/L IBA)为不定芽分化的最佳激素配比。
2)从表4可知,不定芽的长势和增殖倍数均依次为P5>P3>P1。P5不定芽增殖倍数最高,7d即达9.2倍(图示F);P1不定芽只能维持基本生长,并不增殖;P3不定芽增殖倍数为4.3倍,3组的增殖倍数差异较大,差异显著。

表4 不同培养基处理不定芽的增殖效果Table 4 Proliferation of adventitious buds in different culture medium
2.3 组培苗生根、炼苗与移栽
观察发现,T1的小苗发根株数为72个,生根率为100%,根系发达(图示G),有5~9根,主根长度最长可达10cm,植株高度可达8~12cm;而T2的小苗发根株数只有50株,生根率为69%,根的长势一般。选取经炼苗后生长健壮、根系形成良好,叶片2~3,株高8cm左右的植株(图示H)进行移栽,1个月后其成活率达100%(图示I)。
2.4 繁殖周期
在最佳培养基上,愈伤组织诱导时间为10d,不定芽分化时间为7d,增殖培养基上培养7d即可转接到生根培养基上,培养10d后可进行炼苗移栽,繁殖周期为44d。
3 结论与讨论
滴水珠的叶柄和叶片在添加激素2.0mg/L 6-BA+1.0mg/L NAA培养基上愈伤组织诱导率较高,且6-BA+NAA组合诱导效果优于6-BA+2,4-D组合。该研究结果与刘鑫欣等[12]愈伤组织诱导的激素以6-BA为主,NAA其次,而2,4-D影响不显著的结论一致,但与李伟平等[8,10]研究结果不同。可能本试验使用的材料与其所用材料的基因型不同,因而最适的激素种类不同。林娅等[13-15]的研究也证明,NAA诱导愈伤组织的效果优于2,4-D。
在添加激素2.0mg/L 6-BA+0.2mg/L IBA处理下,不定芽分化率较李伟平等[8,10]提高12%,分化时间缩短7d。表明,细胞分裂素与生长素相互作用,当二者比值高时可诱导不定芽正常分化[16];该研究细胞分裂素与生长素比(10∶1)高于李伟平等[8,10]的试验比例(2∶1),可能是导致不定芽分化率提高、时间缩短的主要原因。
通过优化激素种类和配比,获得增殖和继代培养的最优激素种类为2.0mg/L 6-BA和0.2mg/L IBA,2种激素的用量比例为10∶1。闻丽等[17]的研究表明,6-BA与IBA的组合适合油茶花药愈伤组织的进一步继代培养,6-BA与IBA组合是否适用于更多植物的继代培养,有待研究。
该研究表明,在MS培养基+0.1mg/L 6-BA+0.5mg/L IBA+0.5g/L活性炭条件下,不定芽生根数目、质量以及所用时间均优于李伟平等[8,10]。推测可能是因为活性炭创造的黑暗条件有利于根的诱导和根系的生长[18]。
滴水珠的愈伤组织诱导繁殖周期为44d,与之前滴水珠繁殖周期最快89d[8]相比,缩短培养周期1/2。王玉娇等[10]曾对滴水珠的愈伤组织诱导进行优化,但并未缩短其繁殖周期;其认为,材料增殖再多但不生根就不是一株完整的植株[19]。因此,要获得最优的培养体系,应对各环节进行优化。
[1]Flora of China编委会.《中国植物志》英文修订版[M].北京:科学出版社、密苏里植物园出版社联合出版,2010,23(20):40-41.
[2]楼之岑,秦 波.常用中药材品种整理和质量研究[J].北京:北京大学医学出版社,2003:.
[3]王 琦,赵云丽,高晓霞,等.中药滴水珠中Neoechinulin A的分离及测定[J].色谱,2009,27(4):509-512.
[4]徐照辉,朱梦娜,吴巧凤.滴水珠中总生物碱和微量元素的含量测定[J].广东微量元素科学,2005,11(10):37-40.
[5]田莎莎,李伟平,沈嫣婧,等.半夏、天南星和滴水珠抗五步蛇毒中毒作用的研究[J].中药药理与临床,2013,29(3):136-138.
[6]宋立人,洪 恂,丁绪亮,等.现代中药学大辞典[M].北京:人民卫生出版社,2001.
[7]LIN L,JIE L,TANG K X,et al.Molecular Cloning and Characterization of a Mannose-Binding Lectin Gene from Pinellia Cordata[J].Molecular Biology Reports,2008,35(4):641-647.
[8]李伟平,马丹丹,蒋福升,等.滴水珠组培快繁的实验研究[J].北京联合大学学报(自然科学版),2012,26(3):46-51.
[9]郁建新.滴水珠的组织培养和植株再生[J].植物生理学通讯,1988,13(4):37.
[10]王玉娇,李伟平,叶温平,等.滴水珠组织培养及快速繁殖的实验研究[J].中华中医药学刊,2012,30(12):2710-2713.
[11]杨 仙,马丹丹,蒋福升,等.滴水珠原生质体的分离纯化与植株再生[J].中国中药杂志,2014,39(21):4211-4215.
[12]刘鑫欣,崔晓星,刘金欣,等.不同植物生长调节剂对半夏愈伤组织诱导效应的研究[J].中国中医药信息杂志,2011,18(5):57-59.
[13]林 娅,郑玉梅,刘青林.影响月季愈伤组织诱导和分化的因素[J].分子植物育种,2006,4(2):223-227.
[14]白文苑,沈慧敏.苍耳愈伤组织诱导及继代培养研究[J].甘肃农业大学学报,2006,41(1):65-68.
[15]王玉珍,董玉惠.霍霍巴的组织培养与快速繁殖[J].植物生理学通讯,2005,41(6):835-840.
[16]张 峰,陈丽静.细胞工程[M].北京:中国农业大学出版社,2014.
[17]闻 丽,张日清,李典军.不同激素配比对油茶花药愈伤组织形成的影响[J].经济林研究,2005,23(4):21-23.
[18]刘用生,李友勇.植物组织培养中活性炭的使用[J].植物生理学通讯,1994,30(3):214-217.
[19]邢亚娟.中国山杨与美洲山杨杂交种新品系选育研究[D].哈尔滨:东北林业大学,2005.
(责任编辑:王 海)
Tissue Culture System Optimization ofPinelliacordata
ZHU Yanyan,LUO Rui*,CHEN Haili,LIU Dan
(CollegeofLifeScience,GuizhouUniversity,Guiyang,Guizhou550025,China)
In order to shorten the reproductive cycle ofP.cordataand promote the preservation and industrialization utilization of the genetic resources,leaves and petioles were used for explants,the effects of different types of plant hormones on the tissue culture were studied.Results:Petiole was proved to be the best explants for callus inducing.The best conditions for callus induction was MS+6-BA 2.0mg/L+NAA 1.0mg/L.Differentiation and propagation culture with medium MS+6-BA 2.0mg/L+IBA 0.2mg/L could increase the proliferation ratio which could reach 9.2.The rooting medium(MS)supplied with IBA 0.5mg/L+6-BA 0.1mg/L+AC 0.5g/L was optimal.The test-tube plantlets could be transplant after 7days of rooting culture.The reproduction cycle was shortened to 44d,which was beneficial for industrialization production ofP.cordata.
Pinelliacordata;tissue culture;phytohormone;regeneration system;medicinal plant
S567.2
A
2016-03-26;2016-08-20修回
国家自然科学基金项目“半夏珠芽发育的激素调节和关键调控基因克隆研究”(31560081);贵州大学创新基金项目“滴水珠珠芽发育的形态解剖学研究”(研农2016006)
朱燕燕(1989-),在读硕士,研究方向:植物生理学。E-mail:15761622057@163.com
*通讯作者:罗 睿(1974-),副教授,硕士生导师,从事发育生物学研究。E-mail:luorui_physiol@126.com
1001-3601(2016)09-0393-0101-04
