高氧肺损伤中肺泡形成基因P311的动态变化及意义*
2016-04-13曾宝梅王予川
曾宝梅, 王予川, 黄 栋**
(1.贵州医科大学, 贵州 贵阳 550004; 2.贵州省人民医院, 贵州 贵阳 550002)
高氧肺损伤中肺泡形成基因P311的动态变化及意义*
曾宝梅1, 王予川2, 黄栋2**
(1.贵州医科大学, 贵州 贵阳550004; 2.贵州省人民医院, 贵州 贵阳550002)
[摘要]目的: 探讨肺泡形成基因P311在高氧肺损伤中的作用。方法: 成年的昆明小鼠64只,随机分为空气组和高氧组,空气组置于室内空气中饲养,高氧组置于同一室内氧舱中持续吸入氧浓度>90%的医用氧气复制高氧肺损伤动物模型;分别于1 d、3 d、7 d和14 d后取2组小鼠肺组织,苏木精-伊红染色观察肺组织病理变化并鉴定造模是否成功;免疫组织化学染色和实时定量聚合酶链反应(real-time PCR)检测P311蛋白的分布和基因表达;酶联免疫吸附实验(ELISA)检测P311蛋白含量。结果: 高氧组小鼠随着吸入高浓度氧气时间的延长,肺组织病理改变逐渐加重,成功复制高氧肺损伤的动物模型;免疫组织化学染色显示P311在肺组织主要定位于肺泡壁及肺泡隔膜生长点处,在空气组小鼠肺组织中呈弱阳性反应,而在高氧组小鼠肺组织中呈强阳性反应;高氧组小鼠P311基因表达及蛋白含量较空气组小鼠增高,随吸氧时间的延长,P311基因表达及蛋白含量逐渐增高,在第7天时达高峰(P<0.05)。结论: 高氧肺损伤后P311基因表达增加。
[关键词]肺泡形成基因; 基因表达; 高氧症; 肺损伤; 小鼠
氧疗是肺源性及非肺源性疾病所致呼吸衰竭时不可缺少的治疗手段,然而长时间吸入高浓度氧气,机体氧自由基产生增多,可对肺组织造成损伤,甚至导致慢性肺疾病(chronic lung disease,CLD)[1-2]。高氧肺损伤是一个复杂的过程, 有诸多因素、系统共同参与和介导高氧肺损伤的病理过程, 高氧导致的肺损伤越来越受到临床医生的重视[3]。相关高氧诱导肺损伤发生机制及其干预策略的研究报道日渐增多,但收益甚少。通过查阅文献发现,P311作为肺泡形成过程中的重要基因可调节成纤维细胞的增生及转分化,减轻疤痕组织的增生,但其在高氧肺损伤修复中的作用知之甚少。本研究通过构建小鼠高氧肺损伤动物模型,在组织水平探索P311在高氧肺损伤中的变化。
1材料及方法
1.1实验动物与分组
普通级昆明小鼠购自贵阳医学院动物中心,将60日龄的小鼠随机分为空气组和高氧组,两组又分为1 d、3 d、7 d和14 d组,每组8只小鼠。
1.2方法
1.2.1高氧肺损伤动物模型高氧组小鼠置于氧舱中喂养,用测氧仪监测氧舱内的氧浓度使其维持在90%以上,氧舱内温度与室内温度相当,湿度60%左右,CO2浓度低于0.5%。每天定时开舱添加饲料和水,并更换小鼠垫料。空气组均置于同一室内空气中饲养。
1.2.2肺组织病理学检查各组小鼠分别于空气和高氧环境中饲养1 d、3 d、7 d和14 d后取左肺组织固定在4%多聚甲醛中, 苏木精-伊红染色后,光镜下观察各组小鼠肺组织的病理变化。并参照文献按照充血、水肿、出血、炎性浸润、肺泡结构破坏和组织增生等指标的轻重程度以及病变范围进行评分及分析。
1.2.3肺组织P311蛋白分布免疫组织化学方法检测肺组织P311蛋白的分布,P311多克隆抗体购自武汉BOSTER公司,工作浓度1∶200; 二抗及DAB显色试剂盒购自北京中杉金桥公司,实验中以PBS液代替一抗做为阴性对照,免疫组织化学染色方法检测肺组织中P311蛋白分布。
1.2.4肺组织P311mRNA表达采用Real-Time PCR方法。从肺组织中提取总RNA(按照动物组织RNA提取试剂盒的步骤操作),然后检测RNA的完整性、纯度及浓度。将符合要求的RNA逆转录成cDNA(按照逆转录试剂盒的步骤),然后进行扩增。
1.2.5肺组织P311蛋白表达ELISA方法检测P311蛋白,肺组织匀浆后采用双抗体夹心ELISA法检测,操作步骤严格按照试剂盒说明书进行。
1.3统计学处理

2结果
2.1各组小鼠的一般状况
空气组小鼠反应比较灵敏,活动良好,毛发光泽,鼻尖红润;高氧组小鼠随着吸氧时间的延长,逐渐表现为反应迟钝,精神萎靡,活动度下降,食量明显减少,体重增长缓慢,毛发发涩、无光泽,鼻尖发绀,呼吸急促;停止吸氧后,小鼠表现为呼吸稍困难,鼻尖明显发绀,头颤,站立不稳,反应差。
2.2肺组织病理变化
肉眼观察:空气组小鼠肺组织呈均匀淡红色,包膜光滑;高氧组小鼠的肺组织表面苍白,有散在甚至弥漫的出血点。光镜下观察:空气组小鼠肺组织肺泡发育成熟,无充血、水肿、出血、炎性浸润、肺泡结构破坏和组织增生等。高氧1 d组小鼠与空气组小鼠比较无明显异常;高氧3 d组小鼠与高氧1 d组小鼠比较,在肺血管、气管周围有炎性细胞浸润;高氧7 d组小鼠与高氧3 d组小鼠比较除了有炎性细胞浸润外,可见肺泡充血、水肿;高氧14 d组小鼠与高氧7 d组小鼠比较可见肺泡腔明显增大,部分肺泡融合、肺泡数量减少,肺间质细胞增生。高氧组小鼠随着吸氧时间延长,肺组织病变逐渐严重,表现为肺泡腔内炎症细胞渗出增多、间质水肿,典型小直径的肺泡数目显著减少,肺泡结构简单化和囊泡化。肺组织病理变化评分结果提示,高氧7 d、14 d组小鼠与同时段空气组小鼠比较,肺损伤明显,差异有统计学意义(P<0.05);高氧组3 d、7 d、14 d组内两两比较差异有统计学意义(P<0.05),见图1及表1。
2.3肺组织P311蛋白的分布
P311肺组织中主要定位于肺泡壁及肺泡隔膜生长点处,在空气组小鼠肺组织中呈弱阳性反应,部分细胞质呈浅染色。与空气组小鼠比较,高氧组小鼠随着吸氧时间的延长肺组织中P311逐渐呈强阳性反应,表现为细胞质中的棕色颗粒;从吸入高浓度氧后第3天,至第14天P311均呈强阳性反应,见图2。
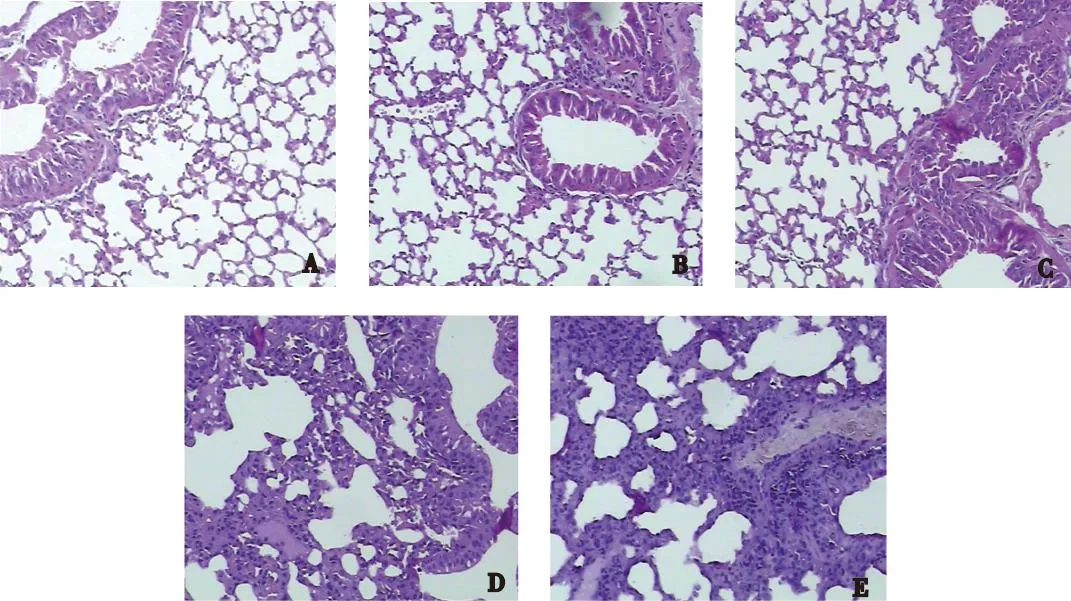
注:A为空气组,B为高氧1 d组,C为高氧3 d组,D为高氧7 d组,E为高氧14 d组图1 空气组与高氧组小鼠肺组织苏木精-伊红染色(×400) Fig.1 Hematoxylin-eosin staining of lung tissue in air group and hyperoxia group
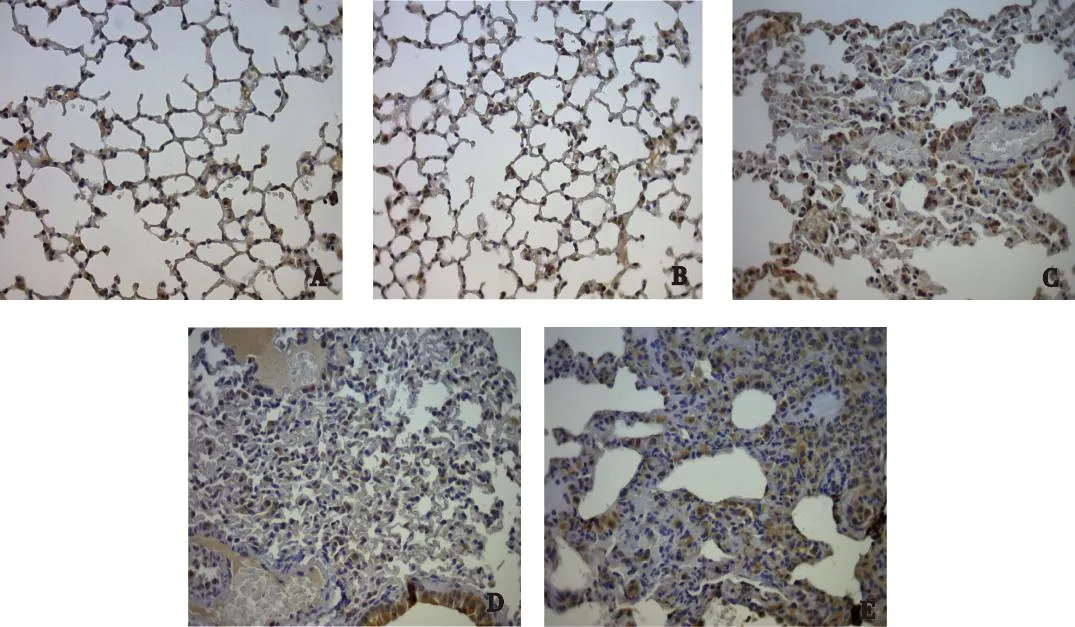
注:A为空气组,B为高氧1 d组,C为高氧3 d组,D为高氧7 d组,E为高氧14 d组图2 空气组与高氧组小鼠肺组织免疫组织化学染色(×400)Fig.2 Immunohistochemical staining for air group and hyperoxia group
2.4肺组织P311 mRNA的表达
空气组各时段小鼠肺组织中P311 mRNA表达无显著变化。高氧组小鼠随着吸氧时间的延长,P311 mRNA在肺组织里的表达逐渐增高,至吸氧第7天时,P311表达达高峰,各时段高氧组小鼠肺组织P311 mRNA表达均高于同时段空气组小鼠(P<0.05),见表2。
2.5肺组织P311蛋白的含量
酶联免疫吸附测定法检测显示,空气组小鼠肺组织P311蛋白含量无明显变化;高氧组小鼠肺组织随着吸氧时间的延长,肺组织中P311蛋白含量逐渐增高,至吸氧第7天时,P311蛋白含量达高峰。各时段高氧组小鼠肺组织中P311蛋白含量均高于同时段空气组小鼠(P<0.05),见表2。
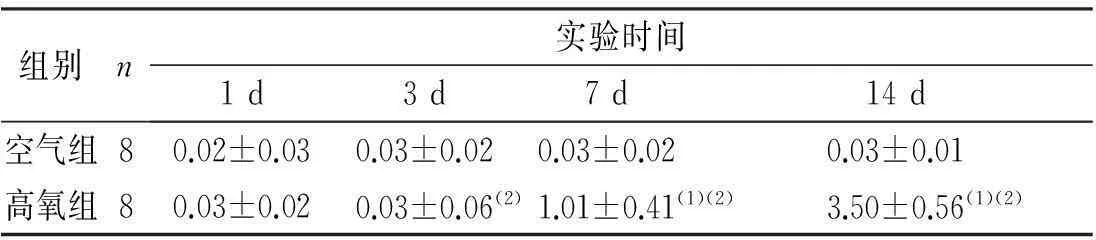
表1 两组小鼠肺组织病理变化评分(分)
(1)与空气组比较,P<0.05;(2)高氧组各时段内比较,P<0.05
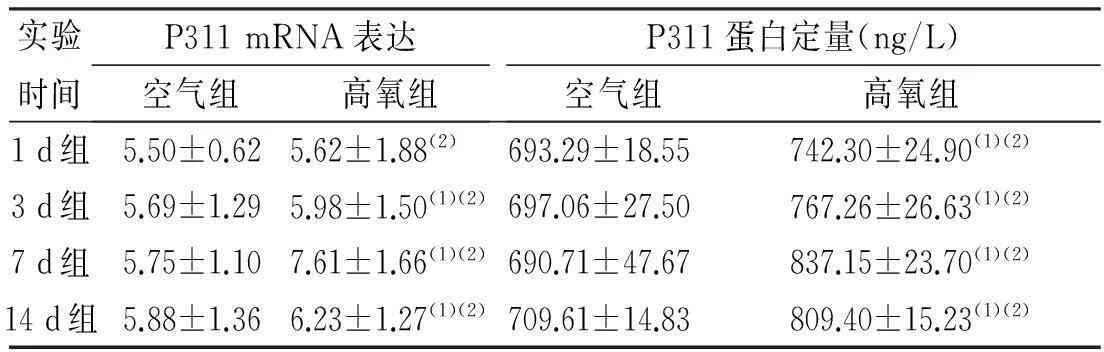
表2 两组小鼠肺组织P311 mRNA表达及
(1)与空气组比较,P<0.05;(2)高氧组各时段内比较,P<0.05
3讨论
尽管氧气对于挽救生命是必须的,但长时间吸入高浓度的氧气对于细胞、器官而言都具有危害性[4]。肺脏直接与外界相通,因此长时间暴露在高浓度氧气环境下最易受损[5-6]。高氧肺损伤早期病理改变为弥漫性肺泡炎症,晚期肺泡间质增生,肺纤维化。肺纤维化影响患者今后肺功能,如何减轻高氧肺损伤患者肺纤维化,改善肺功能,促进肺损伤的无纤维化修复一直是医学研究者关注的焦点。研究证实通过抑制性差减杂交技术(suppression substractive hybridization,SSH)克隆,在肺泡发生相关阶段特异表达的P311基因[7],全长2 025 bp,编码分子质量8 kDa、由68个氨基酸组成的多肽,在人和小鼠等物种间高度保守[8]。P311广泛表达于多种组织细胞中,是一种胞内蛋白,主要存在于胞浆,在核内亦有少量定位。P311主要参与受损神经系统的再生[9-10]、促进成纤维细胞表型转化[8,11],并且与肿瘤细胞的迁移、浸润等密切相关[12-13]。P311在肺组织中主要定位于肺泡壁及肺泡隔膜生长点处,相对于成熟肺组织,P311基因及编码蛋白在原始肺泡期到肺泡形成初期的表达明显升高,而后在肺泡期达到最高峰,并在整个肺泡形成阶段保持高水平表达,这些结果均提示P311可能与肺泡形成有关。研究还显示,高表达P311的肺成纤维细胞可转分化为肌成纤维细胞,肌成纤维细胞在肺泡发育及再生过程中及肺泡隔膜的形成中起着重要的作用,如次级隔膜发生及肺泡重建所必需的弹性蛋白均由肌成纤维细胞产生,提示P311在防止肺损伤或对受损肺组织的修复中发挥重要的作用。本研究将小鼠置于高浓度氧气环境中,小鼠第3天开始肺组织形态学发生改变,至第14天时可见不同程度的肺损伤,随着吸入高浓度氧气时间的延长,早期为炎性反应, 后期肺泡结构逐渐简单化、纤维化[14-15]。本实验成功建立高氧肺损伤小鼠模型,并通过免疫组化、real-time PCR及ELISA方法,检测到P311主要表达于肺泡壁及肺泡隔膜生长点处,与空气组比较,随着吸入高浓度氧气时间的延长肺损伤加重,P311 mRNA和蛋白表达均高于同时段空气对照组,并于高氧肺损伤发生的第7~14天时达高峰。实验提示P311基因可能是肺损伤修复的新的调控因子,可能通过调节肺泡Ⅱ型上皮细胞和肺成纤维间质细胞再生和转分化,促进肺泡分隔膜的形成,抑制肺间质纤维化形成来影响肺的修复。
4参考文献
[1] Kallet RH,Matthay MA. Hyperoxic acute lung injury[J].Respir Care, 2013(1):123-141.
[2] Berkelhamer SK,Kim GA,Radder JE,et al.Developmental differences in hyperoxia-induced oxidative stress and cellular responses in the murine lung[J].Free Radic Biol Med, 2013(61):51-60.
[3] 胡良冈,钱燕,龚永生.SPF级新生大鼠高氧肺损伤模型的建立[J].中国实验动物学报, 2008(6):441-443.
[4] Makena PS,Gorantla VK,Ghosh MC,et al.Lung injury caused by high tidal volume mechanical ventilation and hyperoxia is dependent on oxidant-mediated c-Jun NH2-terminal kinase activation[J].J Appl Physiol, 2011(5):1467-1476.
[5] Park HS, kim SR, Lee YC. Impact of oxidative stress on lung diseases[J]. Respirology, 2009(1):27-38.
[6] Tasaka S,Amaya F,Hashimoto S,et al.Roles of oxidants and redox signaling in the pathogencsis of acute respiratory distress syndrome[J].Antioxid Redox Signal, 2008(4):739-753.
[7] Zhao LQ,Leung JK, Yamamoto H,et al.Identification of P311 as a potential gene regulating alveolar generation[J].Am J Resp Cell Mol, 2006(10):48-54.
[8] Pan D,Zhe X,Jakkaraju S,et al.P311 induces a TGF-beta 1-independent,nonfibrogenic myofibroblast phenotype[J].J Clin Invest, 2002(9):1349-1358.
[9] Fujitani M,Yamagishi S,Che YH,et al.P3ll accelerates nerve regeneration of the axotomized facial nerve[J].J Neurocherrt, 2004(3): 737-744.
[10]Erhardt JA,Pittman RN.Ectopic p21 WAF 1 expression induces differentiation-specific cell cycle changes in PCI 2 cells characteristic of nerve growth factor treatment[J].J Biol Chem, 1998(7):23517-23523.
[11]Paliwal S,Shi J,Dhru U,et al.P311 bings to the latency associate protein and downregulates the expression of TGF-betal and TGF-beta2[J].Biochem Biophys Res Commun, 2004(4):1104-1109.
[12]Mariani LW, McDonough S,Hoelzinger DB,et al.Identification and validation of P3ll as glioblastoma invasion gene using laser capture micro-dissection[J].Cancer Res, 2001(5):4190-4196.
[13]Fang MZ, Liu C,Song Y,et al.Overexpression of gastrin-releasing peptide in human esophageal squamous cell carcinomas[J].Carcinogenesis, 2004(6):865-871.
[14]张向峰,朱光发,刘双,等.基质金属蛋白酶-2/9 及其组织抑制剂比例失衡在高氧所致急性肺损伤中的作用[J].中国危重病急救医学, 2008(10):597-600.
[15]Perkowski S,Scherpereel A,Murciano JC,et al. Dissociation between alveolar transmigration of neutrophils and lung injury in hyperoxia [J].Am J Physiol Lung Cell Mol Physiol, 2006(5):1050-1058.
(2015-07-20收稿,2015-10-07修回)
中文编辑: 刘平; 英文编辑: 刘华
The Dynamic Change and Significance of Alveoli-Forming GeneP311 Expression in Hyperoxia-induced Lung Injury
ZENG Baomei1, WANG Yuchuan2, HUANG Dong2
(1.GuizhouMedicalUniversity,Guiyang550004,Guizhou,China; 2.GuizhouProvincialPeople'sHospital,Guiyang550002,Guizhou,China)
[Abstract]Objective: To explore expression and significance of P311 gene of alveoli forming. Method: Sixty days old adult KM mice were divided into air group and hyperoxia group. Mice of air group were fed in the ordinary room air while mice of hyperoxia group were fed in oxygen chamber of the same room and continuously inhaled high concentration medical oxygen(oxygen concentration>90%). After 1, 3, 7and 14 days, the lung tissues were taken to observe histopathological changes by hematoxylin-eosin staining and check whether the model building was successful or not. The expression of P311 mRNA level and the P311 protein location were detected by real-time PCR and immunohistochemistry respectively, and protein content of P311 was detected by ELISA. Result: In hyperoxia group, with extension of time of inhalation of high-concentration oxygen, the lung tissue pathological changes aggravated gradually, which meant hyperoxia-induced lung injury model building was successful. Immunohistochemical staining of lung tissue showed that P311 was mainly located in the alveolar walls and alveolar septum growing point in the lung tissue, and took on weak positive reaction in air group but strong positive reaction in the high oxygen group. Compared with air group, P311 gene expression and protein content were significantly higher in hyperoxia group. Besides, with extension of time of inhalation of high-concentration oxygen, P311 gene expression and protein content increased gradually and reached the peak on 7thday (P<0.05). Conclusion: P311 gene expression is upregulated in hyperoxia-induced lung injury.
[Key words]alveoli-forming gene; gene expxession; hyperoxia; lung injury; mice
[中图分类号]R34-33
[文献标识码]A
[文章编号]1000-2707(2016)01-0027-05
*[基金项目]贵州省科技厅科研项目[黔科合J字(2011)2250号]
**通信作者 E-mail:hd522523@163.com网络出版时间:2015-07-01
网络出版地址:http://www.cnki.net/kcms/detail/52.5012.R.20150701.2038.031.html
