栌菊木共生丛枝菌根真菌的分离鉴定
2016-04-11葛立傲王国娟马焕成高秀琴陈梦帆伍建榕
葛立傲,王国娟,马焕成,高秀琴,陈梦帆,伍建榕*
(1.西南林业大学林学院,云南省高校森林灾害预警控制重点实验室,云南昆明650224;2.国家林业局西南地区生物多样性保育重点实验室,云南昆明650224)
栌菊木共生丛枝菌根真菌的分离鉴定
葛立傲1,王国娟1,马焕成2,高秀琴1,陈梦帆1,伍建榕1*
(1.西南林业大学林学院,云南省高校森林灾害预警控制重点实验室,云南昆明650224;2.国家林业局西南地区生物多样性保育重点实验室,云南昆明650224)
为了解栌菊木(Nouelia insignis Franch)共生丛枝菌根真菌(Arbuscular mycorrhizal fungi,AMF)的物种多样性,探明其形成乔木与丛枝菌根真菌多样性的关系,野外采集栌菊木根系及根际土壤,利用土壤湿晒法和根系透明染色镜检法,研究丛枝菌根真菌在土壤中的孢子密度及丛枝菌根真菌的侵染率,并采用形态学和分子生物学方法对分离的AMF孢子优势菌株进行鉴定。结果表明:传统形态学方法初步鉴定出栌菊木土壤中存在摩西球囊霉(Glomus mosseae)和幼套球囊霉(Claroideoglomus etunicatum)2种AM真菌;应用nested-PCR技术扩增18SrRNA中的NS31-AM1区,通过序列比对构建系统发育树A-1真菌与Glomus mosseae(DQ273793)亲缘性为97%,A-2真菌与Claroideoglomus etunicatum(AJ510231)亲缘性为99%。根据形态学与分子生物学的双重鉴定,确定侵染栌菊木根系的AM真菌是摩西球囊霉和幼套球囊霉。
栌菊木;AM真菌;nested-PCR;侵染率
丛枝菌根真菌(Arbuscular mycorrhizal fungi,AMF)分布广泛,能够侵染90%以上陆生植物根系形成菌根[1]。丛枝真菌能够提高植物的抗病性、抗旱性和抗逆性等抗性[2]。近年来,丛枝菌根真菌逐渐受到研究者的关注,以至于在很多真菌学、植物学上的研究都要考虑丛枝菌根的影响。胡文武等[3]研究广州菊科植物丛枝菌根侵染和根际土壤孢子密度发现,根际土壤孢子密度与土壤有机质含量呈显著负相关。郭世荣等[4]研究发现,AMF处理显著提高辣椒植株叶片的净光合速率、显著降低蒸腾速率。菊科植物多为草本和灌木植物,只有栌菊木(Nouelia insignis Franch)单种属长成乔木。栌菊木是干热河谷攀枝花地区我国特有的单种属菊科中稀有的木本残遗种,具有很强的抗干热性。其能在干热河谷如此恶劣的环境下生存,除与植物本身生理特性有关外,还与植物根际土壤中的丛枝菌根有着不可磨灭的关系[6]。栌菊木作为在干热河谷地区生长的唯一乔木菊科树种,但对栌菊木方面的研究报道极少,尤其是应用分子生物学方法研究栌菊木丛枝菌根真菌的报道[5]。
近年来,基础PCR的各种分子技术已经广泛应用于丛枝菌根真菌的研究,而核糖体基因分析为AM真菌属或种设计特异性引物提供了可能[7]。运用普通PCR和巢式PCR(nested-PCR)相结合,实现AM真菌在根内和土壤中的特异性检测,为栌菊木AM真菌的准确检测提供技术支撑[8]。为了解栌菊木共生的丛枝菌根真菌的物种多样性,探明其形成乔木与丛枝菌根真菌多样性的关系,为栌菊木的保护及开发利用提供参考,笔者利用形态学鉴定法和分子生物学方法相结合,对栌菊木AM真菌进行了分离鉴定。
1 材料与方法
1.1 样品采集
2015年4月至2016年3月,分别6次在攀枝花干热河谷地区采集栌菊木成株根际10~30cm土层土样约2 000g放入自封袋中,同时采集栌菊木成株主根系、侧根及须根,并将部分根系立即放入FAA(70%酒精90mL、福尔马林5mL、冰醋酸5mL)中保存固定,土样带回实验室后放入阴凉处风干,根样放入4℃条件下保存备用。
1.2 根系侵染
取出根系,加入15%KOH进行解离,在90℃水浴中解离2h,自然冷却,清洗4~5次。加入2%乳酸进行酸化20min,清洗4~5次。加入0.05%苯胺蓝(乳酸333mL、甘油333mL、蒸馏水333mL、苯胺蓝0.5g)于水浴锅中染色1h。染色后用乳酸脱色,最后取出镜检[9]。然后计算AM侵染率,即被侵染的根段长(包括有菌丝、丛枝、泡囊及根内孢子的根段)占总根段的比率。
1.3 AM真菌孢子的鉴定
1.3.1 形态学鉴定采用湿晒沉淀法将孢子从栌菊木根际(围)土壤中分离出来,在双管解剖镜下观察孢子大小、颜色、孢壁的厚度和层数,进行初步分离,待用[10]。
1.3.2 分子学鉴定
1)单孢DNA的提取。用解剖针挑取单个AM真菌孢子,用无菌水漂洗4~5次,放入高温灭菌的1.5mL离心管中,加入STL缓冲液200μL,在60℃水浴中加热15min,每2min涡旋混匀,简单离心(3 800r/s、20s);加入蛋白酶K溶液2μL,60℃水浴中预热45min,简单离心,去除离心管盖子上的水珠,加入Buffer BL溶液225μL,简单离心;加入无水乙醇225μL,简单离心,将小收集柱放入2mL收集管中,转移整个样(包括沉淀)到收集管中,离心(3 800r/s)1min,丢弃下液,用Buffer HB漂洗500μL,离心(3 800r/s)1min弃下层液,将收集柱放入新的2mL收集管中,用Wash Buffer(需用无水乙醇稀释)700μL漂洗2次,离心(3 800r/s)1min。将收集柱放入1.5mL收集管中,用Elution Buffer 25μL洗脱2次,将收集液于-20℃条件下保存、备用。
2)目标DNA片段的nested-PCR扩增。分别将上述提取的AM真菌单孢DNA进行第1次普通PCR,将扩增产物稀释50倍作为第2次PCR模板,进行nested-PCR。第1次PCR引物为Geol1:5′ACC TTG TTA CGA CTT TTA CTT CC 3′,GeoA2:5′CCA GTA GTC ATA TGC TTG TCT 3′,第2次PCR引物为NS31:5′TTG GAG GGC AAG TCT GGT GCC 3′,AM1:5’GTT TCC CGT AAG GCG CCG AA 3′。
第1次PCR扩增,反应体系为50μL,其中,MIX 16.2μL,Geol1 2.5μL,GeoA2 2.5μL,DNA 4μL,ddH2O 24.8μL。反应条件:盖子温度105℃;94℃4min;94℃30s,58℃1min,72℃1min,30个循环;72℃10min;4℃保存。第2次PCR扩增,反应体系为50μL,其中,MIX 20.2μL,NS31 2.5μL,AM1 2.5μL,ddH2O 23.8μL,DNA 1μL(第1次PCR产物),反应条件与第1次PCR相同。然后进行琼脂糖凝胶电泳检测。
3)目标DNA片段的测序及系统发育树构建。将PCR产物纯化回收由上海生工生物工程技术有限公司进行测序。测序结果与西弗吉利亚大学网站(http://www.invam.wvu.edu)上以及NCBI上查询的序列进行比对,采用MEGA 6中的极大似然法对所有序列进行系统进化分析。
2 结果与分析
2.1 栌菊木AM真菌孢子的形态特征
经镜检,栌菊木根内具有丛枝菌根结构,表明栌菊木根能形成丛枝菌根。丛枝菌根真菌侵染率越高的树木生长越好,枝叶越茂盛。栌菊木土壤中存在大量AM真菌孢子,其中主要优势菌种经形态学鉴定,分别属于摩西球囊霉(Glomus mosseae)和幼套球囊霉(Claroideoglomus etunicatum)。
1)摩西球囊霉。孢子圆形或近圆形,淡黄色至黄褐色,直径250~325μm;有3层孢壁,外层孢壁无色透明,成熟后一般脱落,第2层孢壁淡黄或浅黄棕色,第3层孢壁黄棕色至浅橘黄棕色,连点呈漏斗状,连点直径为16~32μm(图1)。
2)幼套球囊霉。孢子圆形或近圆形,淡黄色或黄色,直径90~155μm;有2层孢壁,外层孢壁无色透明,内层孢壁黄色或黄棕色;未成熟后垣孢子的外壁有完整的连孢菌丝,成熟后脱落(图2)。

图1 栌菊木土壤中摩西球囊霉(Glomus mosseae)的形态Fig.1 Morphology of Glomus mosseae in N.insignis soil

图2 栌菊木土壤中幼套球囊霉(Claroideoglomus etunicatum)的形态Fig.2 Morphology of Claroideoglomus etunicatum in N.insignis soil
2.2 栌菊木丛枝菌根的发育及侵染情况
对栌菊木根系透明染色发现有大量丛枝结构(图3),表明栌菊木根系可以形成丛枝菌根。挑选50段根系进行观察,其根系基本均被侵染,其中有泡囊-丛枝结构的47根,栌菊木丛枝菌根的菌丝侵染率高达94%。
2.3 AM真菌单孢DNA nested-PCR
经普通PCR发现,由于AM真菌DNA含量较少,在琼脂凝胶中没有观察到DNA条带。故使用引物AM1、NS31进行nested-PCR扩增,AM真菌相应的特异性DNA序列被扩增出来,片段大小为500~750bp(图4)。
2.4 AM真菌的系统发育树
将栌菊木2种AM真菌扩增的DNA序列编号为A-1和A-2,以2个孢子NS31-AM1区域的DNA序列在GenBank上进行blast比对,与相关菌种构建系统发育树(图5),A-1和A-2聚成一支,具有较高的支持率。其中,A-1与Gloums mosseae(DQ273793)同源性最高,为97%,初步鉴定A-1为摩西球囊霉(Gloums mosseae)。A-2与Claroideoglomus etunicatum(AJ510231)同源性最高,为99%,初步鉴定A-2为幼套球囊霉(Claroideoglomus etunicatum)。

图3 栌菊木根系的丛枝结构(40×)Fig.3 Arbuscular structure of N.insignis root system(40×)

图4 栌菊木AM真菌单孢DNA nested-PCR扩增电泳图谱Fig.4 Single-spore DNA electrophoretogram of N.insignis AMF amplified by nested-PCR
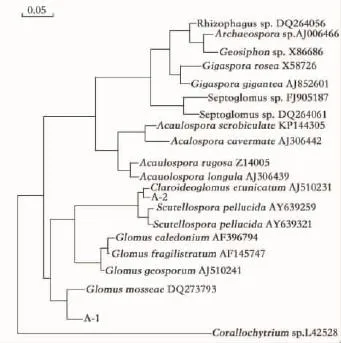
图5 栌菊木2株AM真菌与其他近缘种的系统发育树Fig.5 Phylogenetic tree of two N.insignis AMF trains and other closely related species
3 结论与讨论
随着现代分子生物学技术的不断发展,各种生物分子学技术被应用到生物物种的鉴定方面。但是丛枝菌根真菌的分子鉴定工作,在国内还比较少见。本研究是国内首次对栌菊木丛枝菌根真菌进行形态学和分子学双重鉴定,为今后栌菊木菌落的进一步研究奠定了基础。根据AM真菌的形态学观察,侵染栌菊木的AM真菌初步鉴定为摩西球囊霉和幼套球囊霉。后期的分子学鉴定也为形态学鉴定提供了证明。
AM真菌的分离鉴定是保护以及利用微生物资源最基本也是最重要的工作,AM真菌几乎可以存在于土壤中任何地方,且具有丰富的物种多样性[11]。但是,AM真菌与宿主植物严格共生,不能独立完成一个生活周期,目前还不能对AM真菌进行纯培养。因此,对其鉴定工作有一定困难。近年来,随着分子生物学的发展,国内外大批学者开始尝试从基因水平上认识和鉴定新的物种[12]。采用NS31-AM1区域是真核生物18SrRNA的一部分,其片段较小(约550bp),又是丛枝菌根真菌菌种的种间可变区域,可以作为丛枝菌根菌种的鉴定依据[13]。目前,AM真菌分子鉴定的困难之处在于其基因信息数据库不完整,许多菌种和菌株没有录入基因信息库,本研究也通过在Genbank以及西弗吉利亚大学网站内找到相对完整的基因库来进行分子学鉴定。而且,并非所有的AM真菌都能侵染土壤中的植物根系,同时不同植物品种的AM真菌侵染方式不同。因此,宿主植物与AM真菌共生的关系具有一定选择性,通过鉴定,收集,保护各种AM真菌具有重要的意义。
综合形态学特征及DNA序列比对结果,侵染栌菊木的2种AM真菌分别是摩西球囊霉(Gloums mosseae)和幼套球囊霉(Claroideoglomus etunicatum)。2个AM真菌为栌菊木中的优势菌种,在其他抗干旱植物上也发现有共生的现象,说明2个菌种对植物的抗干旱性有促进作用,今后可在其他植物上接种,放在相同抗旱条件下对比,测定植物的生物量,为干热地区植被的恢复提供参考。
[1]刘润进,李晓林.丛枝菌根及其应用[M].北京:科学出版社,2000.
[2]KOIDE R T,MOSSE B.A history of research on arbuscular mycorrhiza[J].Mycorrhiza,2004,14:145-163.
[3]胡文武,辛国荣,郭健桦,等.广州地区七种菊科入侵植物丛枝菌根侵染和根际土壤孢子密度的生境差异性分析[J].热带亚热带植物学报,2015,23(2):183-190.
[4]郑舜怡,郭世荣,张钰,等.丛枝菌根真菌对辣椒光合特性及根际微生物多样性和酶活性的影响[J].西北植物学报,2014,34(4):0800-0809.
[5]高宝莼,方文培,孔宪需,等.四川植物志[M].成都:四川人民出版社,1980.
[6]马焕成,曾小红.干旱和干旱河谷及其植被恢复[J].西南林学院学报,2005,25(4):52-55.
[7]蔡柏岩,阎秀峰,葛菁萍,等.黄檗根围丛枝菌根真菌的分离与分子鉴定[J].菌物学报,2008,27(6):884-893.
[8]郑世学,董秀丽,喻子牛,等.四种AM真菌接种剂的田间效应及其分子检测研究[J].土壤学报,2004,41(5):742-749.
[9]BERCH S M,KENDRICK B.Vesicular-arbuscular mycorrhizae of Southern Ontario ferns and fern-alliies[J].Mycologia,1982,74(5):769-776.
[10]刘润进,陈应龙.菌物学[M].北京:科学出版社,2007.
[11]OBA H,TAWARAYA K.Semi-quantitative analysis of arbuscular colonization of onion roots inoculated with single or mixed species based upon PCR-RFLP[J].Soil science,2002,48(1):51-56.
[12]YOKOYAMA K,TATEISHI T.A molecular marker diagnostic of a specific isolate of an arbuscular mycorrhizal fungus,Gigaspora margarita[J].Ferms microbiology Letters,2002,12(2):171-175.
[13]龙良鲲,姚青,羊宋贞,等.一株丛枝菌根真菌的形态与分子鉴定[J].华南农业大学学报,2006,27(4):40-42.
(责任编辑:冯 卫)
Isolation and Identification of Symbiosis Arbuscular Mycorrhizal Fungi(AMF)in Nouelia insignis Soil
GE Li’Ao1,WANG Guojuan1,MA Huancheng2,GAO Xiuqing1,CHEN MengFan1,WU Jianrong1*
(1.Yunnan Key Laboratory of Forest Disaster Warning and Control,College of Forestry,Southwest Forestry University,Kunming,Yunnan650224;2.Southwest Key Laboratory of Biodiversity Conservation,State Forestry Administration,Kunming,Yunnan 650224,China)
The spore density and infection rate of AMF in root system and rhizosphere soil of N.insignis were studied by the soil drying in shade and root system transparency staining microscopy methods anDThe strains with spore superiority of isolated AMF were identified by morphology and molecular biology methods to discuss AMF diversity of arbuscular mycorrhizal fungi in N.insignis soil and explore the relationship between tree and AMF diversity.Results:There are two AMF species of Glomus mosseae and Claroideoglomus etunicatumin N.insignis soil.The results from amplifying NS31-AM1area in 18SrRNA by nested-PCR show that the homology between A-1fungus and Glomus mosseae(DQ273793)in GenBank reaches 97%anDThe homology between A-2fungus and Claroideoglomus etunicatum(AJ510231)is up to 99%.The AMF to infect the root system of N.insignis are Glomus mosseae and Claroideoglomus etunicatum according to the double identification of morphology and molecular biology.
Nouelia insignis;Arbuscular mycorrhizal fungi(AMF);nested-PCR;infection rate
Q939.5
A
1001-3601(2016)10-0426-0066-04
2016-06-16;2016-09-20修回
国家自然科学基金项目“干热河谷区木棉-丛枝菌根真菌共生系统的水分关系研究”(31260175),“地生兰-菌根真菌-松三联共生关系研究”(31360198),“云南热区木棉不同基因型的抗旱性比较”(31560207);云南省高校干热河谷植被恢复创新团队项目“干热河谷木棉定向培育和产业化技术开发研究”(2016CYH14);云南省重点学科森林保护学项目(XKZ200905);云南省林学一流学科建设项目(YN2016);云南省高等学校森林病虫害综合治理教学团队项目(YN2012)
葛立傲(1991-),男,在读硕士,研究方向:园林植物保护学。E-mail:geliaogao@163.com
*通讯作者:伍建榕(1963-),女,教授,从事森林病理学与资源微生物利用研究。E-mail:wujianrong63@aliyun.com
