贵州烟田非烟植物和烟草白粉病菌的RAPD分析
2016-04-11范成平卢志伟
黄 团,范成平,卢志伟,左 锐
(1.百色学院农业与食品工程学院,广西百色533000;2.贵州省生物技术研究所,贵州贵阳550006;3.贵州省烟草公司安顺市公司,贵州安顺561000;4.贵州中烟工业有限责任公司,贵州贵阳550000)
贵州烟田非烟植物和烟草白粉病菌的RAPD分析
黄 团1,2,范成平3,卢志伟4,左 锐2
(1.百色学院农业与食品工程学院,广西百色533000;2.贵州省生物技术研究所,贵州贵阳550006;3.贵州省烟草公司安顺市公司,贵州安顺561000;4.贵州中烟工业有限责任公司,贵州贵阳550000)
为确定烟田非烟植物的白粉病菌能否浸染烟草,并分析烟田植物与烟草白粉病菌间的亲缘关系,收集烟田及周边非烟植物与烟草的13份白粉病菌,利用RAPD技术对其进行分子标记分析,并通过人工接种鉴定其浸染能力。结果表明:参试的11份材料相似系数为0.030 8~0.720 9,多样性较丰富,其对烟草的致病能力变化也较大;根据多态性,11份材料中地雷花、水蛇麻与烟草白粉病菌归为一类,亲缘关系较近,且容易浸染烟草,白粉病菌间的多态性与浸染能力存在一定的相关性。
非烟植物;烟草;白粉病菌;分子标记
烟草作为一种特殊的消费品,是我国的主要经济作物,近年来种植面积和产量均居世界前列[1]。在减少有害成分、保障大众健康的基础上,烟叶质量的控制非常重要。烟草白粉病使烟叶缺乏弹性、组织坏死,降低甚至失去烘烤价值[2],是严重影响烟叶质量的主要病害之一,其不仅能浸染烟田烟株,还能浸染收获后堆放、烘烤的烟叶[3-5]。目前,主要通过白粉病菌菌株在鉴别寄主上的抗感反应[6-7]判断白粉病菌所属生理小种,也有通过结合ITS、RAPD等分子标记手段[811]进行鉴定,或根据基因组中特有保守序列设计引物鉴定[12];这些工作多以某种或某类作物[13-14]所浸染的白粉病菌为对象。而在生产过程中,烟田及周边存在的多种非烟作物及杂草也是白粉病菌的主要携带植物[15],其携带的白粉病菌是否会浸染烟草及白粉病菌间的亲缘关系未见相关报道。因此,对贵州贵阳及安顺烟田中烟株及其非烟作物和杂草上收集的白粉病菌,进行人工接种浸染能力试验和RAPD分子标记技术,探讨不同非烟植物与烟草白粉病菌间的遗传多样性和亲缘关系,同时初步建立白粉病菌分子检测技术和方法,为白粉病菌不同生理小种的鉴定及烟草白粉病的防治提供试验及分子学依据。
1 材料与方法
1.1 试验材料
烟草品种为南江3号,由贵州省烟草公司安顺市公司提供。
白粉病菌采集自贵州安顺、贵阳周边烟田中的烟株、杂草及附近农作物上自然发病植株,植物包括羊蹄、洋姜、大豆、烟草、西红柿、水蛇麻、风轮菜、地雷花、葵花、土荆芥、指甲花、南瓜和黄瓜等13种。
试剂主要有Tiangen公司产的Taq DNA聚合酶、10×PCR buffer和100bp DNA ladder,上海生工生物工程公司产的dNTPs。选用的20条随机引物(表1)长度为10bp,由上海捷瑞生物工程有限公司合成。
1.2 人工接种白粉病菌试验
试验在贵州省农业科学院温室大棚进行。烟苗用花钵栽培,每钵1株,到烟苗生长至5叶时,选择未发病、长势均匀的烟苗接种白粉病菌。每种非烟作物或杂草上的病菌接种1株烟苗,每株接4片叶,1片接种烟草白粉病菌(CK),其余3片接种需要鉴定的非烟植物白粉病菌,每片叶接种6个点,重复3次。白粉病菌采用菌液法接种:将供试病菌用无菌水洗下,镜检计数后稀释成106个/mL浓度的孢子悬液,滴在烟叶上表面,每个点每次接种1滴菌液,待第1次接种的菌液干后再滴第2滴,每滴菌液25uL,共50uL。接种后用干净透明的薄膜单株间隔开,置于温室大棚内,保持小空间内的温度和湿度,形成促进病菌孢子萌发的阴凉潮湿环境[5]。第2周开始,每周观察、记录病菌在叶片上的生长情况,直至第6周;根据存活率及存活时间判断其浸染能力。
1.3 基因组DNA提取及测定
在烟田非烟植物白粉病发病时,轻扫感病叶片表面白粉病菌,收集至1.5mL尖底离心管,置于-20℃保存;在提取各病菌的DNA时,每离心管加入少量磨细的无菌石英砂和约50uL提取液,用研磨棒磨碎样品后,参考改进的CTAB法[16];1.0%的琼脂糖凝胶电泳及紫外分光光度计DU800Spectrophotometer检测DNA纯度和浓度。
1.4 RAPD扩增、产物检测及分析
试验在百色学院农业与食品工程学院生物化学与分子生物学实验室及贵州省生物技术研究所进行。经过优化后,确定了烟草白粉病菌的RAPDPCR反应体系为10×PCR buffer(含20μmol/L的Mg2+)2.5μl,10mmol/L的dNTPs 0.5μL和10μmol/L的随机引物1μL,Taq DNA聚合酶0.75U,模板DNA 50ng,最后补足dd H2O至25 μL。在BIO-RAD的T100型PCR仪上进行扩增。PCR扩增程序为95℃预变性4min;95℃变性45s,36℃退火45s,72℃延伸90s,35个循环;72℃延伸8min;扩增后,产物保存于4℃冰箱中。最后,利用2.0%的琼脂糖凝胶电泳分离扩增产物,并在紫外凝胶成像系统中成像观察、保存。
统计凝胶电泳图谱上重复性好、有差异且易识别的多态性条带,在相同迁移率的位置上,有带记为1,无带记为0,组成1和0的原始矩阵。采用NTSYS-pc 2.10e软件对烟田11种不同非烟植物的白粉病菌进行分析,采用UPGMA方法进行聚类,并通过Treeplot生成聚类图,综合人工接种试验及分子标记聚类分析白粉病菌的亲缘关系及致病性。
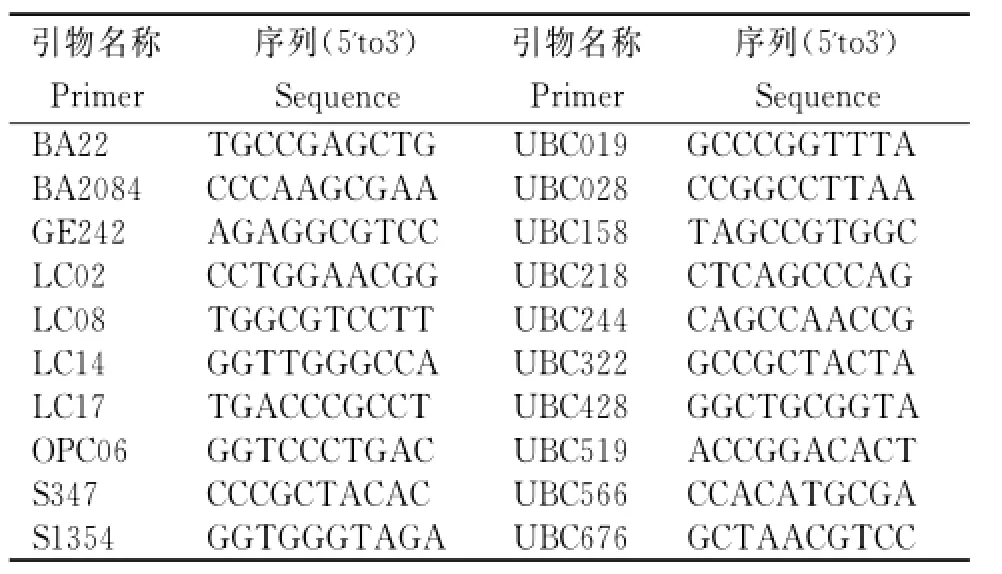
表1 试验所用引物的序列Table1 The sequences of primers in test
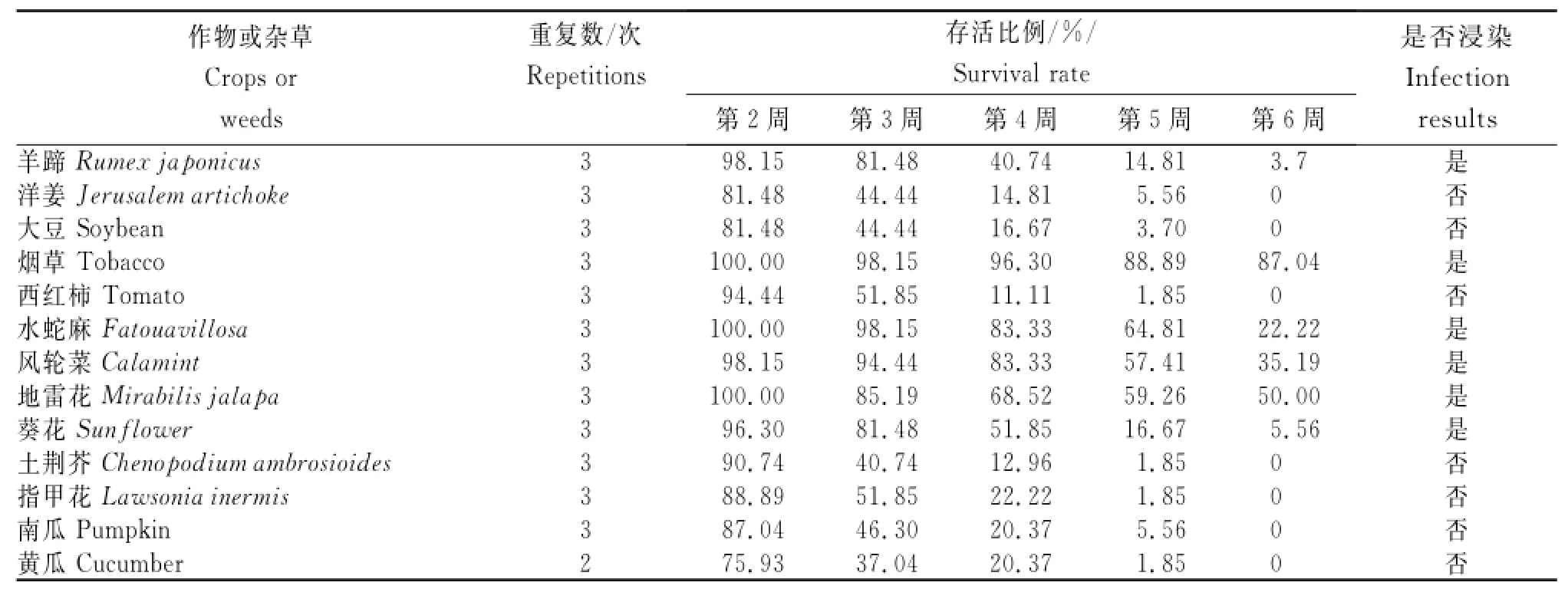
表2 13个不同寄主的白粉病菌对烟株的浸染效果Table2 Infection results of powdery mildew fungus from 13different hosts to tobacco
2 结果与分析
2.1 烟田非烟植物白粉病菌对烟草的浸染能力
表2结果表明,采自烟田及周边的部分非烟作物和杂草的白粉病菌能够侵染烟株,侵染能力强弱依次为地雷花>风轮菜>葵花>水蛇麻>羊蹄,且与对照(烟草)有明显差异。因此,初步认为烟田及周边的地雷花、风轮菜、葵花、水蛇麻和羊蹄所携带的白粉病菌可能在栽培过程中成为烟草的白粉病的侵染源。而南瓜、黄瓜、洋姜、大豆、西红柿、土荆芥和指甲花植株上的白粉病菌对烟草的侵染能力较差,可能不侵染烟草植株。
2.2 病菌基因组DNA的提取情况
1.0 %琼脂糖凝胶电泳检测结果(图1)表明,除大豆、风轮菜的白粉病菌提取效果不佳外,其它白粉病菌基因组DNA主带清晰,完整、无降解,RNA消化彻底;紫外分光光度计测定A260/A280值在1.7~1.9,表明所提取的白粉病菌DNA纯度较高,质量能满足RAPD分子标记对DNA模板的要求。
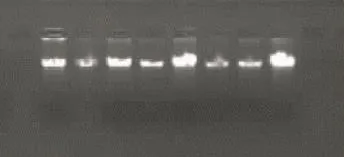
图1 部分白粉病菌基因组DNA琼脂糖凝胶检测结果Fig.1 The tested result of powdery mildew fungus genome DNA by Agarose gel electrophoresis

图2 白粉病菌RAPD引物扩增结果Fig.2 The amplification pattern of powdery mildew fungus amplified by RAPD primers

图3 11份白粉病菌RAPD的聚类结果Fig.3 Clustering diagram of 11isolates of powdery mildew fungus by UPGMA(RAPD)
2.3 白粉病菌RAPD-PCR扩增多态性
利用筛选的引物对参试材料病菌进行的RAPD-PCR扩增结果(图2)表明,20条参选RAPD引物中,筛选的14条引物能扩增出稳定的多态性条带,多态性引物比例为70%;在11个不同寄主(除风轮菜外)的白粉病菌中总共扩增出多态性位点167个;多态性引物最多扩增出17条多态性条带,最少8条;平均每条引物扩增出11.9个多态性位点。由此可知,参试材料间具有较大遗传差异,遗传多样性较丰富。大豆、风轮菜的白粉病菌RAPD扩增效果不佳,在部分引物中模糊甚至不出现条带,故不计统计分析。

表3 11个寄主白粉病菌浸染能力间的相似系数Table3 The coefficient of 11isolates of powdery mildew fungus
2.4 白粉病菌的聚类结果
聚类分析结果(图3)表明,11份参试白粉病菌间的相似系数在0.030 8~0.720 9,差异大;以相似系数0.20可将11种不同白粉病菌分为4类(图3)。第一类为洋姜白粉病菌,其与烟草白粉病菌相似系数为0.164 4;第二类包括烟草、地雷花和水蛇麻的白粉病菌;第三类包括葵花、黄瓜、南瓜及指甲花的白粉病菌,其中,指甲花和南瓜、黄瓜三者的白粉病菌相似系数较高,分别为0.7209和0.6897(表3);第四类为羊蹄、西红柿和土荆芥的白粉病菌。参试的11种植物白粉病菌同一大类间的亲缘关系较近,在遗传基础上,地雷花、水蛇麻白粉病菌与烟草白粉病菌的亲缘关系较近,归入第二大类;而烟田非烟植物白粉病菌对烟草的人工浸染能力的鉴定(表3)表明,烟田及周边水蛇麻和地雷花植株感染的白粉病菌容易浸染烟田烟草;单叶第二大类材料的分析,白粉病菌间的亲缘关系与浸染能力存在相关性。但羊蹄和葵花白粉病菌与烟草在亲缘关系上并不归为一类,而人工接种的浸染能力表明其对烟草具有浸染能力。因此,初步认为白粉病菌间的亲缘关系与浸染能力可能存在一定的相关性。
3 结论与讨论
在常规的白粉病生理小种鉴定方法中,植株的抗感反应受到接菌时期、菌样浓度及纯度、鉴别寄主的种植环境、接种后环境等条件影响,可导致鉴定结果不准确。白粉病菌生理小种鉴定方法虽有一套通用的鉴别寄主和抗感反应,但鉴别寄主对病菌的抗感判断却没有统一标准,接种条件也无明确规定[11]。因此,人工接种浸染烟草的鉴定试验的规范操作是试验顺利进行的保证。基于DNA水平的RAPD分子标记在鉴定白粉病菌可以避免环境条件的影响,其结果更可靠;同时,RAPD技术简单、操作简便、多态性高,已广泛应用于系统分类、资源多样性鉴定等研究[1720]。
本研究通过人工接种试验结合RAPD分子标记对烟草及烟田非烟植物白粉病菌进行亲缘关系鉴定,以此判断烟田非烟植物所携带的白粉病菌会否浸染烟草,同时通过聚类分析归类白粉病菌,初步认定烟草、地雷花和水蛇麻的白粉病菌亲缘关系较近;结合烟田非烟植物白粉病菌对烟草的人工接种的浸染能力鉴定结果,即地雷花、水蛇麻植株上的白粉病菌在浸染烟草叶片的第6周平均成活率分别为50%和22.22%,判断地雷花、水蛇麻植株上的白粉病菌容易浸染烟田的烟草。因此,在进行烟田烟草白粉病防治时,应该注重烟田及附近水蛇麻和地雷花白粉病的发生情况,及时采取措施,防止其侵染烟草,从源头遏制白粉病的发生和蔓延。羊蹄和葵花的白粉病菌虽在RAPD分子标记亲缘鉴定上与烟草不聚为一类,但对烟草的人工浸染能力分别为第6周平均成活率3.7%和5.56%;此外,风轮菜白粉病菌由于菌样收集质量欠佳,DNA提取及PCR扩增效果不佳,未参与分子标记聚类,但其对烟草的人工浸染能力较强,浸染第6周平均成活率达到35.19%。因此,在烟草实际生产中烟田及附近的羊蹄、葵花和风轮菜也要注意防范。
[1]曹 航.中国烟草行业发展研究[J].现代商贸工业,2011(5):4-5.
[2]牟建英,钱玉梅,任民,等.烟草白粉病抗性基因的QTL定位[J].中国烟草学报,2013,19(4):105-108.
[3]宋 双,张鑫,罗晶,等.不同杀菌剂对烟草白粉病菌的室内毒力及田间防效[J].西北农林科技大学学报,2014,42(2):131-135.
[4]刘佳玲.烟草白粉病流行因素及防治对策[J].贵州农业科学,1998,26(5):38-40.
[5]卢志伟,杨辉,曾荣,等.烟叶烘烤过程中白粉病菌的浸染情况[J].贵州农业科学,2015,43(2):50-52.
[6]雒振宁,时焦,王聪,等.湖北晒凉烟地方种质对烟草白粉病抗性的温室鉴定[J].烟草科技,2015,48(1):26-30.
[7]咸丰,张勇,马建祥,等.陕西关中地区瓜类白粉病菌生理小种的鉴定[J].西北农林科技大学学报(自然科学版),2010,38(10):115-120.
[8]张怡,徐克东,陈佩佩,等.河南省周口地区瓜类白粉病的分子鉴定与分析[J].华中师范大学学报(自然科学版),2013,47(6):830-835.
[9]裴冬丽,刘筱斐,李成伟.杨树白粉病病菌鉴定[J].东北林业大学学报,2016,44(1):100-102.
[10]邢荷荷,梁晨,于静,等.青岛地区烟草白粉病病[J].菌物学报,2015,34(1):159-163.
[11]魏尊苗,高鹏,王学征,等.黑龙江省葫芦科白粉菌RAPD分析[J].菌物学报,2011,30(4):587-597.
[12]毛宇宁,梁鹏,刘文波,等.橡胶树白粉病菌分子检测技术的建立[J].植物保护,2016,42(4):129-134.
[13]魏松红,曹远银,牟连晓.东北春麦区白粉病菌生理小种鉴定及毒性基因分析[J].植物保护学报,2006,33(1):27-31.
[14]顾海峰,张旭,张文芳,等.上海地区西甜瓜白粉病菌生理小种的鉴定[J].上海农业学报,2010,26(4):155-158.
[15]范成平,胡宁贵,陈恩发,等.贵州安顺地区烟草白粉病菌浸染特性及发生分析[J].安徽农业科学,2015,43(25):102-105.
[16]朱海英,段霞瑜,周益林,等.小麦白粉病菌基因组DNA的微量提取及ISSR-PCR反应体系的优化[J].植物保护,2010,36(3):125-129.
[17]陈作红,张志光,张天晓.鹅膏菌属真菌RAPD分析及亲缘关系的研究[J].菌物系统,2000,19(1):51-55.
[18]肖猛,李群,郭亮,等.四川西部濒危植物桃儿七遗传多样性的RAPD分析[J].生态学报,2015(5):1488-1495.
[19]罗琼.小麦白粉菌群体多样性RAPD分析及无毒性遗传分析[M].北京:中国农业科学院,2002:29-31.
[20]肖仲久,徐如宏,任明见,等.贵州小麦白粉病RAPD分析[J].山地农业生物学报,2006,25(6):501-505.
(责任编辑:聂克艳)
RAPD Analysis of Nonnicotiana Plants anDTobacco Powdery Mildew Fungus in Open Tobacco Field in Guizhou Province
HUANG Tuan1,2,FAN Chengping3,LU Zhiwei4,ZUO Rui2
(1.College of Agriculture and Food Engineering,Baise University,Baise,Guangxi 533000;2.Biotechnology Institute of Guizhou Province,Guiyang,Guizhou550006;3.Anshun Branch of Guizhou Tobacco Company,Anshun,Guizhou561000;4.China Tobacco Guizhou Industrial CO.,LTD.,Guiyang,Guizhou550006,China)
13samples of powdery mildew fungus were collected and separated from diseased nonnicotiana plants anDTobacco in open tobacco fielDTo test the potential infection of powdery mildew fungus from different nonnicaotiana hosts to tobacco,anDTo analyze their genetic relationship.And Samples were evaluated by using random amplified polymorphic DNA,anDThe infectivity was identifieDThrough artificial inoculation.Results:High genetic diversity existed among the tested powdery mildew fungus in Guizhou,anDThe similarity coefficient of the 11tested isolates varied from 0.0308to 0.7209.The UPGMA dendrogram divideDThe 11tested isolates,anDThe isolates from Mirabilils jalapaL.,Fatouavillosa Nakai anDTobacco were groupeDTogether.Tobacco host are susceptible to the isolates from M.jalapaL.,F.Nakai.It shows that there is some potentially association between DNA polymorphism and susceptible to isolates.
nonnicotiana plants;tobacco;powdery mildew fungus;molecular marker
S435.72
A
1001-3601(2016)10-0423-0054-04
2016-07-30;2016-10-10修回
广西高等学校优势特色专业群建设项目“亚热带农业产业专业群”[桂教高教(201541)66];贵州中烟工业有限责任公司科技专项“烟草白粉病综合防治技术研究”(黔烟工科201224)
黄 团(1981-),男,副研究员,硕士,从事植物遗传育种及生物技术等研究。E-mail:hwanjiang@hotmail.com
