溴酸钾体系十二烷基苯磺酸钠动力学分光光度法测定食品中痕量铜(Ⅱ)
2016-04-11沈淑君李术艳
沈淑君 李术艳
(漳州职业技术学院,福建 漳州 363000)
溴酸钾体系十二烷基苯磺酸钠动力学分光光度法测定食品中痕量铜(Ⅱ)
沈淑君 李术艳
(漳州职业技术学院,福建 漳州 363000)
研究了在表面活性剂十二烷基苯磺酸钠存在下,在pH=9.00的氨性缓冲溶液中,铜(Ⅱ)对溴酸钾氧化中性红褪色有明显的催化作用。通过测定595 nm下吸光度值的变化及其与铜(Ⅱ)浓度的线性关系,建立了分光光度法测定铜(Ⅱ)的新方法。方法的线性范围为0.012~0.12 μg/mL,线性方程为:ΔA=6.995c-0.097 7,相关系数r=0.999 2,检出限为7.74×10-10g/mL。用于食品及水样中痕量铜的测定,结果令人满意,相对标准偏差(RSD,n=6)为1.8%~2.3%。
催化动力学分光光度法;中性红;溴酸钾;铜;食品
Determination of Trace Cu (Ⅱ) in Foods by Kinetic
0 引言
铜是人体及动植物必需的微量元素之一[1],能调节机体的新陈代谢,铜缺乏可使人体出现生理紊乱[2],但过量也会引起铜中毒[3]。因此,环境中痕量铜准确测定具有重要意义[4]。目前食品、环境样品、药物中痕量铜的测定方法有萃取分光光度法[5]和原子吸收光谱法[6]。萃取分光光度法虽然仪器要求简单,但操作繁杂,灵敏度低,而且分离富集样品时的萃取剂通常是对人体健康有毒有害的有机溶剂[7];原子吸收光谱法仪器昂贵,操作繁琐、分析成本较高[8],不利于方法的推广与应用。催化动力学分光光度法由于设备简单[9]、操作简便[10]、灵敏度高、分析成本低[11]等优点,备受关注,而且不用有机萃取剂,弥补了原子吸收光谱法和萃取分光光度法的缺陷,具有较好的发展前景,已成为检测痕量元素的重要方法之一。近年来,催化动力学分光光度法对痕量铜的检测已有不少报道。在催化动力学分光光度法中加入适当的表面活性剂,可起到增敏、增稳、增溶的作用[12],因此是分光光度分析中优良分析试剂。
本研究发现,由于表面活性剂十二烷基苯磺酸钠(SDBS)的加入,铜(Ⅱ)能催化溴酸钾氧化中性红褪色,且灵敏度大大提高。对水样及食品样品中痕量铜的检测,取得令人满意的结果。
1 实验部分
1.1 仪器与试剂
UV2800型分光光度计(日本岛津公司);恒温水浴;ECPH51001S型精密酸度计(上海雷磁仪器厂);电子天平(北京赛多利斯仪器有限公司)。
铜标准储备溶液(1.0 g/L):准确称取0.106 0 g高纯铜粉(99.999%),用HNO3(1+2)溶解后,转移到100 mL容量瓶中,用二次蒸馏水定容,摇匀,使用时再逐级稀释至1.00 μg/mL的标准溶液。
KBrO3溶液(0.4 mol/L);中性红溶液(5.0×10-4mol/L);十二烷基苯磺酸钠(SDBS)溶液(10 g/L);NH3-NH4Cl缓冲溶液(pH=8.0~10.0)。所用试剂均为分析纯,实验用水为二次去离子水。
1.2 实验方法
取两支25 mL具塞比色管,依次加入3.0 mL中性红, 2.0 mL NH3-NH4Cl缓冲溶液(pH9.0),其中一支比色管加入适量Cu(Ⅱ)工作溶液(催化体系,吸光度A),另一支比色管不加(非催化体系,吸光度A0),再分别加入3.0 mL溴酸钾,2.0 mL十二烷基苯磺酸钠溶液,两支比色管均用二次去离子水定容至刻度,摇匀,同时放入沸水浴中加热10 min,立即取出,用自来水冲淋、冷却4 min,终止反应,用1 cm比色皿,以蒸馏水作参比,于595 nm波长处测定体系的吸光度差值ΔA=A0-A。
2 结果与讨论
2.1 吸收光谱曲线
按实验方法分别测定催化及非催化反应(其中各一份不加SDBS)的吸光度,并绘制吸收曲线,结果如图1所示。

图1 吸收曲线Figure 1 Absorption curves.
由图1中的曲线1和曲线2可知,在没有增敏剂SDBS作用下,Cu(Ⅱ)对KBrO3氧化中性红褪色的催化作用很小;由曲线3和曲线4可知,增敏剂SDBS加入后,Cu(Ⅱ)对该体系的催化作用明显增强,且最大吸收波长由512 nm红移到595 nm,说明在增敏剂SDBS的存在下,Cu(Ⅱ)对KBrO3氧化中性红褪色的催化作用增强,且在波长595 nm处两体系的ΔA最大。故实验选择595 nm为测定波长。
2.2 酸介质及用量的选择
按实验方法,考察了H3PO4、CH3COOH、H2SO4、HNO3、HCl、HAc-NaAc及NH3-NH4Cl缓冲溶液对反应的影响。结果表明,在NH3-NH4Cl介质中,Cu(Ⅱ)对KBrO3氧化中性红褪色反应催化效果最明显。两体系褪色差异大,且稳定。故实验的反应介质选用NH3-NH4Cl。
同时,考察了缓冲溶液pH在8.0~10.0范围内对体系ΔA的影响,结果表明,pH9.0时,体系ΔA值达到最大且恒定,因此选用pH9.0的NH3-NH4Cl缓冲溶液控制酸度。进一步考察其用量的影响,结果表明:当NH3-NH4Cl用量在0.5~2.0 mL时,体系的ΔA值随其用量增加而增大,其用量为2.0 mL时,体系ΔA值最大;继续增加时,ΔA值开始下降,故本实验选择pH9.0的NH3-NH4Cl用量为2.0 mL。
2.3 显色剂中性红用量的选择
按实验方法,考察了中性红用量在1.0~6.0 mL的影响,分别测定两体系的吸光度A和A0。结果如图2所示。
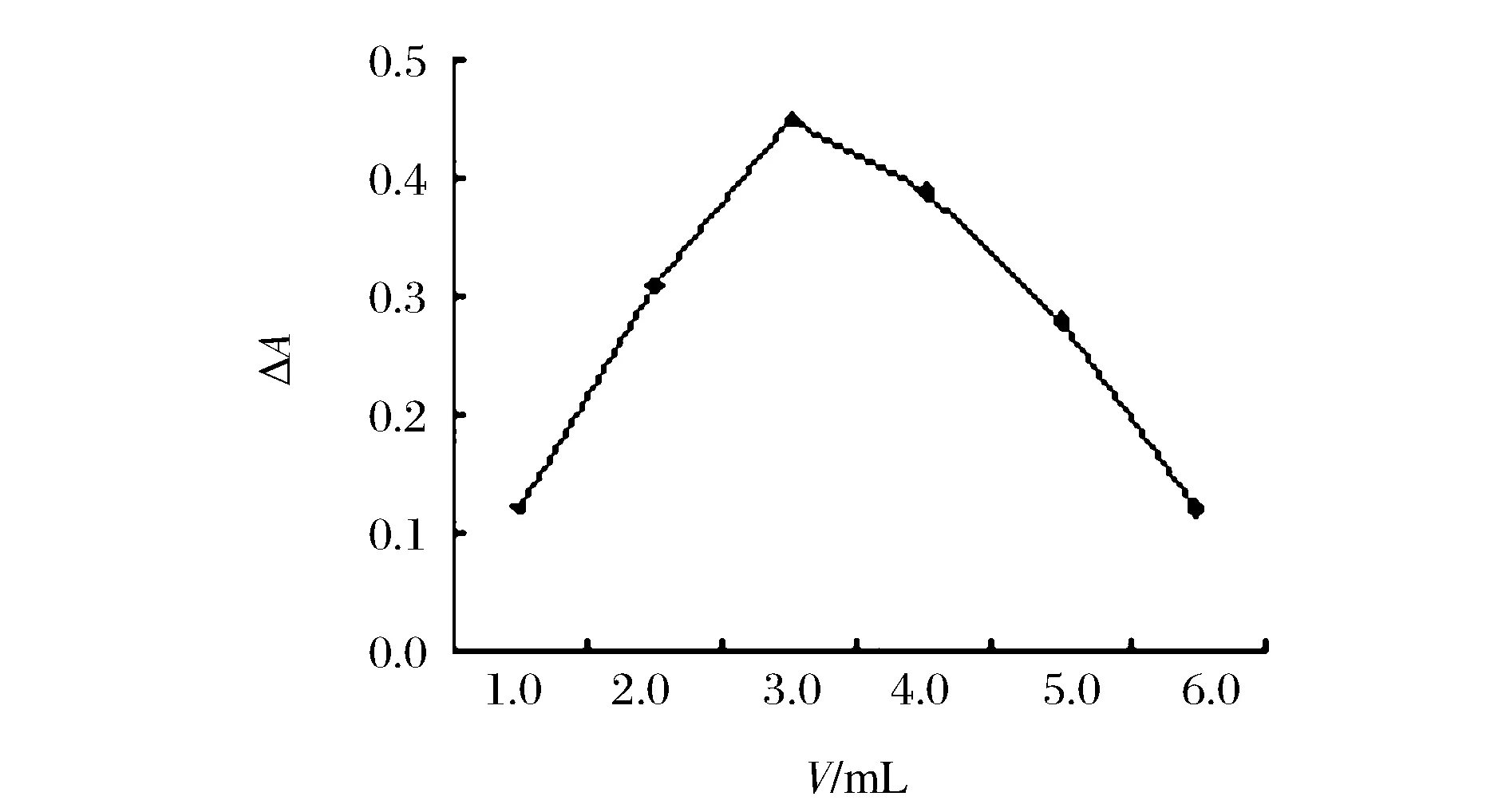
图2 显色剂用量对ΔA的影响Figure 2 Effect of amount of neutral red on absorbance.
当中性红用量在1.0~3.0 mL之间,体系ΔA值不断增大,其用量为3.0 mL时,ΔA值最大;增加用量,ΔA值下降。因此中性红用量选择3.0 mL。
2.4 表面活性剂及用量的选择
按实验方法,考察了阳离子表面活性剂十六烷基三甲基溴化铵(CTMAB)、氯化十六烷基吡啶(CPC)、溴代十六烷基吡啶(CPB);阴离子表面活性剂十二烷基苯磺酸钠(SDBS)、十二烷基硫酸钠(SDS);非离子表面活性剂吐温80、聚氧乙烯烷基酚(TritonX-l00)、聚乙烯醇(PVA)等对体系吸光度的影响,发现阴离子表面活性剂SDBS对反应具有明显的增敏作用。故选用SDBS作为本反应体系的表面活性剂。
同时考察SDBS用量的影响,如图3所示:当增敏剂用量小于0.5 mL时,两体系反应都较慢,ΔA值较小;增加增敏剂用量,体系ΔA值不断增大;其用量在1.5~3.0 mL之间体系的ΔA值变化不明显。当其用量为2.0 mL时,体系的ΔA值最大。因此本实验选用增敏剂用量为2.0 mL。

图3 增敏剂用量对ΔA的影响Figure 3 Effect of amount of SDBS on absorbance.
2.5 溴酸钾用量的选择
按实验方法,考察了溴酸钾(0.1 mol/L)用量在1.0~5.0 mL的影响。发现随着溴酸钾溶液用量的增加,体系ΔA值不断增大,当其用量为3.0 mL,ΔA值最大,其用量继续增加,ΔA值稍有下降,且当其用量太大时,反应速率加快,不易控制。故本实验选溴酸钾(0.1 mol/L)用量为3.0 mL。
2.6 反应温度的选择
按实验方法,考察了不同温度(50~110 ℃)对体系ΔA值的影响,发现当温度低于60 ℃时,催化与非催化体系几乎不反应,ΔA值无明显差异;反应温度为60~100 ℃时,随温度升高,体系ΔA值不断增大,100 ℃达到最大;温度继续升高,两体系ΔA值又迅速下降。故反应温度选择100 ℃的沸水浴。
2.7 反应时间的选择
按实验方法,考察反应在2~12 min内对体系ΔA值的影响,结果表明,反应时间小于4 min,两体系反应缓慢,ΔA值很小;反应时间在4~10 min,体系ΔA值不断增大,10 min时,ΔA值最大;反应超过10 min,体系ΔA值又迅速下降。故实验选择反应时间为10 min。
2.8 体系的稳定性
实验结果表明,该反应在低温下难以进行,反应完毕,只要用自来水冲淋、冷却4 min即可终止反应。故采用流水冷却终止反应。体系至少可以稳定5 h。
2.9 工作曲线和检出限
在最佳实验条件下,按实验方法,取不同量(0.2、0.3、0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0 mL)的Cu(Ⅱ)标准溶液,绘制工作曲线,结果如图4所示。
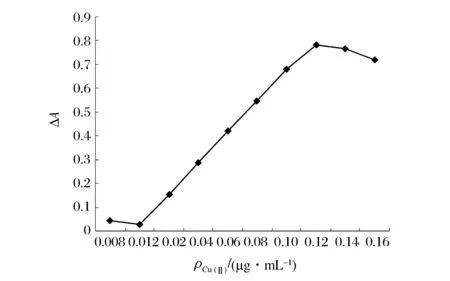
图4 工作曲线 Figure 4 Calibration Curves.
由图4可知,Cu(Ⅱ)的浓度(c)在0.012~0.12 μg/mL之间时与吸光度(A)呈良好的线性关系,线性回归方程为:ΔA=6.995c-0.097 7,相关系数r=0.999 2,同时进行11次平行空白实验,标准偏差σ=1.80×10-3。根据3倍标准偏差的方法得出方法的检出限为7.74×10-10g/mL。
2.10 共存离子的影响
3 样品分析
3.1 食品样品分析
称取2.00 g(精确至0.000 1 g)大米、小麦、薏米样品,于50 mL的小烧杯中,加入10.00 mL混合酸(VHNO3∶VHClO4=4∶1)消解液,盖上表面皿,然后在电热板上缓慢加热消解至冒白烟,消解液澄清为止。若溶液不澄清,再加几滴混合酸,加热消解至溶液无色澄清为止,于100 mL容量瓶中定容。取5.00 mL样品溶液于25 mL比色管中,按最佳实验方法进行测定,同时做加标回收实验。结果见表1。
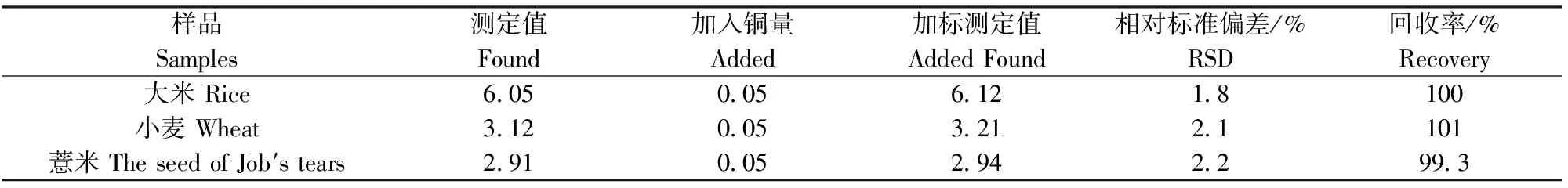
表1 食品中Cu(Ⅱ)的分析结果Table 1 Analytical results of Cu(Ⅱ) in food samples(n=6) /(μg·g-1)
3.2 水样分析
移取新鲜的水样5.0 mL于25 mL比色管中,按最佳实验方法测定各水样中铜(Ⅱ)的含量,结果如表2所示。
表2 水样中Cu(Ⅱ)的分析结果及回收率
Table 2 Analytical results of Cu (Ⅱ) in water samples and recovery tests of the method(n=6)/(μg·mL-1)

样品法测定值加入铜量加标测定值相对标准偏差/%回收率/%SamplesFoundAddedAddedFoundRSDRecovery自来水Tapwater031601041323993泉水Springwater045301055421100井水Wellwater051801062218101
4 结论
当没有加入表面活性剂SDBS时,Cu(Ⅱ)不能催化溴酸钾氧化中性红褪色,加入表面活性剂SDBS后,Cu(Ⅱ)的催化作用明显,从而建立了催化动力学分光光度法测定痕量Cu(Ⅱ)的新方法。且灵敏度大大提高,线性范围为0.012~0.12 μg/mL,检出限为7.74×10-10g/mL。应用于食品样品及水样中痕量Cu(Ⅱ)的测定,结果令人满意。
[1] 东明.微波消解-石墨炉原子吸收分光光度法测定不同类型水样中的总铜[J].科技视界(Science&TechnologyVision),2015,21(27):265-266.
[2] 耿明.双波长双指示剂催化动力学光度法测定痕量铬和铜[D].淮北:淮北师范大学,2010.
[3] 葛笑兰,谢英剑.双波长双指示剂催化光度法测定中药材中的痕量铜[J].淮北师范大学学报:自然科学版(JournalofHuaibeiNormalUniversity:NaturalScience),2014,35(1):30-33.
[4] 徐鉴,邵阳,张翠玲.分散液液微萃取-分光光度法测定水中痕量铜[J].应用化工(AppliedChemicalIndustry),2015,44(2):371-373.
[5] 沈友.液膜富集碘-四氯化碳萃取光度法测定矿石中的痕量铜[J].冶金分析(MetallurgicalAnalysis), 2000,7(4):18-22.
[6] 张武萍.简析火焰原子吸收光谱法测定铜基中微量金属元素[J].中国化工贸易(ChinaChemicalTrade),2015,35(19):26-29.
[7] Rezaee Mohammad,Assadi Yaghoub,Hosseini Mohamm-ad-Reza Milani,et a1.Determination of organic compounds in water using dispersive liquid-liquid microext raction[J].Journal of Chromatography A,2006,1116(122):1-9.
[8] 严小平.催化动力学褪色分光光度法测定痕量铜(Ⅱ)及其在食品中的应用[J].光谱实验室(ChineseJournalofSpectroscopyLaboratory), 2010,27(6):2167-2170.
[9] 沈淑君,邹小勇.茜素红-十六烷基三甲基溴化铵催化动力学光度法测定痕量铬(Ⅵ)[J].冶金分析(MetallurgicalAnalysis),2013,33(12):47-51.
[10] 沈淑君,邹小勇. 氯酸钾体系催化动力学光度法测定痕量钒(Ⅱ)[J].分析试验室(ChineseJournalofAnalysisLaboratory),2012,31(7):87-89.
[11] 王书民,樊雪梅,张晓晶,等.催化动力学光度法测定锌尾矿中痕量铅[J].冶金分析(MetallurgicalAnalysis),2013,33(6):42-46.
[12] 张羽,成杰民.十二烷基苯磺酸钠在分光光度法测量土壤中痕量钒的应用[J].绿色科技(JournalofGreenScienceandTechnology),2013,33(9):164-167.
Spectrophotometry with Potassium Bromate-SodiumDodecyl Benzene Sulfonate System
SHEN Shujun,LI Shuyan
(ZhangzhouInstituteofTechnology,Zhangzhou,Fujian363000,China)
Based on the catalytic effect of Cu(Ⅱ) on the oxidative fading neutral red by potassium bromated (KBrO3) with the surfactant of sodium dodecyl benzene sulfonate (SDBS) in NH3-NH4buffer solution (pH=9.0), a new catalytic spectrophotometry was presented for the determination of trace Cu(Ⅱ). A good linear relationship between the absorbance and the content of Cuwas obtained at 595 nm. Under the optimum conditions, the linear range of Cu (Ⅱ) was 0.012~0.12 μg/mL. The regression equation was ΔA=6.995c-0.097 7 with correlation coefficient of 0.999 2. The detection limit was 7.74×10-10g/mL. The method has been successfully applied to the determination of copper in water and food samples with satisfactory results. The relative standard deviation (RSD,n=6) was 1.8%~2.3%.
catalytic kinetic spectrophotometry; neutral red; KBrO3; Cu(Ⅱ); food
2015-12-24
2016-02-29
福建省教育厅A类科技项目(JA13388);漳州市职业技术学院科研项目(ZZY1308)资助
沈淑君,女,讲师。主要从事分析化学研究。E-mail:ssjun8008@126.com
10.3969/j.issn.2095-1035.2016.02.015
O657.32;TH744.12+1
A
2095-1035(2016)02-0054-04
