强直性脊柱炎相关IgA肾病的临床及病理特点
2016-04-11胡云琴俞东容
姜 飞,倪 军,胡云琴,俞东容
(浙江中医药大学附属广兴医院肾内科, 杭州 310007)
ChinJAllergyClinImmunol,2016,10(3):232- 237
强直性脊柱炎(ankylosing spondylitis,AS)是以脊柱关节肌腱附着点炎症为主要临床表现的慢性自身免疫性疾病[1]。除中轴及外周关节受累外,亦可出现眼、皮肤、心血管、胃肠道、肾脏等多个器官受累[2]。肾脏损害是AS不可忽视的关节外表现,可使原发病变复杂,降低患者生活质量,增加患者死亡风险[3]。AS肾损害主要表现为肾淀粉样病变、IgA肾病(IgA nephropathy,IgAN)、膜性肾病等[4- 7],国内以IgAN最为多见[8- 9]。目前国内外关于AS并发IgAN相关文献均以个案报道为主,大样本研究较少。本研究通过回顾性分析本院15例AS并发IgAN患者的临床表现、病理特点、治疗及随访结果,以期加深对疾病的认识。
对象与方法
对象
选取2009年1月至2015年1月在本院住院并行肾穿刺活检确诊为AS并发IgAN患者15例。AS诊断标准为1984年美国风湿病学会修订的纽约标准[10],并排除如未分化脊柱关节病、银屑病关节炎等其他血清阴性关节病。IgAN诊断依据以免疫荧光肾小球系膜区弥漫性IgA沉积,并排除系统性红斑狼疮、类风湿关节炎、过敏性紫癜、乙型肝炎相关性肾病等其他继发性IgAN。
方法
回顾性分析15例患者临床资料及肾脏病理特征。
临床资料:性别、年龄、病程、主要临床表现、肾穿刺时尿蛋白、红细胞计数及形态、尿N-乙酰-β-D氨基葡萄糖苷酶(NAG)、尿渗透压、尿微量蛋白[尿α1-微球蛋白/尿肌酐(尿α1-MG/cr)、尿白蛋白/ 尿肌酐(尿Alb/cr)、尿转铁蛋白/尿肌酐(尿TRf/cr)和尿IgG/尿肌酐(尿IgG/cr)]、血红蛋白、血肌酐、血尿酸、24 h尿蛋白定量、人类白细胞抗原B27(HLA-B27)、红细胞沉降率、C反应蛋白(C-reaction protein,CRP)、免疫球蛋白(IgA、IgG、IgM)、血清补体、类风湿因子、抗核抗体、抗dsDNA抗体和抗SM抗体等。
分析AS相关影像学资料;肾脏病理资料:肾穿刺活检后标本分别进行光镜(HE、PAS、Masson、PASM及刚果红染色)检查,免疫荧光(IgA、IgG、IgM、C3、C4及C1q)检查。电镜观察电子致密物沉积及基底膜的厚度。
相关定义
高血压:收缩压≥140 mm Hg,和(或)舒张压≥90 mm Hg;高尿酸血症:男性血尿酸>420 μmol/L,女性血尿酸>357 μmol/L;贫血:男性Hb<120 g/L,女性Hb<110 g/L。
统计学处理
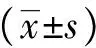
结 果
临床表现
基本情况:15例患者中,男性11例,女性4例,肾活检年龄(35.7±9.2)岁,9例35岁以下。2例有AS家族史,6例贫血,4例高血压,4例胆囊结石。
AS损害表现:AS病程(55.93±95.10)个月,2例患者肾脏病变发现在前,其AS关节表现不典型,腰骶部疼痛偶发,入院后结合检查及追溯病史后确诊;所有患者影像学检查可见单侧或者双侧Ⅱ~Ⅳ级骶髂关节炎;13例腰骶部疼痛及活动受限明显,其中2例并发颈椎疼痛及活动受限,2例并发胸椎活动度减少,2例并发晨僵,2例并发有下肢放射痛。1例肺间质纤维化明显,1例虹膜炎。14例HLA-B27阳性,1例HLA-B27阴性;所有患者自身抗体抗核抗体、抗dsDNA抗体、抗SM抗体及类风湿因子均为阴性。
肾脏病变表现:肾病病程(28.00±60.39)个月,7例于AS疾病治疗过程中发现,3例体检中发现,4例浮肿后发现,1例肉眼血尿后发现。10例蛋白尿并发血尿,5例以镜下血尿为主;2例尿N-乙酰-Β-D氨基葡萄糖苷酶/尿肌酐(NAG/Cr)异常;体液免疫中8例血清IgA升高;24 h尿蛋白定量(0.72±0.59)g,13例24 h尿蛋白定量小于1 g。所有患者血肌酐水平正常,肾脏超声显示肾脏大小形态正常(表1)。
病理表现
光镜表现:所有患者可见系膜细胞及系膜基质病变,11例可见肾小球硬化,8例可见肾小球节段硬化,13例可见新月体形成,3例可见内皮细胞增生;肾间质以轻度病变为主,13例可见灶性肾间质纤维化,12例可见灶性肾间质炎症细胞浸润,13例可见灶性肾小管萎缩,12例可见肾间质内小血管病变。刚果红染色均为阴性。
免疫荧光表现:所有患者可见肾小球系膜区IgA沉积。其中11例并发IgM沉积,6例并发IgG沉积,4例并发C1q沉积,14例并发C3沉积,无C4沉积。
电镜表现:2例电镜下无肾小球,其他患者肾小球基底膜厚度正常,肾小球系膜区及内皮下可见不同程度的电子致密物沉积,均可见足突融合(表2)。
治疗及结局
治疗:肾穿刺前13例已确诊的AS患者治疗方案:5例患者使用柳氮磺吡啶,其中1例加用来氟米特,4例使用非甾体抗炎药(nonsteroidal antiinflammatory drugs,NSAIDs);1例使用生物制剂;1例使用激素;肾穿刺前肾病治疗方案:6例患者使用血管紧张素Ⅱ受体拮抗剂/血管紧张素转化酶抑制剂基础治疗,其中1例联用激素,1例联用来氟米特。肾穿刺后治疗方案:15例患者中,10例患者使用激素治疗,其中6例联用来氟米特,1例联用环磷酰胺,1例联用雷公藤多甙,1例联用吗替麦考酚酯,其余5例患者使用来氟米特。
结局:本组患者随访4个月至6年余,1例患者失访,14例随访患者中12例尿蛋白转阴,13例镜下红细胞转阴,13例血肌酐水平正常,1例血肌酐水平较肾穿刺时上升约50%(末次随访血肌酐117 μmol/L,AS病史30余年,尿检异常病史10余年,未定期随诊)。14例患者中13例腰骶部疼痛较前改善,无新增如肺间质纤维化、虹膜炎、葡萄膜炎、主动脉瓣病变等其他AS损害。
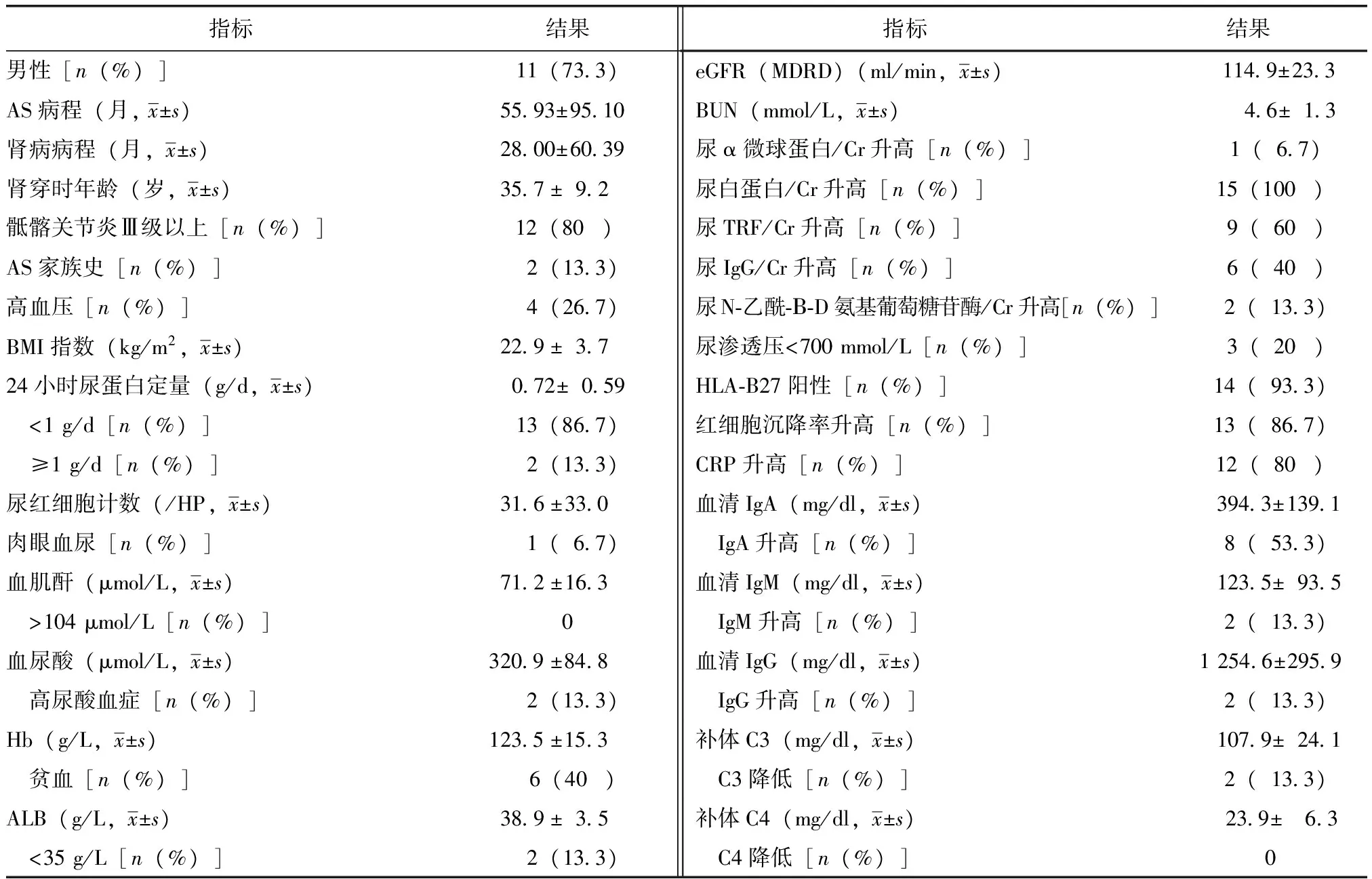
表1 15例AS患者IgA肾病临床表现Table 1 Clinical characteristics of the patients with IgA nephropathy associated with ankylosing spondylitis
AS:强直性脊柱炎; Hb:血红蛋白; ALB:人血白蛋白; eGRF:肾小球滤过率; BUN:尿素氮; Cr:肌酐; TRF:转铁蛋白; CRP:C反应蛋白
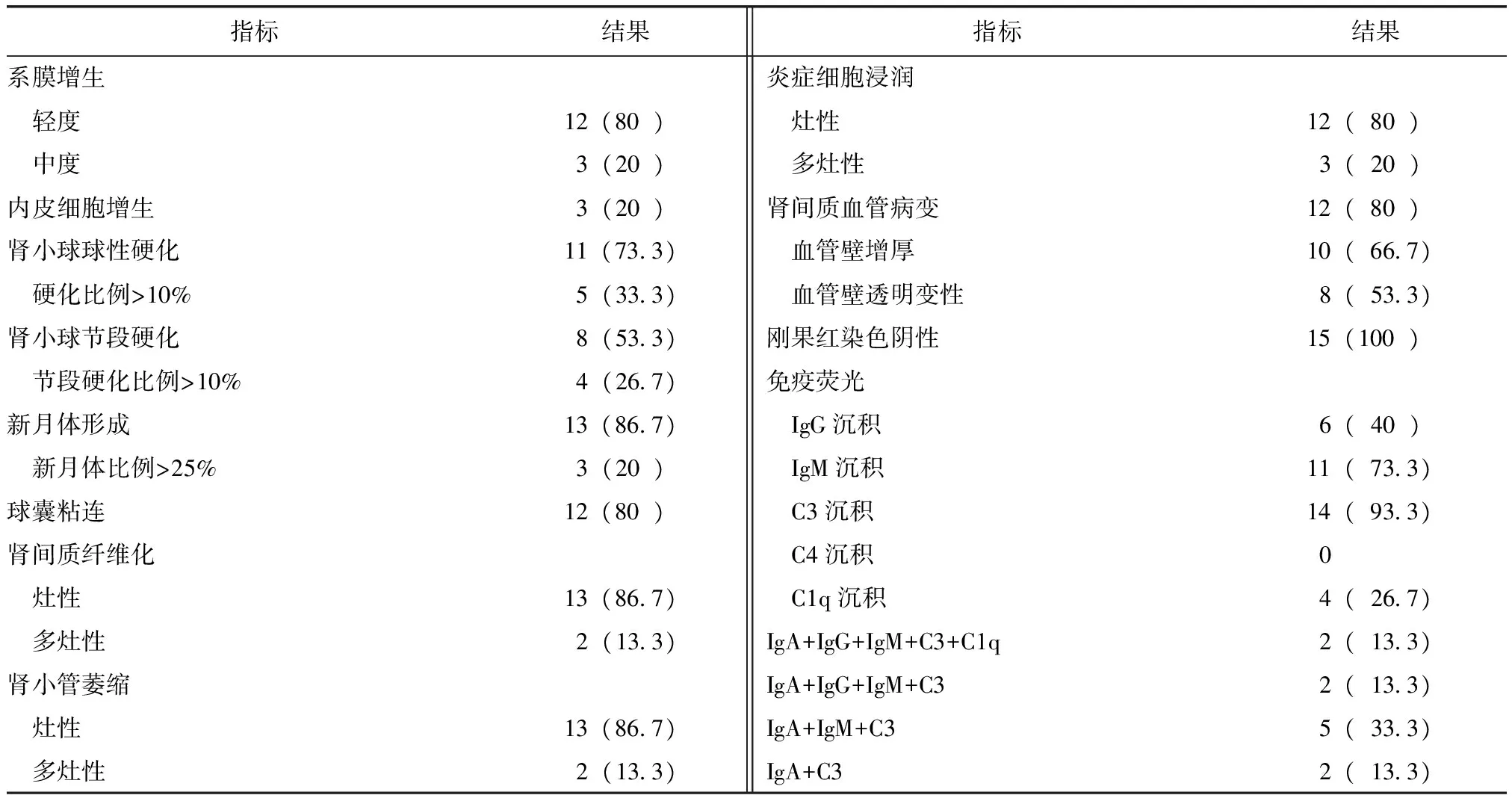
表2 15例AS患者IgA肾病病理表现Table 2 Pathologic characteristics of the patients with IgA nephropathy associated with ankylosing spondylitis [n(%)]
AS:强直性脊柱炎; 轻度:病变比例≤25%;中度:25%<病变比例≤50%;灶性:病变比例≤25%;多灶性:25%<病变比例<50%
讨 论
相比较其他系统而言,AS肾脏受累相对少见,临床上也未得到充分重视[11]。国外报道约5%~13% AS患者可发生肾损害[12- 13],国内尚无AS肾损害系统性的流行病学数据。既往研究认为IgAN是我国AS肾损害最常见的病理类型。AS并发IgAN的发病机制尚不明确,一方面,可能与两者存在共同的免疫学特征(血清IgA以及含IgA的免疫复合物水平升高)[14]有关;另一方面,近年来针对IgAN的研究认为本病并非是一种单一性疾病,而是具有相同肾脏免疫病理特征的临床症候群,其临床及肾脏病理表现多样,病因复杂[15]。IgAN在并发其他免疫因素介导的疾病时,需进行针对性检查排除继发性IgAN的可能。
本研究多数患者肾损害见于AS确诊后,而部分患者AS起病隐匿,关节病变不典型,腰骶部疼痛及活动受限情况并不明显,IgAN诊治过程中才确诊为AS。IgAN患者如有AS家族史、腰骶部疼痛或免疫学检查异常,应及时进行针对性影像学检查,避免AS的漏诊。肾损害起病更加隐匿,研究中仅5例患者有明确的临床表现(浮肿和肉眼血尿),其他均无症状,尿检异常,临床上容易漏诊。AS作为慢性系统性疾病,长期的诊治过程中需要考虑到对肾脏损害的筛查,定期的尿常规、微量蛋白尿及肾功能检查有利于较早地发现肾损害,对于反复尿检异常(持续蛋白尿或异形红细胞尿)及肾功能异常患者,应考虑行肾穿刺活检,明确肾脏病变情况。
AS相关IgAN肾脏临床表现多样,可见镜下血尿、肉眼血尿、蛋白尿甚至肾病综合征,肾功能不全。研究中主要以反复镜下血尿或血尿并发少量蛋白尿为主,肾功能水平正常。尿蛋白定量多小于1 g/d,甚至无蛋白尿,随访中也未见大量蛋白尿。血尿是AS相关IgAN最常见临床表现,相较蛋白尿而言,这部分患者的血尿出现早、情况重、持续时间长、不易控制且容易随着AS病情反复。肾穿刺检查时15例患者中有13例AS病情活动(关节疼痛明显,CRP和红细胞沉降率升高),血尿水平较非活动患者重,随访过程中血尿水平随着AS病情活动而加重,包括2例起病隐匿的AS患者。肾脏病理以轻度系膜增生性病变为主,肾小球及肾间质病变都较轻。新月体也是该部分患者常见的病理表现,86.7%患者伴有新月体形成,且以细胞性或者细胞纤维性新月体为主。其中2例新月体比例接近40%。李世军等[16]发现AS相关IgAN患者新月体发生率及比例较原发性IgAN高,认为疾病的血管病变较严重。值得一提的是NSAIDs作为控制AS病情活动的一线用药,也可引起蛋白尿、血尿及不同程度肾功能损害。本研究中仅有1例患者长期服用NSAIDs,所有患者肾活检后较少用此类药物,肾小管功能损害不明显(如夜尿增多,渗透压降低,肾性糖尿及肾小管酸中毒等情况较轻),病理上肾间质病变较轻(无弥漫性肾间质水肿、弥漫性肾小管萎缩及间质纤维化等)。排除药物性因素及肾淀粉样变性(肾组织刚果红染色阴性)引起的肾损害后,考虑本组患者肾脏病变是由IgAN引起。而临床上随AS病情反复的血尿和肾病理上较原发性IgAN突出的血管病变提示本组患者的IgAN可能继发于AS而非原发。
AS是一种炎症性损害疾病,可见红细胞沉降率、CRP升高。红细胞沉降率和CRP是目前临床上反映AS活动性最重要的客观指标。国际上常用评价AS病情活动的标准AS活动性评分(ASDAS)[17]也含有这两项指标。研究中13例患者红细胞沉降率升高,12例患者CRP升高,随访中8例病情稳定后复查7例红细胞沉降率正常,6例CRP正常。AS并发IgAN可见血清IgA以及含IgA的免疫复合物水平升高。既往研究认为这可能与IgA的特异性Fc受体功能异常有关[14],也有研究认为与某些肠道致病菌感染引起肠黏膜分泌IgA升高有关[18- 19],但是IgA水平升高与AS并发IgAN的病因有无直接关系目前尚无定论。随访中发现8例血清IgA升高的患者中,6例病情稳定后,复查IgA水平正常,提示血清IgA水平可能与AS相关的IgAN病情活动性相关。
目前AS相关IgAN尚无统一的治疗方案,临床上主要根据AS病情活动性、肾病理结果及药物的肾毒性等多方面因素评估后制定。研究中5例IgAN病变较轻,仅以ACEI/ARB控制蛋白尿,主要以柳氮磺吡啶或来氟米特控制AS病情为主。而其他10例患者均使用糖皮质激素,尽管目前AS治疗中并不推荐口服或静脉全身应用激素[20],但考虑到这部分患者肾脏病变较重,临床上蛋白尿、血尿较多,病理上存在活动性病变如细胞性新月体,肾间质炎症细胞浸润,系膜细胞增生,治疗上以激素联合其他免疫抑制剂控制肾脏病情为主。而非甾体抗炎药因存在加重肾脏病风险[21],这类患者较少使用。随访中AS关节症状得到控制,无新增其他系统损害,尿蛋白及红细胞计数较前下降,肾功能基本稳定,结局尚可。提示AS相关IgAN予以较积极的免疫抑制剂治疗效果良好。
总之,AS相关IgAN起病隐匿,容易漏诊,血尿是最突出的临床表现,轻度系膜增生及新月体形成是最常见的病理改变。通过早期诊断及较积极的免疫抑制治疗,预后尚可。
[1]Braun J, Yu DTY. Ankylosing spondylitis[J]. Lancet, 2010,1:1379- 1390.
[2]Vander Cruyssen B, Ribbens C, Boonen A, et al. The epidemiology of ankylosing spondylitis and the commen-cement of anti-TNF therapy in daily rheumatology practice[J]. Ann Rheum Dis, 2007,66:1072- 1077.
[3]Lehtinen K. Mortality and causes of death in 398 patients admitted to hospital with ankylosing spondylitis[J]. Ann Rheum Dis, 1993,52: 174- 176.
[4]Gupta R, Sharma A, Arora R, et al. Membranous glomerulonephritis in a patient with ankylosing spondylitis: A rare association[J]. Clin Exp Nephrol, 2009,13:667- 670.
[5]Samia B, Hazgui F, Abdelghani KB, et al. Renal abnormalities in ankylosing spondylitis[J]. Nephrol Ther, 2012,8:220- 225.
[6]Donmez S, Pamuk ON, Pamuk GE, et al. Secondary amyloidosis in ankylosing spondylitis[J]. Rheumatol Int, 2013,33:1725- 1729.
[7]Strobel ES, Fritschka E. Renal diseases in ankylosing spondylitis: Review of the literature illustrated by case reports[J]. Clin Rheumatol, 1998,17:524- 530.
[8]陈进伟. 重视强直性脊柱炎关节外表现的诊治[J]. 中华风湿病学杂志, 2012, 16: 577- 579.
[9]高俊丽, 李小峰, 王鑫, 等. 强直性脊柱炎合并肾脏损害三例临床分析并文献复习[J]. 中国药物与临床, 2014, 14:230- 233.
[10] van der Linden S, Valkenburg HA, Cats A. Evaluation of diagnostic criteria for ankylosing spondylitis. A proposal for modification of the new york criteria[J]. Arthritis Rheum, 1984,27:361- 368.
[11] 李坤鹏. 强直性脊柱炎:一种被忽视的全身性疾病[J]. 中华内科杂志, 2015, 54: 913- 915.
[12] Levy AR, Szabo SM, Rao SR, et al. Estimating the occurrence of renal complications among persons with ankylosing spondylitis[J]. Arthritis Care Res (Hoboken), 2014,66:440- 445.
[13] Lee SH, Lee EJ, Chung SW, et al. Renal involvement in ankylosing spondylitis: Prevalence, pathology, response to tnf- a blocker[J]. Rheumatol Int, 2013,33:1689- 1692.
[14] Montenegro V, Monteiro RC. Elevation of serum IgA in spondyloarthropathies and IgA nephropathy and its pathogenic role[J]. Curr Opin Rheumatol, 1999,11:265- 272.
[15] 陈惠萍, 刘志红, 胡伟新, 等. 继发性IgA肾病常见病因及其病理特征分析[J]. 肾脏病与透析肾移植杂志, 2007, 16: 222- 228.
[16] 李世军, 刘志红, 陈惠萍, 等. 强直性脊柱炎相关 IgA 肾病临床与病理特征[J]. 肾脏病与透析肾移植杂志, 2007, 16:229- 232.
[17] Lukas C. Development of an asas-endorsed disease activity score (asdas) in patients with ankylosing spondylitis[J]. Ann Rheum Dis, 2009,68:18- 24.
[18] Wendling D. Spondylarthropathies and the IgA system[J]. Rev Med Interne, 1994,15:55- 61.
[19] de Moura CG, de Moura TG, de Souza SP, et al. Inflammatory bowel disease, ankylosing spondylitis, and IgA nephropathy[J]. J Clin Rheumatol, 2006,12:106- 107.
[20] Braun J, Berg RVD, Baraliakos X, et al. 2010 update of the asas/eular recommendations for the management of ankylosing spondylitis[J]. Ann Rheum Dis, 2011,70:896- 904.
[21] Azevedo DC, Ferreira GA, Carvalho MA. IgA nephropathy in patients with spondyloarthritis followed-up at the rheumatology service of hospital das clinicas/ufmg[J]. Rev Bras Reumatol, 2011,51:417- 422.
