《物质结构与性质》模块考向探析
2016-04-10江苏马秋英
江苏 马秋英
《物质结构与性质》模块考向探析
江苏 马秋英
高考对《物质结构与性质》模块的考查,以对主干知识的综合考查为主,题型基本上都是多点拼盘式的综合题。下面具体举例,就这类试题的主要综合方式和常考知识点进行分析。
1.任选各专题的重点知识进行拼盘
这类试题针对本模块中的一些重要知识点进行简单组合命题,以填空题或选择题的形式呈现,各问题之间没有内在联系,属并列关系。
例1 (2015浙江)请回答下列问题。
(1)Cu2+的电子排布式是__________________________。
(2)下列物质中既有离子键又有共价键的是________。
A.MgO B.NaOH
C.CaCl2D.(NH4)2SO4
(3)关于下列分子的说法不正确的是________。

A.既有σ键又有π键
B.O—H键的极性强于C—H键的极性
C.是非极性分子
D.该物质的分子之间不能形成氢键,但它可以与水分子形成氢键
(4)下列说法正确的是________。
A.HOCH2CH(OH)CH2OH与CH3CHClCH2CH3都是手性分子
C.BF3与都是平面型分子
D.CO2和H2O都是直线型分子
(5)下列有关性质的比较,正确的是________。
A.第一电离能:O>N
B.水溶性:CH3CH2OH>CH3CH2OCH2CH3
C.沸点:HCl>HF
D.晶格能:NaCl>MgO
解析:(1)Cu是29号元素,基态铜原子的电子排布式为1s22s22p63s23p63d104s1;Cu原子失去最外层1个电子和次外层1个电子得到Cu2+,其电子排布式为1s22s22p63s23p63d9。(2)MgO、CaCl2都是由活泼金属元素和活泼非金属元素组成的,只有离子键;NaOH中,Na+和OH-之间以离子键结合,H、O原子间以极性共价键结合;(NH4)2SO4中,NH4+和之间以离子键结合,N原子和H原子、S原子和O原子之间都以极性共价键结合。(3)该有机物分子中含有碳碳双键,故既有σ键又有π键,A正确;非金属性:O>C,则键的极性:O—H键>C—H键,B正确;该分子结构不对称,正负电荷中心不能重合,是极性分子,C错误;该分子既可以形成分子间氢键,又可以形成分子内氢键,D错误。(4)手性分子是指结构上镜像对称而又不能完全重合的分子,连有四个不同原子或基团的碳原子称为手性碳原子,HOCH2CH(OH)CH2OH不是手性分子,A错误;和CH4都是正四面体结构,B正确;BF3是平面三角形分子,苯分子是平面结构,C正确;CO2是直线形分子,而H2O是V形分子,D错误。(5)N原子的2p轨道为半满状态,比较稳定,第一电离能:N>O,A错误;乙醇分子含有亲水基团(羟基),水溶性:乙醇>乙醚,B正确;F元素的非金属性极强,HF分子间存在氢键,沸点大于无氢键的HCl,C错误;离子所带电荷数:Mg2+>Na+、O2->Cl-,离子半径:Mg2+<Na+、O2-<Cl-,晶格能的大小与离子所带电荷数成正比,与离子半径成反比,故晶格能:MgO>NaCl,D错误。
答案:(1)1s22s22p63s23p63d9或[Ar]3d9(2)BD(3)CD (4)BC (5)B
2.根据某一化学反应中出现的物质拼盘
这类试题通常给出一个有特定作用的化学反应,要求用物质结构知识分析反应中出现的元素及其化合物的结构和性质。
例2 (2015江苏)下列反应曾用于检测司机是否酒后驾驶:

(1)Cr3+基态核外电子排布式为_______________;配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是__________(填元素符号)。
(2)CH3COOH中C原子轨道杂化类型为___________;1mol CH3COOH分子含有σ键的数目为__________。
(3)与H2O互为等电子体的一种阳离子为__________ ____(填化学式);H2O与CH3CH2OH可以任意比例互溶,除因为它们都是极性分子外,还因为_______________。
解析:(1)Cr为24号元素,价电子数为24-18=6,d轨道半满状态下较稳定,则Cr的核外电子排布为[Ar]3d54s1;原子失去电子时,先失最外层上的电子,所以Cr3+的核外电子排布为[Ar]3d3。H2O分子中的O原子有孤电子对,所以O为配位原子。(2)甲基中的C原子以sp3形式杂化,羧基中的C原子以sp2形式杂化。单键全部为σ键,双键中有一个π键和一个σ键,所以1mol CH3COOH中含有7molσ键。(3)H2O中O原子的价电子数与F+相等,所以H2O和H2F+互为等电子体。H2O与CH3CH2OH之间可以形成分子间氢键,故两者可以任意比例互溶。
答案:(1)1s22s22p63s23p63d3(或[Ar]3d3) O
(2)sp3、sp27mol(或7 NA)
(3)H2F+H2O与CH3CH2OH之间可以形成氢键
3.围绕某个主题涉及的物质进行拼盘
这类试题以新材料的开发利用、某元素及其化合物的应用等为背景串联各知识点,联系最新科技成果,体现化学与社会发展的密切联系。
例3 (2015全国卷Ⅰ)碳及其化合物广泛存在于自然界中。回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用________形象化描述。在基态14C原子中,核外存在________对自旋相反的电子。
(2)碳在形成化合物时,其键型以共价键为主,原因是_____________________________________________________。
(3)CS2分子中,共价键的类型有________,C原子的杂化轨道类型是________,写出两个与CS2具有相同空间构型和键合形式的分子或离子________。
(4)CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253K,沸点为376K,其固体属于________晶体。
(5)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:

①在石墨烯晶体中,每个C原子连接________个六元环,每个六元环占有________个C原子。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接_________个六元环,六元环中最多有________个C原子在同一平面。
解析:(1)电子云是处于一定空间运动状态的电子在原子核外出现的概率密度分布的形象化描述。C原子的核外有6个电子,电子排布式为1s22s22p2,其中1s、2s上2对电子的自旋方向相反,而2p轨道的电子自旋方向相同。(2)碳原子的最外层是4个电子,且碳原子的半径较小,难以通过得或失电子达到稳定结构,所以通过形成共用电子对的方式,即形成共价键来达到稳定结构。(3)在CS2分子中,C与S原子间形成双键,每个双键都是含有1个σ键和1个π键,分子为直线形结构,则含有的共价键类型为σ键和π键。C原子的最外层形成2个σ键,无孤电子对,以sp形式杂化。O与S同主族,所以与CS2具有相同空间构型和键合形式的分子为CO2;SCN-离子与CO2互为等电子体,故SCN-的空间构型和键合方式与CS2相同。(4)该化合物的熔沸点较低,应为分子晶体。(5)本小题应根据均摊法来计算。①石墨烯晶体中,每个C原子被3个六元环共有,每个六元环占有的C原子数是6×1/3=2。②在金刚石晶体中,一个C形成四个键,每个键和另外三个键都可以成六元环,从四个键里任选两个键成环,有六种不同选法;每两个相邻的键可以成两个环,所以每个C原子连接6×2=12个环。金刚石中的六元环不同于苯环,是类似于椅状的六元环。根据立体几何知识,可知每个环中最多有4个C原子在同一平面。
答案:(1)电子云 2
(2)C有4个价电子且半径小,难以通过得或失电子达到稳定电子结构
(3)σ键和π键 sp CO2、SCN-(或COS等)
(4)分子
(5)①3 2 ②12 4
4.以推断出的元素为主线进行拼盘
这类试题要求根据元素的位置、结构和性质等信息推断元素,在此基础上解答与元素及其化合物有关的问题。因此,推出元素是解答这类试题的关键,否则会满盘皆输。
例4 (2015全国卷Ⅱ)A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是_________(填元素符号),其中C原子的核外电子排布式为________。
(2)单质A有两种同素异形体,其中沸点高的是______ ______(填分子式),原因是____________________。A和B的氢化物所属的晶体类型分别是________和________。
(3)C和D反应可生成组成比为1∶3的化合物E,E的立体构型为________,中心原子的杂化轨道类型为________。
(4)化合物D2A的立体构型为________,中心原子的价层电子对数为________,单质D与湿润的Na2CO3反应可制成D2A,其化学方程式为_____________________。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm。F的化学式为_______________;晶胞中A原子的配位数为________;列式计算晶体F的密度:________g·cm-3。
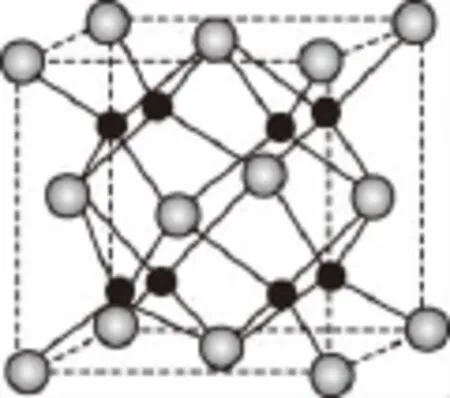
解析:推断元素应从C突破:C原子的电子总数为15,最外层有5个电子,是P元素;D与P元素同在第三周期,最外层有一个未成对电子,D是Cl元素;A、B的原子序数小于15,A2-和B+具有相同的电子构型,则A是O元素,B是Na元素。
(1)根据元素电负性的变化规律,可知四种元素,O的电负性最大。(2)O能形成O2和O3两种单质,其中沸点高的是O3,因为O3相对分子质量较大,范德华力大。H2O形成的晶体是分子晶体,NaH是离子化合物,形成的晶体是离子晶体。(3)E是PCl3,P原子的价电子数是4,其中有1对孤对电子,其立体构型为三角锥形,P原子以sp3形式杂化。(4)Cl2O分子中,O原子的价电子对数为4,其有2对孤对电子,分子的立体构型为V形。(5)由晶胞结构可知:N(Na)∶,故F的化学式为Na2O。晶胞中O原子的配位数为8。1个F晶胞中有4个“Na2O”,其质量为;F晶胞的体积V=(0.566×10-7cm)3,其密度
答案:(1)O 1s22s22p63s23p3(或[Ne]3s23p3)
(2)O3O3相对分子质量较大,范德华力大 分子晶体 离子晶体
(3)三角锥形 sp3
(4)V形 4 2Cl2+2Na2CO3+H2O ===Cl2O+2NaHCO3+2NaCl
(或2Cl2+Na2CO3===Cl2O+CO2+2NaCl)
分析上述高考试题可以发现,本模块的重要考点有:原子(或离子)的表示方式(电子式、结构示意图、基态原子或离子的核外电子排布式等)、第一电离能的大小比较、电负性的应用、等电子体及等电子原理、原子杂化方式及分子的空间构型、氢键对物质性质的影响、晶胞中原子或离子数目的计算、配合物的结构与性质等。虽然本模块涉及的内容有一定的难度,但高考试题的难度并不大。复习备考时,应强化对基础知识的把握和理解,突破晶体结构和晶胞计算等难点问题。可以预计,立足双基,拼盘式的多点考查仍然是以后高考命题的趋势。只要基础扎实,这部分的试题都能得到自己满意的分数。
(作者单位:江苏省常州市横山桥高级中学)
