二氯化乙酰胺·一水合铜催化分解双氧水
2016-04-10*殷杰
*殷 杰
(信阳职业技术学院化学与环境工程学院 河南 464000)
二氯化乙酰胺·一水合铜催化分解双氧水
*殷 杰
(信阳职业技术学院化学与环境工程学院 河南 464000)
用乙酰胺与CuCl2·2H2O以1:1的比例在无水乙醇中反应,合成了二氯化乙酰胺·一水合铜配合物。红外光谱证实了其结构,并就该配合物对催化分解双氧水反应进行了研究。结果表明该配合物催化活性优良、性质稳定、重复性能好。
二氯化乙酰胺·一水合铜;双氧水;催化分解
本文以乙酰胺和铜的无机盐为原料,合成了金属铜的配合物,并考察了该金属配合物催化分解双氧水的反应性能。研究表明,二氯化乙酰胺·一水合铜对于催化分解双氧水反应均表现出良好的催化活性。
1.实验部分
(1)试剂与仪器
乙酰胺、氯化铜、高锰酸钾、无水乙醇、30%过氧化氢均为分析纯。FT-IR Nicolet 8700型红外光谱仪(4000-400 cm-1,KBr压片);三颈瓶;磁力搅拌器;U型管计量器等。
(2)方法
①配合物的合成及提纯
相同物质的量的乙酰胺和氯化铜分别溶入20ml的95%乙醇,然后将二者混合,加热回流2h,水浴蒸去乙醇,少量无水乙醇重结晶,减压干燥得到黄棕色固体粗产品。然后以甲醇作溶剂,中性氧化铝作吸附剂,通过柱色谱法将配合物提纯,经蒸发、真空干燥最后得到淡黄色针状细小的晶体,收率为44.5%。
②H2O2的催化分解
一部分通过能及时测量气体体积的装置,来测定不同时间下配合物催化H2O2分解出的氧气的体积,用此来表明H2O2分解速率的大小。一部分用高锰酸钾标准溶液滴定并计算双氧水分解率。研究在不同H2O2浓度、催化剂用量等条件下,对双氧水分解反应的影响,找出它的催化规律。
2.结果与讨论
(1)配合物的结构分析
合成的二氯化乙酰胺·一水合铜配合物的红外光谱见图1,以及乙酰胺的红外光谱见图2。在配合物中乙酰胺的羰基特征峰由1667cm-1变为1650cm-1,吸收峰发生了很明显的红移,既可以证明乙酰胺配体与金属铜离子发生了配位作用;而胺基的特征峰发生了一定程度的蓝移,证明胺基没有和铜离子配位只有羰基氧和铜离子配位。其组成可能为[CU(O=C(NH2)(CH3))H2O]Cl2即一个乙酰胺分子取代了氯化铜晶体中的一个水分子。反应式如下:

(2)过氧化氢浓度对分解速率的影响
取0.03g配合物依次加入到浓度分别为30%、15%、5%的15mL双氧水溶液中,测定在20℃时不同时间内反应放出的氧气体积量,结果见表1。
取0.21g(1mmol)配合物依次加入到浓度分别为20%、17%、15%、5%的20mL双氧水溶液中,测定半小时后双氧水的分解率,结果见表2。

图1 乙酰胺·一水合铜的IR光谱图

图2 乙酰胺的IR光普图
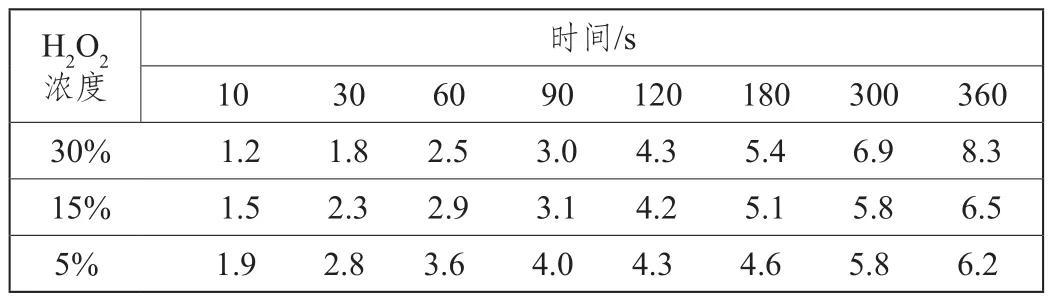
表1 不同双氧水浓度下催化反应所生成的氧气体积
由表1可知,不同浓度的双氧水分解速率不同。30%的双氧水分解先慢后快。在分解初期,5%双氧水的分解速率稍快,但随反应时间的增加,分解速率加快,30%的双氧水明显超过其他两种,这与反应是放热反应有关,浓度越大产生热越多,使得反应加快。
由表2可知,不同浓度的双氧水分解率不同。20%的过氧化氢分解最快。从实际反应现象看,浓度大的双氧水加入0.21g催化剂后会很快剧烈反应,产生大量的热使得反应体系液体沸腾,双氧水很快分解完全,如20%的H2O2反应21分钟后反应体系基本平静。
(3)铜配合物用量对分解速率的影响
在15%双氧水溶液中,加入不同质量的配合物作催化剂,在20℃下测试过氧化氢分解产生氧气的量,结果见表3

表3 15%过氧化氢溶液在不同质量的催化剂催化下放出氧气的体积
由表3可知,随着催化剂用量的增加双氧水分解速率逐步提高。0.03g催化剂催化速率最小,0.15g催化剂催化速度最快,说明该催化剂增加用量加大反应速率。
3.结论
通过在配合物不同用量、过氧化氢的浓度等条件下的实验研究得知∶二氯化乙酰胺·一水合铜乙配合物用量的增加,使得双氧水分解速率加快。过氧化氢的浓度也影响催化反应速率,浓度高会加快起始反应速度。在20ml15%的过氧化氢中加入1mmol的配合物,反应相当剧烈,产生大量热,使得溶液沸腾,过氧化氢分解加快。总之该配合物的催化性能优秀,而且能够重复使用,催化效率变化很小。
Chloride, Acetamide Monohydrate Copper, Catalytic Decomposition of Hydrogen Peroxide
Yin Jie
(Xin yang Vocational and Technical College School of Chemical and Environmental Engineering, Henan, 464000 )
with acetamide and CuCl2- 2H2O at the ratio of 1:1 in ethanol reaction, acetamide copper complexes were synthesized. Infrared spectroscopy confirmed the structure. And that the complexes on catalytic decomposition of hydrogen peroxide reaction was studied.The results show that the complex has excellent catalytic activity, stable property and good repeatability.
dichloride acetamide·copper monohydrate;hydrogen peroxide;catalytic decomposition

表2 不同双氧水浓度下分解率(半小时)
O657.1 文献标示码:A
(责任编辑 牛玉娟)
河南省科技厅科技公关项目(152102110159)。
殷杰(1971~),男,信阳职业技术学院化学与环境工程学院,研究方向:应用化学和化学教育。
