菩人丹改善高糖波动状态下INS-1细胞胰岛素分泌功能的分子机制*
2016-04-10白颖慧杜子亮鲁碧楠庞宗然
白颖慧,杜子亮,陈 书,鲁碧楠,庞宗然Δ
(1.中央民族大学中国少数民族传统医学研究院,中国少数民族传统医学国家民委-教育部重点实验室,北京 100081;2.北京市回民医院,北京 100053)
菩人丹改善高糖波动状态下INS-1细胞胰岛素分泌功能的分子机制*
白颖慧1,杜子亮2,陈 书1,鲁碧楠1,庞宗然1Δ
(1.中央民族大学中国少数民族传统医学研究院,中国少数民族传统医学国家民委-教育部重点实验室,北京 100081;2.北京市回民医院,北京 100053)
目的:考察菩人丹改善高糖波动状态下INS-1细胞胰岛素分泌功能的分子机制。方法:将INS-1细胞置于含33.3 mmol ·L-1和11.1 mmol·L-1葡萄糖RPMI1640培养液内12 h交替培养,持续培养5 d构建高糖波动细胞模型。分别以5%、10%菩人丹含药血清对高糖波动状态下INS-1细胞干预24 h,并以二甲双胍含药血清作为阳性对照。正常对照组细胞以含11.1 mmol·L-1葡萄糖的RPMI1640培养液进行培养。采用CCK-8试剂盒检测细胞活力,大鼠胰岛素ELISA试剂盒测定胰岛素分泌量,Western blot分析IRS2、Akt、mTOR、P70s6k和PTP1B的蛋白质表达水平及磷酸化水平。结果:与正常组比较,高糖波动能够显著降低INS-1细胞活力及胰岛素分泌量,下调INS-1细胞的IRS2蛋白质表达水平,提高IRS2磷酸化水平,降低INS-1细胞Akt、mTOR和P70s6k的磷酸化水平,上调PTP1B蛋白质表达水平。与模型组比较,菩人丹含药血清能增加INS-1细胞活力及胰岛素分泌量,上调IRS2蛋白质表达,抑制IRS2磷酸化,促进Akt、mTOR和P70s6k的磷酸化,下调PTP1B蛋白表达水平。结论:菩人丹调控高糖波动诱导的INS-1细胞IRS2、Akt、mTOR、P70s6k和PTP1B的蛋白质表达水平及磷酸化水平,改善高糖波动状态下胰岛β细胞胰岛素分泌功能。
INS-1细胞;高糖波动;胰岛素分泌;菩人丹;IRS2-PI3K/Akt
2型糖尿病(type 2 diabetes mellitus,T2DM)的主要病理表现是糖脂代谢紊乱,而血糖水平的急性改变是T2DM患者糖代谢紊乱的重要形式。研究已证实[1-3],高糖状态下的血糖波动通过激活氧化应激、炎症通路等方式,导致胰岛β细胞数量异常减少和胰岛素分泌功能的下降,致使胰岛β细胞无法分泌足够的胰岛素以调节机体血糖稳态,从而加速T2DM的发生发展。因此,保护高糖波动(fluctuatedhigh glucose,FG)状态下胰岛β细胞功能,是减缓T2DM病程的基础。本实验以大鼠胰岛素瘤细胞系INS-1细胞为研究对象,体外模拟高糖波动状态下胰岛β细胞分泌功能的变化,考察中药降糖复方菩人丹(Pu Ren Dan,PRD)对胰岛β细胞胰岛素分泌的影响,并以胰岛素受体底物2/磷酸肌醇-3激酶/蛋 白 激 酶 B (insulin receptor substrate 2/ phosphoinositide 3-kinase/protein kinase B,IRS2-PI3K/Akt)信号通路为切入点,探讨菩人丹改善糖波动状态下INS-1细胞胰岛素分泌功能的分子机制。
1 实验材料
1.1 动物及细胞株
大鼠胰岛素瘤细胞系INS-1细胞株,购自协和医科大学细胞中心;SPF级雄性Wistar大鼠90只,8周龄,体质量300 g左右,购自北京维通利华实验动物技术有限公司(SCXK-军2007-004)。
1.2 主要药品及试剂
人参(亚威中药饮片有限公司)、丹参(金香中药饮片有限公司)、葛根(金香中药饮片有限公司)、制何首乌(亚威中药饮片有限公司)、制水蛭(金香中药饮片有限公司)、苦瓜冻干粉(诺金科生物技术有限公司)、盐酸二甲双胍片(双鹤药业)、Cell Counting Kit-8(CCK-8)(DOJINDO同仁化学研究所)、大鼠胰岛素ELISA试剂盒(RD Biosciences公司)、p-IRS2(ser731)、IRS2、p-Akt(thr308)、p-mTOR (ser2448)、p-P70s6k(thr389)(CellSignaling Technology公司)、PTP1B(Millipore公司)。
1.3 主要仪器
超净工作台(苏州苏洁净化设备有限公司),血球计数板(上海求精公司),多功能酶标仪(美国分子仪器公司),Bio-Rad电泳仪(美国伯乐仪器有限公司),水平脱色摇床(江苏其林贝尔仪器有限公司),湿转电泳槽(北京凯元信瑞仪器有限公司),Fresco低温冷冻离心机(美国 Thermo Scientific公司)。
1.4 菩人丹含药血清制备
1.4.1 中药菩人丹制备 菩人丹降糖方由苦瓜、人参、丹参、制首乌、葛根及水蛭组成。将人参、丹参、制首乌、葛根及水蛭以冷水浸泡过夜后,加8倍水回流提取2次,时间为1.5、1 h,其中人参单独提取,余药材一并提取,收集提取液过滤后合并,于旋转蒸发仪中浓缩。取苦瓜冻干粉加入之前药材浓缩液中,蒸馏水补齐,制备浓度相当于生药量7.21 g ·mL-1的菩人丹。
1.4.2 菩人丹含药血清制备 取SPF级雄性Wistar大鼠90只,8周龄,体质量(300 g±10 g),大鼠适应性喂养1周后,将大鼠按随机数字表法分为3组,即菩人丹组30只,二甲双胍阳性对照组30只和空白对照组30只,各组均饲以普通维持饲料。根据前期研究结果[8-13],确定大鼠给药体质量剂量为正常给药剂量的10倍,即菩人丹组以144.2 g(生药)·kg-1·d-1水煎液灌胃,二甲双胍阳性对照组以1.4 g·kg-1·d-1的二甲双胍0.5%CMC-Na乳浊液灌胃;空白对照组以0.5%CMC-Na溶液灌胃。各组大鼠的灌胃体积为10 mL·kg(体质量)-1,每日给药2次(间隔12 h),连续给药5 d。第5天首次给药(即第9次给药)后1 h,腹腔注射10%水合氯醛(体质量剂量3 mL·kg-1)麻醉大鼠,腹主动脉取血,血样室温静置3 h,3500 rpm离心15 min取上清,分别将各组大鼠血清混合,56℃水浴灭活30 min,一次性无菌微孔滤膜(0.22 μm)过滤灭菌,分装后-80℃保存备用。
2 实验方法
2.1 细胞培养
INS-1细胞在完全RPMI1640培养液(含10%胎牛血清,葡萄糖11.1 mmol·L-1,1 mmol·L-1丙酮酸钠,2 mmol·L-1L-谷氨酰胺,10 mmol·L-1HEPES,50 μmol·L-1β-巯基乙醇,100 kU/L青霉素,100 mg/L链霉素)中培养,每3 d更换1次培养基,待细胞处于对数生长期后予以传代。
2.2 模型复制及分组
取同代 INS-1细胞置于含33.3 mmol·L-1和11.1 mmol·L-1葡萄糖的RPMI1640培养液内12 h交替培养,持续培养5 d。将INS-1细胞等密度接种于培养板中,待细胞完全贴壁后随机分组并进行干预:正常对照组(Control组,常规 RPMI1640中培养)、高糖波动模型组(FG组,高糖RPMI1640培养液与常规RPMI1640中交替培养5 d,每12 h交替,后以常规RPMI1640培养24 h)、菩人丹药物血清高剂量组(H-PRD组,FG组细胞中加入终浓度10%的菩人丹含药血清常规RPMI1640培养液干预24 h)、菩人丹药物血清低剂量组(L-PRD组,FG组细胞中加入终浓度5%的菩人丹含药血清常规RPMI1640培养液干预24 h)、二甲双胍药物血清对照组(MF组,FG组细胞中加入终浓度10%的二甲双胍含药血清培养液干预24 h)。
2.3 细胞活力检测
收集对数生长期的INS-1细胞,将细胞浓度调整至1×105cells·mL-1并接种于96孔板,每孔200 μL,于5%CO2、37℃恒温湿化培养箱中培养。各组细胞干预结束后按照CCK-8试剂盒说明书操作,酶标仪测定450 nm处的吸光度(A),以Control组A为对照,按照干预组A/正常组A×100%计算各组细胞活力。
2.4 葡萄糖刺激的胰岛素释放实验
将INS-1细胞按2×105/孔的密度接种于24孔板中培养到80%~90%融合,磷酸盐缓冲液(PBS)清洗2遍后,加入含有3 mmol·L-1葡萄糖的Krebs-Ringer HEPES缓冲液(KRBH缓冲液,含有 115 mmol·L-1氯化钠,24 mmol·L-1碳酸氢钠,5 mmol· L-1氯化钾,1 mmol·L-1氯化镁,25 mmol·L-1HEPES,0.5%BSA,pH 7.4),在37℃下平衡20 min弃去上清,分别加入含3 mmol·L-1或20 mmol·L-1葡萄糖的KRHB缓冲液,37℃孵育20 min,小心吸取上清液(注意尽量不要吸到细胞)后4℃离心800 rpm,5 min,收集上清后采用ELISA法测定胰岛素分泌量。相应的细胞加200 μL细胞裂解液,BCA法测每组细胞总蛋白含量。每组实验均设复孔,重复3次。通过总蛋白含量对胰岛素释放量进行校正,计算出各组细胞的基础胰岛素分泌(basal insulin secretion,BIS)和葡萄糖刺激的胰岛素分泌(glucose-stimulated insulin secretion,GSIS)。
2.5 Western blot分析
利用western blot分析检测胰岛素受体底物2 (insulin receptor substrate 2,IRS2)、蛋白激酶 B (protein kinase B,Akt)、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)、40S核糖体S6蛋白激酶(P70 ribosomal protein S6 kinases,P70s6k)和蛋白质酪氨酸磷酸酶1B(protein tyrosine phosphatase 1B,PTP1B)的蛋白质表达水平及磷酸化水平。收集各组细胞,按RIPA蛋白抽提试剂盒说明抽取各组细胞总蛋白,用BCA法检测蛋白质浓度。制备蛋白样品转膜、封闭,置于一抗(p-IRS2 (ser731)1∶1000、IRS 1∶1000、p-Akt(thr308)1∶1000、p-mTOR(ser2448)1∶2000、p-P70s6k(thr389)1∶1000、PTP1B 1∶4000)中4℃过夜,次日置于二抗(1∶20000)中,摇床上室温孵育40 min,ECL发光显色,Bio-Rad图像分析系统对Western印迹目的条带进行扫描,然后用Quantity One软件分析目的条带光密度值与内参条带光密度值的比值来评估结果。
2.6 统计学方法
采用SPSS 18.0统计软件进行统计分析,正态分布资料以均数±标准差(±s)表示,2组间比较采用两样本均数的t检验,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
3 结果
3.1 菩人丹对高糖波动状态下INS-1细胞的活力检测
图1显示,采用CCK-8试剂盒测定细胞活力,结果显示INS-1细胞在含33.3 mmol·L-1葡萄糖的培养液和含11.1 mmol·L-1葡萄糖的培养液中培养5 d后,细胞活力显著降低,以常规培养液培养的INS-1细胞(细胞活力为100%)为对照,FG组细胞活力下降至(57.40% ±5.32%,P<0.001)。分别给予低剂量(5%)和高剂量(10%)菩人丹含药血清对高糖波动损伤INS-1细胞进行24 h干预,结果LPRD组与FG组的细胞活力比较差异无统计学意义(60.40%±3.58%,P=0.275),但H-PRD组作用24 h后,INS-1细胞活力较 FG组细胞明显升高(80.00%±4.12%,P<0.001)。
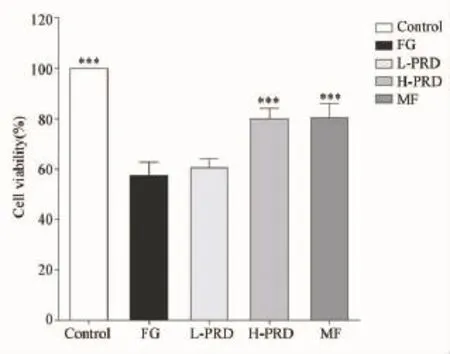
图1 菩人丹对高糖波动状态下INS-1细胞的活力检测注:与FG组比较:*P<0.05,**P<0.01,***P<0.001
3.2 菩人丹对高糖波动状态下INS-1胰岛素分泌功能的影响
图2显示,利用ELISA方法对INS-1细胞的胰岛素分泌量进行检测。实验结果显示,与正常对照组比较,INS-1细胞的基础胰岛素分泌量(BIS)由(0.77±0.07)μU/mg/h下降至(0.522±0.065) μU/mg/h(P<0.001),葡萄糖刺激的胰岛素分泌(GSIS)则由(1.908±0.085)μU/mg/h降低至(0.61±0.117)μU/mg/h(P<0.001);低剂量菩人丹干预24 h后,INS-1细胞的BIS与FG组比较无明显改变,但GSIS显著升高(0.826±0.065 μU/mg/ h,P=0.009);高剂量即菩人丹可以明显增加INS-1细胞的胰岛素分泌量,BIS增加至(0.692±0.006) μU/mg/h(P<0.001),GSIS增加至(1.21±0.123) μU/mg/h(P<0.001)。

图2 菩人丹对高糖波动状态下INS-1细胞胰岛素分泌功能的影响注:与FG组比较:*P<0.05,**P<0.01,***P<0.001
3.3 菩人丹对INS-1细胞IRS2、Akt、mTOR、P70s6k和PTP1B的蛋白质表达水平及磷酸化水平的影响
3.3.1 菩人丹对高糖波动状态下INS-1细胞IRS2蛋白质表达及磷酸化的影响 图3显示,与Control组比较,FG组INS-1细胞的IRS2蛋白质表达水平明显下调(63.00% ±4%,P<0.001),菩人丹则能显著上调高糖波动状态下损伤INS-1细胞的IRS2蛋白质表达水平,菩人丹干预组细胞的IRS2蛋白质表达水平与FG组比较升高(86.00%±4%,P<0.001);与Control组比较,FG组IRS2(ser731)磷酸化水平升高(318.00% ±18%,P<0.001),菩人丹作用24 h后,损伤INS-1细胞IRS2(ser731)磷酸化水平显著降低(72.00%±3%,P<0.001)。
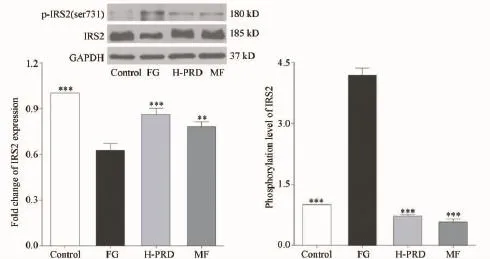
图3 菩人丹对高糖波动状态下INS-1细胞IRS2蛋白质表达及ser731位点磷酸化的影响注:与FG组比较:*P<0.05,**P<0.01,***P<0.001
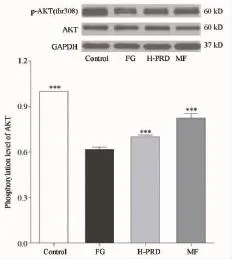
图4 菩人丹对高糖波动状态下INS-1细胞Akt(thr308)磷酸化的影响注:与FG组比较:*P<0.05,**P<0.01,***P<0.001
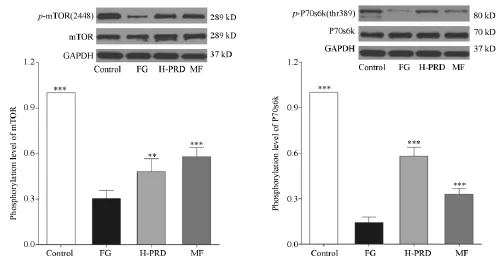
图5 菩人丹对高糖波动状态下INS-1细胞mTOR(ser2448)和P70s6k(thr389)磷酸化的影响注:与FG组比较:*P<0.05,**P<0.01,***P<0.001

图6 菩人丹对高糖波动状态下INS-1细胞PTP1B蛋白表达水平的影响注:与FG组比较:*P<0.05,**P<0.01,***P<0.001
3.3.2 菩人丹对高糖波动状态下INS-1细胞Akt(thr308)磷酸化的影响 图4显示,高糖波动状态下Akt苏氨酸308位点磷酸化水平明显降低,与Control组比较,FG组Akt(thr308)磷酸化水平下降(62%±2%,P<0.001)。菩人丹可上调INS-1细胞Akt(thr308)磷酸化水平,促进Akt活化。菩人丹作用24 h后,FG损伤细胞的Akt(thr308)磷酸化水平升高(70%±1%)。
3.3.3 菩人丹对高糖波动状态下INS-1细胞mTOR(ser2448)和P70s6k(thr389)磷酸化的影响图5显示,高糖波动状态下 INS-1细胞 mTOR (ser2448)的磷酸化水平显著下降,FG组 mTOR (ser2448)磷酸化水平较 Control组下降(30% ± 5%,P<0.001),菩人丹作用24 h后,INS-1细胞mTOR(ser2448)磷酸化水平上调(48%±8%,P= 0.006)。作为mTOR效应因子的P70s6k,其thr389位点的磷酸化在高糖波动状态下被显著抑制;与Control组比较,FG组P70s6k(thr389)磷酸化水平下降(14%±4%,P<0.001),菩人丹作用24 h后,FG组细胞 P70s6k(thr389)磷酸化水平均显著升高(58%±6%,P<0.001)。
3.3.4 菩人丹对高糖波动状态下INS-1细胞PTP1B蛋白质表达的影响 图6显示,高糖波动状态下,INS-1细胞的PTP1B蛋白质表达显著上调,与control组比较,FG组 PTP1B蛋白质表达水平(126%±8%,P=0.002),菩人丹作用24 h后,FG损伤细胞PTP1B蛋白表达水平下调(64%±10%,P<0.001)。
4 讨论
血糖波动不仅是糖尿病慢性并发症重要的独立危险因素,而且与胰岛β细胞功能密切相关。研究发现,血糖水平波动较大时β细胞功能减低明显高于较小的血糖水平波动,提示胰岛β细胞功能损害的严重程度与血糖波动幅度的大小有关。邱平等[10]通过体外实验证明,波动性高糖可显著降低细胞的GSIS,并推测其机制可能涉及线粒体氧化应激损伤。课题组前期研究也证实了波动性高糖对胰岛β细胞的损伤作用[6]。
IRS2是维护胰岛β细胞功能的关键信号蛋白。Hennige等[11]发现,小鼠β细胞内IRS2表达增加可以促进β细胞生长、存活和改善其胰岛素分泌功能。本实验发现,高糖波动状态下INS-1细胞的IRS2蛋白表达水平显著降低,这可能是与高糖波动状态下IRS2的异常降解有关。同时我们发现,IRS2丝氨酸731位点磷酸化水平却明显增高,这可能是由于高糖波动状态抑制蛋白酪氨酸激酶的活化,而菩人丹干预后INS-1细胞的IRS2蛋白质表达水平明显升高,IRS2丝氨酸731位点磷酸化水平明显下降,说明菩人丹能有效抑制IRS2蛋白降解和IRS2蛋白731位点丝氨酸磷酸化,从而修复高糖波动状态下INS-1细胞的胰岛素信号传导障碍。
AKT分子通过不同的下游底物调节胰岛β细胞大小、数量、细胞内的基因转录以及细胞分泌功能[12]。本实验发现,在高糖波动状态下Akt苏氨酸308位点磷酸化水平明显降低,进而使INS-1细胞胰岛素分泌功能下降。
mTOR是磷脂酰肌醇相关蛋白激酶(PIKK)的家族成员,具有丝氨酸/苏氨酸激酶活性,可以响应细胞外信号,激活下游效应因子,参与基因转录、蛋白质翻译等过程,以调节β细胞生存、增殖及蛋白质合成。P70s6k是mTOR的下游靶蛋白,是mTOR效应因子中研究最广泛的,P70s6k的Thr389磷酸化被认为是mTOR激活的镜子[13]。本实验观察到,在高糖波动状态下INS-1细胞mTOR和P70s6k活性均受到抑制,mTOR(ser2448)和P70s6k(thr389)磷酸化水平均显著降低。而菩人丹干预后,mTOR和P70s6k的磷酸化水平均明显升高,提示菩人丹可通过促进 Akt和 mTOR的磷酸化水平进而活化P70s6k,使细胞总体蛋白质翻译水平升高,从而促进INS-1细胞的增殖。
PTP1B可在胰岛素信号级联中的多个位点发挥负调控作用,过度表达PTP1B能增加胰岛素受体、胰岛素受体底物的脱磷酸化,并下调受体后信号,从而引起胰岛素信号传导障碍并引发胰岛素抵抗甚至T2DM。研究表明[14],敲除PTP1B基因后,小鼠胰岛素敏感性显著增强,即使在高脂高热卡饮食环境下,小鼠也不出现肥胖或胰岛素抵抗,若重新表达PTP1B,原本增强的胰岛素敏感性则会出现显著减弱。本实验证实,在高糖波动状态下,INS-1细胞PTP1B蛋白质表达水平显著上调,而菩人丹干预后细胞PTP1B蛋白质表达水平下降,说明菩人丹部分抑制PTP1B对胰岛素信号传导的负性调控,从而改善INS-1细胞IRS2/PI3K/Akt信号传导。
前期研究表明,菩人丹具有降糖、调脂、减轻胰岛素抵抗、抑制胰岛β细胞凋亡、保护胰岛β细胞功能的作用[4-9]。本实验在此基础上,进一步考察了菩人丹对高糖波动胰岛β细胞胰岛素分泌功能的影响,揭示了菩人丹通过调控IRS2/PI3K/Akt信号通路中IRS2、Akt、mTOR/P70s6k和PTP1B蛋白质表达水平及其磷酸化水平,改善胰岛β细胞分泌功能的分子机制,为菩人丹修复胰岛β细胞损伤,防治T2DM的临床应用提供了实验依据。
[1]HOU,Li HL,ZHAO JJ,et al.Impairment of pancreatic islet beta cell function induced by intermittent high glucose through oxidative and endoplasmic reticulum stress:experiment with rat pancreatic islet beta cells[J].Zhonghua Yi Xue Za Zhi,2008,88(28):2002-2004.
[2] SYEDA K,MOHAMMED A M,ARORA D K,et al.Glucotoxic conditions induce endoplasmic reticulum stress to cause caspase 3 mediated lamin B degradation in pancreatic beta-cells:protection by nifedipine[J].Biochem Pharmacol,2013,86(9):1338-1346.
[3]KIM M,CHUNG H,YOON C,et al.Increase of INS-1 cell apoptosis under glucose fluctuation and the involvement of FOXOSIRT pathway[J].Diabetes Res Clin Pract,2012,98(1):132-139.
[4]庞宗然,赵玉堂,李静华,等.菩人丹超微粉对肥胖型2型糖尿病大鼠糖代谢相关指标的影响[J].中国实验方剂学杂志,2010,16(5):107-110.
[5]金英,鲁碧楠,刘祖涵,等.菩人丹对T2DM大鼠胰岛β细胞分泌功能及胰岛素敏感性的影响[J].中国中医基础医学杂志,2012,18(10):1090-1092.
[6]鲁碧楠.菩人丹对糖脂毒导致的INS-1细胞损伤的修复作用及机制研究[D].北京:中央民族大学,2013.
[7]杜子亮,鲁碧楠,陈书,等.菩人丹对高糖诱导的INS-1细胞凋亡、BAD和FOXO1蛋白表达的影响[J].中国实验方剂学杂志,2013,19(22):173-177.
[8] 陈书,鲁碧楠,杜子亮,等.菩人丹调控IRS2、BAD、FOXO1蛋白表达和磷酸化抑制INS-1细胞凋亡的分子机制[J].中国中医基础医学杂志,2013,19(11):1341-1344.
[9]鲁碧楠,苏占辉,苏晓慧,等.菩人丹超微粉对T2DM大血管损伤大鼠骨骼肌IRS-1,GLUT-4,PI-3K,NF-κB蛋白表达的影响[J].中国实验方剂学杂志,2013,19(9):210-214.
[10]邱平,赵铁耘,李秀钧,等.间断高浓度葡萄糖对胰岛β细胞的损伤机制研究[J].四川大学学报:医学版,2008,39 (6):69-71,93.
[11] HENNIGE A M,SARTORIUS T,TSCHRITTER O, et al.Tissue selectivity ofinsulin detemiraction in vivo[J].Diabetologia,2006,49(6):1274-1282.
[12]MIAO X Y,GU Z Y,LIU P,et al.The human glucagon-like peptide-1 analogue liraglutide regulatespancreatic beta-cell proliferation and apoptosis via an AMPK/mTOR/P70S6K signaling pathway[J].Peptides,2013,39:71-79.
[13]李小明,杨作成,陈淳媛,等.mTOR/p70S6K信号通路与NIH3T3成纤维细胞增殖[J].现代预防医学,2008,35 (18):3582-3584.
[14]PANZHINSKIY E,REN J,NAIR S. Protein tyrosine
phosphatase 1B and insulin resistance:role of endoplasmic reticulum stress/reactive oxygen species/nuclear factor kappa B axis[J].PLoS One,2013,8(10):e77228.
Purendan Improving the Molecular Mechanism of Ins-1 Cell Insulin Secretion under High Glucose Fluctuation
BAI Ying-hui1,DU Zi-liang2,CHEN Shu1,LU Bi-nan1,PANG Zong-ran1Δ
(1.Institute of Chinese Minority Traditional Medicine,Mizu University of China.Key Laboratory for Chinese Minority Traditional Medicine of Ministry of Education,Beijing 100081,China;2.The Moslem Hospital of Bejing,Beijing 100053,China)
Objective:To study the molecular mechanism of Pu Ren Dan improving the secretion function of INS-1 cell under fluctuated high glucose.Methods:INS-1 cell was cultured in high glucose RPMI1640 medium containing 33.3 mmol ·L-1glucose and conventional RPMI1640 medium containing 11.1 mmol·L-1glucose each 12 hours for 5 days to induce fluctuated high glucose cell model.INS-1 cell was intervened in 5%and 10%drug serum containing PRD for 24 hours as PRD experimental group,drug serum containing Metformin as the positive control group.The INS-1 cell in the normal control group was cultured in RPMI1640 medium containing 11.1 mmol·L-1glucose.Using CCK-8 kit to detect cell viability,ELISA to test the insulin secretion of INS-1 cell,Western blot assay to test proteins expression and phosphorylation levels of IRS2,Akt,mTOR,P70s6k,PTP1B.Results:Compared with the control group,cell viability and insulin secretion level of INS-1 cell in FG decreased significantly.Protein expression level of IRS2 decreased,phosphorylation of IRS-2 increased;phosphorylations of Akt,mTOR and P70s6k lowered significantly;while the protein expression level of PTP1B increased.Compared with the model group,cell viability and insulin secretion level of INS-1 cell in PRD experimental group increased significantly.Protein expression level of IRS2 increased,phosphorylation of IRS2 lowered;phosphorylations of Akt,mTOR and P70s6k increased significantly;while the protein expression level of PTP1B decreased.Conclusion:Pu Ren Dan regulates the protein expression and phosphorylation levels of IRS2,Akt,mTOR,P70s6k and PTP1B of INS-1 cell induced by fluctuated high glucose,improving the insulin secretion function of INS-1 cell under fluctuated high glucose.
INS-1 cell;Fluctuated High Glucose;Insulin secretion;Pu Ren Dan;IRS2-PI3K/Akt
R285.5
B
1006-3250(2016)12-1620-05
2016-05-27
国家自然科学基金资助项目(81072963)-菩人丹超微粉调控PTP1B蛋白与IRS2/PI3K/Akt信号转导改善胰岛β细胞形态与功能的作用机制;国家自然科学基金青年基金项目(81302946)-基于IR信号转导系统的菩人丹修管T2DM胰岛β细胞损伤作用靶点研究
白颖慧(1991-),女,河南新密人,在读硕士,从事2型糖尿病发病机制及其传统医药干预研究。
△通讯作者:庞宗然(1966-),男,研究员,博士研究生导师,从事糖尿病及其并发症发病机制与中医药干预研究,Tel: 010-68935090,E-mail:zrpang@163.com。
