元素及其化合物专题复习检测
2016-04-08江苏朱伟刚
江苏 朱伟刚
元素及其化合物专题复习检测
江苏 朱伟刚
可能用到的相对原子质量:H—1 C—12 N—14 O—16 Na—23 Mg—24 S—32 Cl—35.5
一、选择题(本题包括7小题,每小题6分,共42分。每小题有一个选项符合题意)
1.下列有关物质性质的应用正确的是( )
A.常温下干燥氯气与铁不反应,可以用钢瓶储存氯水
B.二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸
C.二氧化硫有漂白、杀菌性能,可在食品生产中大量使用
D.次氯酸钠具有强氧化性,可用于配制消毒液用于消毒
2.下列事实或现象可用同一原理进行解释的是( )
A.硝酸银溶液与液溴保存在棕色瓶中避光
B.I2溶于CCl4中,Cl2溶于NaOH溶液中
C.将酸雨暴露在空气中和将SO2通入氯水中pH都会变小
D.铁在冷的浓硫酸中或铝在冷的浓硝酸中都没有明显变化
3.下表中的陈述均正确并且前后存在因果关系的是( )
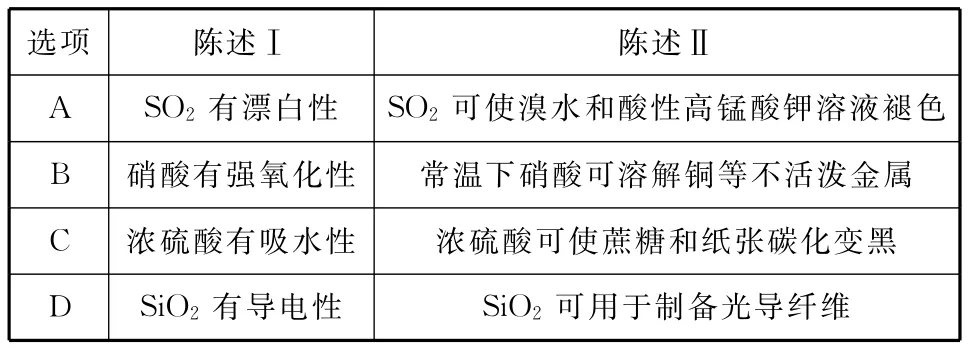
选项_ _____陈述Ⅰ陈述Ⅱ__A SO2有漂白性__ SO2可使溴水和酸性高锰酸钾溶液褪色__B 硝酸有强氧化性_ ___常温下硝酸可溶解铜等不活泼金属__C 浓硫酸有吸水性_ ____浓硫酸可使蔗糖和纸张碳化变黑__D SiO2有导电性__ ______SiO2可用于制备光导纤维_______
4.甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下图转化关系。下列有关物质的推断正确的是( )
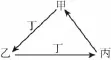
A.若甲为N2,则丁可能是O2
B.若甲为Fe,则丁可能是Cl2
C.若甲为AlCl3,则丁可能是NH3
D.若甲为NaHCO3,则丁可能是HCl
5.在复杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断正确的是( )
A.在含等物质的量的AlO-2、OH-、CO2-3的溶液中,逐滴加入盐酸:AlO-2、OH-、CO2-3
B.在含等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气:I-、Br-、Fe2+
C.在含等物质的量的Ba(OH)2、KOH的溶液中,缓慢通入CO2:KOH、Ba(OH)2、K2CO3、BaCO3
D.在含等物质的量的Fe3+、Cu2+、H+的溶液中加入锌粉:Fe3+、Cu2+、H+
6.下列离子或分子在溶液中能大量共存,且能满足相应要求的是( )

选项_ _________离子或分子要求__A K+、ClO、Cl-、HS-通入氯气时立即有沉淀产生__B Fe3+、MnO-4、SO2-3、Cl-____滴加盐酸立即有气体产生___滴加NaOH溶液立即有气体C NH+4、Al3+、SO2-4、CH3COOH _______ ____________________________产生D Na+、HCO-3、Ca2+、I-滴加NaOH溶液立即有沉淀_______ ____________________________产生
7.硝酸的还原产物比较复杂,硝酸越稀,还原产物中氮元素的化合价越低。某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出。在反应结束后的溶液中,逐滴加入5mol/L的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。下列说法不正确的是( )

B.DE段反应的离子方程式为:NH4++OH-=== NH3·H2O
C.合金中铁和铝的物质的量之比为1∶3
D.图象中C点所加NaOH溶液的体积为7mL
二、非选择题(本题包括3小题,共58分)
8.(22分)A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去)。

(1)若A是一种黄色单质固体,则B→C的化学方程式为_________________________。
(2)若A是一种活泼金属,C是淡黄色固体,则C的名称为_____________。将C长期露置于空气中,最后将变成物质D,D的化学式为_____________。现有D和NaHCO3的固体混合物10g,加热至质量不再改变,剩余固体质量为9.38g,D的质量分数为________。
(3)若C是红棕色气体,A可能是一种能使湿润的红色石蕊试纸变蓝的气体。下图是实验室制取A气体的装置,请结合所学知识,回答下列问题:
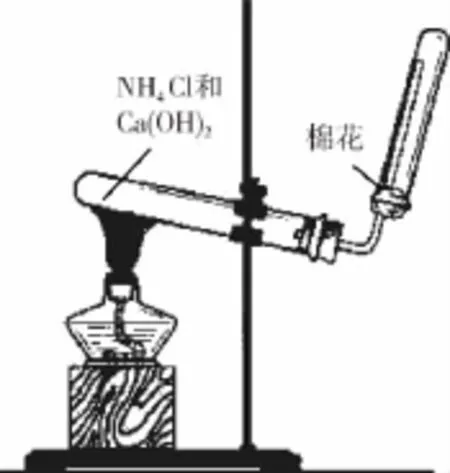
①收集A的方法是________,验证A是否已经收集满的方法是________(任写一种)。
②写出实验室制取A的化学方程式:_______________ _______________。
③若有5.35g氯化铵参加反应,则产生的A气体在标准状况下的体积为______L。
④试写出C与水反应的化学方程式:_______________ ____,反应可得到酸X,如下图。足量X的浓溶液与Cu反应,写出烧瓶中发生反应的离子方程式:_________________ ______。实验完毕后,试管中收集到的气体的主要成分为_____________(写化学式)。

9.(17分)镁及其化合物在生产生活中有重要的作用。以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁的主要流程如下:
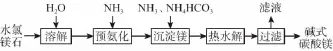
(1)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为___________________。指出该物质在工农业生产中的一种用途:________________________________________ _____________________________________________________。
(2)写出预氨化时发生的主要反应的离子方程式:____ ________________________。
(3)沉淀镁时反应的温度不宜过高,原因是__________ ___________________。
(4)设计一个实验,确定产品碱式碳酸镁aMgCO3· bMg(OH)2·cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量;②高温分解;③______________________;④___________________;⑤称量MgO。
18.2g产品完全分解后,产生6.6g CO2和8.0g MgO,由此可知,产品的化学式中:
a=________;b=________;c=________。
(5)从水氯镁石中可以提取无水氯化镁,电解熔融态的无水氯化镁可以得到金属镁。有同学认为:电解熔融的MgO也可制金属镁,在实际生产中可简化生产步骤,体现生产的简约性和经济性原则。你同意该同学的想法吗?为什么?你的观点是________。理由是____________________ ______________________________________________________。
10.(19分)二氧化硫是一种大气污染物,同时也是一种重要的化工原料。
(1)某化学兴趣小组采用图1所示装置制取并探究SO2气体的某些性质。
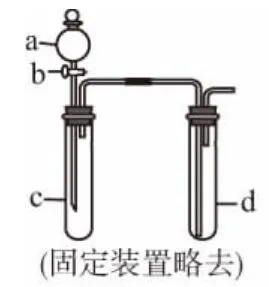
图1
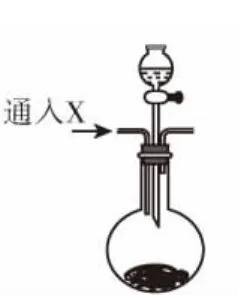
图2
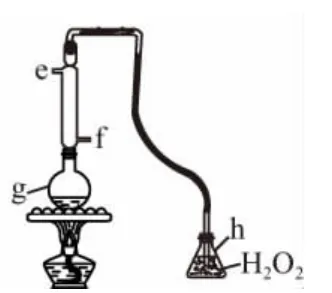
图3
①下列实验方案适用于用图1所示装置制取所需SO2的是________(填序号)。
A.Na2SO3溶液与HNO3
B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧
D.铜与浓H2SO4
②若要证明c中生成的气体是SO2,d中加入品红溶液后,打开活塞b,反应开始,待d中溶液___________后,再_____________(填实验的操作)试管d中的溶液,颜色又恢复,证明气体是SO2。
③同学们设计的探究装置中存在一个明显的缺陷,请你进行改进并补充完整(用文字说明即可):_____________ _______________________________________。
(2)在图1装置的d试管中加入BaCl2溶液,实验后发现d中有白色沉淀生成。为了探究沉淀的组成,同学们往d中加入过量稀盐酸,发现沉淀不溶解,你认为留下的沉淀物是________,形成该沉淀的主要原因是_________________ _______________。为了进一步验证沉淀产生的原因,研究小组另取BaCl2溶液,加热煮沸,冷却后及时加入少量苯液封,然后再通SO2,结果发现沉淀量减少,但仍有轻微浑浊。研究小组改用图2制气装置,再进行实验,d中没有出现浑浊。下列气体可作为X气体的是________(填序号,不定项选择)。
A.CO2B.NH3
C.O3D.N2
E.NO2
(3)SO2通常作为保护剂添加到葡萄酒中,有杀菌、抗氧化、澄清、溶解、改善风味和增酸的作用,但吸入过量的SO2对人体有害。我国国家标准规定葡萄酒中SO2的最大使用量为0.25g·L-1。图3为该兴趣小组对葡萄酒中的SO2进行收集与测量的装置。
①冷凝管中水的进口为________(填“e”或“f”)。
②g中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与h中H2O2完全反应,反应的化学方程式为____________________________。
③除去h中过量的H2O2,然后用0.090 0mol/L NaOH标准溶液进行滴定,滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为________g/L。
参考答案及解题提示
1.D 【解析】常温下干燥氯气与铁不反应,可以用钢瓶储存液氯,不能储存氯水;二氧化硅不与一般的酸发生反应,但可以与氢氟酸反应,氢氟酸应保存在塑料瓶中;二氧化硫有毒,不能在食品生产中大量使用。
2.D 【解析】硝酸银见光易分解,溴易挥发;I2溶于CCl4中是一种物理溶解,Cl2溶于NaOH溶液中发生了化学反应;酸雨pH变小是因为H2SO3变成了H2SO4,SO2通入氯水pH变小是因为反应生成了HCl和H2SO4;铁和铝在冷的浓硝酸或浓硫酸中能发生钝化。
3.B 【解析】SO2使溴水和酸性高锰酸钾溶液褪色是其还原性所致,A错误;硝酸有强氧化性,能将铜等不活泼金属氧化而使之溶解,B错误;浓硫酸使蔗糖和纸张碳化变黑是其脱水性所致,C错误;SiO2没有导电性,D正确。
4.A 【解析】若甲为N2,丁是O2时,乙是NO,丙是NO2,A正确;若甲为Fe,丁是Cl2时,乙是FeCl3,FeCl3与Cl2不反应,B错误;若甲为AlCl3,丁是NH3时,乙是Al(OH)3,Al(OH)3与NH3或氨水不反应,C错误;若甲为NaHCO3,丁是HCl时,乙是NaCl,NaCl和HCl不反应,D错误。
5.D 【解析】Al(OH)3能与OH-反应,A项反应的正确顺序是:OH-、AlO-2、CO2-3;离子的还原性:I->Fe2+>Br-,B项反应的正确顺序是:I-、Fe2+、Br-;Ba2+能与反应生成的CO2-3结合生成沉淀,C项反应中,正确的反应顺序是:Ba(OH)2、KOH、K2CO3、BaCO3;离子的氧化性:Fe3+>Cu2+>H+,D项反应的顺序正确。
6.D 【解析】ClO-有强氧化性,能将HS-离子氧化,A错误;Fe3+和MnO-4能将SO2-3氧化,B错误;C组溶液有醋酸,滴加NaOH溶液时,NaOH先与醋酸反应,然后再与NH+4反应放出氨气,C错误;在D项溶液中加NaOH溶液时,HCO-3与OH-反应生成的CO2-3立即与Ca2+反应生成沉淀。
7.C 【解析】因为硝酸与金属反应没有气体放出,故硝酸的还原产物为NH+4,A项正确;加入NaOH溶液时,DE段没有沉淀产生,发生的反应是NH+4+OH-==NH3·H2O,B项正确;EF段是Al(OH)3溶于NaOH溶液,n[Al(OH)3]=n(NaOH)=5mol/L×2×10-3L=0.01mol,即原混合物中含有0.01mol Al;n(NH+4)=5mol/L×3×10-3L=0.015mol,反应中转移电子0.015mol×8=0.12mol,故Fe和Al的物质的量之和为0.12mol÷3=0.04mol,Fe为0.03mol,铁和铝的物质的量之比为3∶1,C项错误;沉淀0.04mol Al3+和Fe3+需要0.12mol NaOH,其溶液体积为24mL,故C点所加NaOH溶液的体积为31mL-24mL=7mL,D项正确。
(2)过氧化钠 (1分) Na2CO3(2分) 83.2%(3分)
(3)①向下排空气法 (2分)
将湿润的红色石蕊试纸置于试管口处,若试纸变蓝,则证明氨气已收集满 (2分)
(或用蘸有浓盐酸的玻璃棒靠近试管口处,若产生大量白烟,则证明氨气已收集满)
②Ca(OH)2+2NH4ClCaCl2+2NH3↑+2H2O
Cu+4H++2NO3-===Cu2++2NO2↑+2H2O(2分) NO (2分)
【解析】(1)若A是一种黄色单质固体,则A是S,B是SO2,C是SO3。
(2)若A是一种活泼金属,C是淡黄色固体,则A是钠,C是过氧化钠。将过氧化钠长期置于空气中,最终生成碳酸钠。加热10g Na2CO3和NaHCO3的混合物,剩余固体质量为9.38g,减少的质量为0.62g,其中CO2和H2O的物质的量之比为1∶1,44x+18x=0.62,x=0.01mol,即n(NaHCO3)=0.02mol,m(NaHCO3)=0.02mol×84g/mol= 1.68g,混合物中Na2CO3的质量分数为×100%=(2分)
③2.24 (2分)
④3NO2+H2O ===2HNO3+NO (2分)83.2%。
(3)若C是红棕色气体,A可能是一种能使湿润的红色石蕊试纸变蓝的气体,则A是NH3,B是NO,C是NO2。 n(NH3)=n(NH4Cl)==0.1mol,在标准状况下,生成NH3的体积为2.24L。NO2与水反应生成硝酸,浓硝酸与铜反应生成NO2,NO2与水反应生成NO,通过排水法收集到的气体是NO。
9.(1)NH4Cl (2分) 做氮肥(或其他合理答案)(1分)
(2)Mg2++2NH3·H2O ===Mg(OH)2↓+2H2O(2分)
(3)防止碳酸氢铵分解 (2分)
(4)③测出CO2的质量 (2分) ④测出水蒸气的质量 (2分) 3 (1分) 1 (1分) 3 (1分)
(5)不同意 (1分) MgO熔点很高,熔融时耗费大量的能量而增加生产成本 (2分)
【解析】测定一定质量碱式碳酸镁分解生成生成的CO2、水蒸气和MgO的质量,求出物质的量之比即可确定其化学式。4.66g碱式碳酸镁分解的产物中,n(MgO)=所以,n(MgO)∶n(CO2)∶n(H2O)=0.2∶ 0.15∶0.2=4∶3∶4,碱式碳酸镁用氧化物表示的化学式为4MgO·3CO2·4H2O,即3MgCO3·Mg(OH)2· 3H2O。10.(1)①B (2分) ②褪色 (1分) 加热 (1分)③d中导气管通入NaOH溶液中,吸收尾气中的SO2(2分)
(2)BaSO4(2分) SO2在溶液中被O2氧化生成了H2SO4(2分) AD (3分)
(3)①f (1分) ②SO2+H2O2===H2SO4(2分)③0.24 (3分)
【解析】(1)①该装置适用于固体和液体反应制气体。硝酸有强氧化性,能将SO2-3氧化为SO2-4,A错误;Na2SO3固体与浓硫酸反应能生成SO2气体,B正确;固体硫在纯氧中燃烧能生成SO2,但不满足装置要求,C错误;铜与浓H2SO4反应要加热,D错误。②SO2有漂白性,能使品红溶液褪色,加热后溶液又恢复红色,据此可证明气体是SO2。③该装置中缺少尾气吸收装置,容易造成环境污染,应将尾气通入NaOH溶液中。
(2)SO2不能与BaCl2溶液反应生成沉淀,但SO2(或H2SO3)易被空气中的氧气氧化生成H2SO4,所以d中的沉淀物是BaSO4。改用图2制气装置实验,通入的气体X应该是不能氧化SO2(或H2SO3)的CO2或N2;O3和NO2都有强氧化性,不符合要求;NH3能与SO2(或H2SO3)反应生成(NH4)2SO3,(NH4)2SO3能与BaCl2溶液反应生成BaSO3沉淀,也不符合要求。
(3)①冷凝管中冷却水应下进上出,水的进口为f。②SO2能被H2O2氧化为H2SO4。③n(SO2)=n(H2SO4)=n(NaOH)=×0.090 0mol/L×25.00×10-3L= 1.125×10-3mol,m(SO2)=64g/mol×1.125×10-3mol= 0.072g,该葡萄酒中SO2含量为0.072g/0.3L=0.24g/L。
(作者单位:江苏省常州市横山桥高级中学)
