四步法完成陌生氧化还原反应方程式
2016-04-08广东陈彬城
广东 陈彬城
四步法完成陌生氧化还原反应方程式
广东 陈彬城
高考对氧化还原反应的考查,不局限于基础知识,还要求考生能够将实际问题分解,通过运用氧化还原反应相关知识,采用分析、综合的方法,解决简单化学问题。
纵观近几年各省市的化学高考题,氧化还原反应是高考热点,而需要运用相关知识,采用分析、综合方法才能完成的“陌生”氧化还原反应方程式的书写,是高考难点。面对纷繁芜杂的氧化还原反应方程式,很多考生束手无策。那么,有没有什么方法,可以又快又准的写出氧化还原反应方程式呢?以下介绍“四步法”,即分四个步骤完成氧化还原反应方程式。
一、理论基础
1.掌握氧化还原反应的基本知识
熟悉氧化还原反应的基本原理即元素化合价升降相等原理(本质是电子得失相等)并能利用氧化还原反应的原理分析简单问题;熟悉“氧化剂”“还原剂”“氧化产物”“还原产物”等基本概念;掌握双线桥法标氧化还原反应的电子转移;能利用电子守恒法配平氧化还原方程式。
2.熟悉常见氧化剂、还原剂及其还原产物、氧化产物
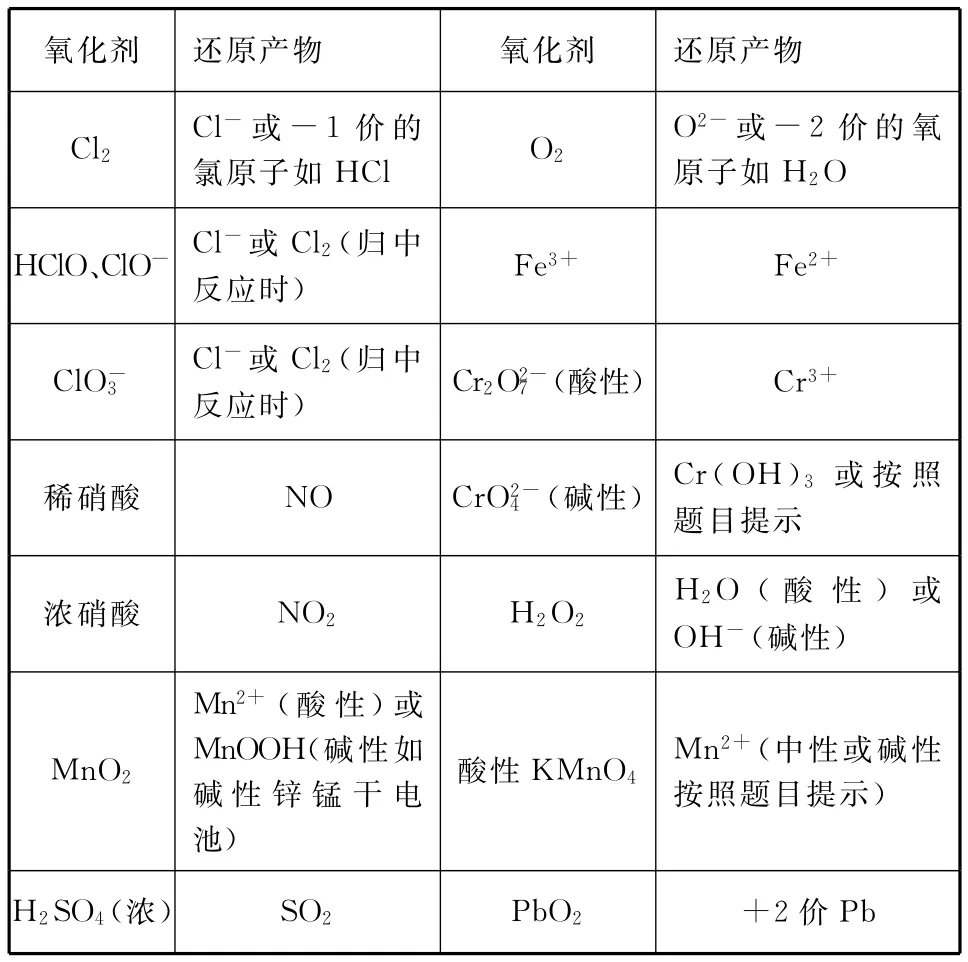
表1 常见氧化剂及其还原产物
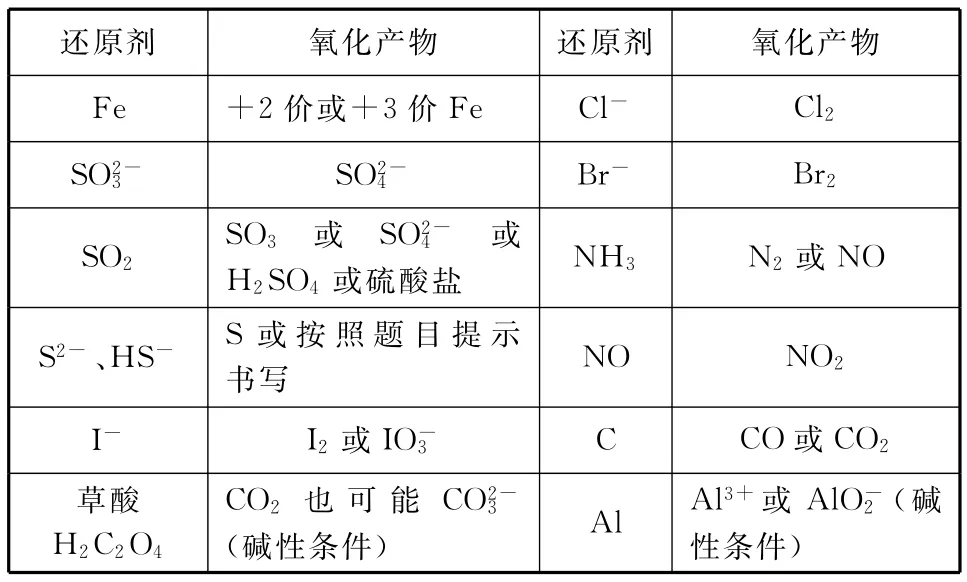
表2 常见还原剂及其氧化产物
二、“四步法”介绍
第一步:先写出氧化剂、还原剂或题目提供的反应物、生成物。
第二步:再根据题意和所学知识,采用分析、综合的方法写出氧化产物、还原产物。
这是关键步骤,要做好这一环节,一方面要求我们有元素化学的知识基础,并熟悉表1和表2;另一方面我们要提取题目中的有用信息,分析其化合价变化的可能情况,结合氧化性、还原性的强弱,回归氧化还原反应的实质,判断反应产物。
要求我们有元素化学知识基础并熟悉表1和表2,能利用氧化还原反应的原理分析问题。
第三步:配平所写出物质。(主要是利用电子守恒原理配平氧化剂、还原剂、氧化产物及还原产物)
第四步:根据质量守恒和综合判断补充必要物质(包括反应物和生成物),再配平、检查。
三、应用
1.典例分析
【例1】书写SO2使酸性高锰酸钾褪色的离子方程式。
【典型错误】该式子无法配平。在教学实践中,这样的错误是最普遍的,很多学生错误地认为酸性高锰酸钾溶液中,H+一定参与反应。如果我们用“四步法”完成,就可以顺利避开这个问题。
【分析】(1)先写出氧化剂、还原剂或题目提供的反应物、生成物。
SO2具有强还原性,MnO4-具有强氧化性。
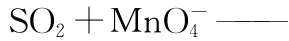
(2)再根据题意和所学知识,写出氧化产物、还原产物。
SO2被氧化的产物可能是SO3或SO2-4或H2SO4或硫酸盐,SO3能与水剧烈反应,氧化产物不可能是SO3,K2SO4、H2SO4、MnSO4皆可以拆,所以氧化产物为SO2-4。而MnO-4在酸性条件下,(题目没有特殊说明时,)其还原产物为Mn2+。
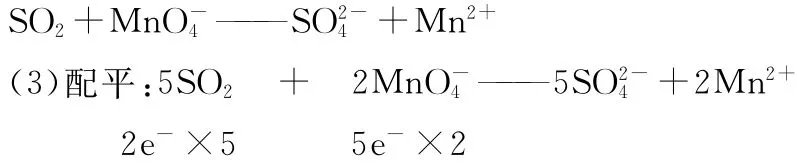
(4)补充:观察以上式子,可发现左边缺少2O,在酸性溶液中,只能从水补充,应加上2H2O,而水失去氧生成4H+。

【例2】书写SO2通入X2(X为Cl、Br、I)的水溶液的化学方程式。
【分析】(1)SO2具有强还原性,X2具有强氧化性。

(2)SO2被氧化的产物可能是SO3或SO2-4或H2SO4或硫酸盐,SO3能与水剧烈反应,氧化产物不可能是SO3,+6价硫以SO2-4存在,溶液中没有金属离子,所以氧化产物为H2SO4。而X2被还原为-1价的卤素原子,溶液中没有金属离子,所以还原产物为HX。

(4)补充:观察以上式子,可发现左边缺少4H和2O,恰好补充2H2O。

【例3】写出H2C2O4(草酸)使酸性高锰酸钾褪色的离子方程式。
【分析】(1)H2C2O4+MnO-4——
(2)H2C2O4中的C为+3价,被氧化为+4价,产物可能是CO2或CO2-3,酸性条件下,氧化产物应为CO2,而MnO-4在酸性条件下,其还原产物为Mn2+。
H2C2O4+MnO-4——CO2+Mn2+
(3)配平:5H2C2O4+2MnO-4——10CO2+2Mn2+
(4)观察以上式子,可发现左边多8O和10H,在酸性溶液中,应补充6H+,生成8H2O。

2.真题演练
1.(2015新课标Ⅰ,36节选)

(2)写出步骤③中主要反应的离子方程式:__________。
【分析】(1)从流程图可知,步骤③的反应生成CuCl,故反应需Cl-参与;步骤②滤液含Cu2+,Cu2+为氧化剂;SO2-3(亚硫酸铵)为还原剂。
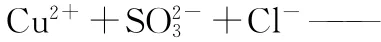

(4)观察以上式子,可发现左边少O,应补充H2O同时生成2H+。
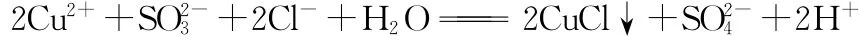
2.(2015山东,29节选)(2)利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下:

(部分流程图)
Co(OH)3溶解还原反应的离子方程式为________。
【分析】(1)从流程图可知,Co(OH)3作氧化剂被还原为
Co2+;(Na2SO3)为还原剂。Co(OH)3+——Co2+
(2)还原产物为Co2+,的氧化产物为。
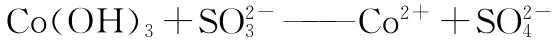
(3)配平:2Co(OH)3+SO2-3——2Co2++SO2-4
(4)观察以上式子,可发现左边多5O和6H,溶液是酸性介质,故应补充4H+同时生成5H2O。

3.(2015四川,8节选)CuSO4溶液能用作P4中毒的解毒剂,反应可生成P的最高价含氧酸和铜,该反应的化学方程式是________。
【分析】(1)CuSO4+P4——
(2)P的最高价含氧酸是H3PO4,P4为还原剂,硫酸根的氧化性极弱,不参与氧化还原(浓硫酸中的+6价S才具有强氧化性,稀硫酸或硫酸盐中的SO2-4氧化性极弱,基本上不参与氧还原反应),Cu2+得电子生成Cu,溶液中已经没有金属离子,故溶液中的阳离子只能是H+,即产物为H2SO4。

(3)配平:10CuSO4+P4——4H3PO4+10Cu+10H2SO4
(4)观察以上式子,可发现左边少16O和32H,应补充16H2O。
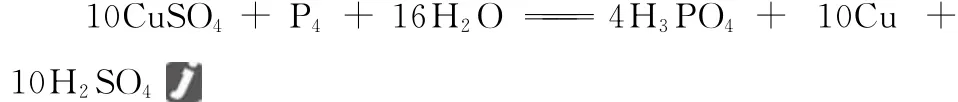
(作者单位:广东省惠来县第一中学)
