HPLC法测定生甘草、炙甘草中6种成分
2016-04-08戴衍朋周洪雷
周 倩, 戴衍朋, 王 亮, 郭 威, 周洪雷
(1.山东中医药大学,山东济南250355;2.山东省中医药研究院,山东济南250014)
HPLC法测定生甘草、炙甘草中6种成分
周 倩1,2, 戴衍朋2, 王 亮2, 郭 威1,2, 周洪雷1*
(1.山东中医药大学,山东济南250355;2.山东省中医药研究院,山东济南250014)
摘要:目的 建立HPLC法测定生甘草、炙甘草中5个黄酮(甘草素葡萄糖芹糖苷、甘草苷、异甘草苷、甘草素、异甘草素)和一个三萜类(甘草酸铵)成分的含有量。方法 甘草甲醇提取液分析采用HyPerc1one ODS C18色谱柱(4.6 mm×250 mm,5 μm);乙腈-0.2%甲酸为流动相,梯度洗脱;柱温25℃。结果 与生甘草相比,炙甘草中甘草素葡萄糖芹糖苷、甘草苷、甘草酸铵、异甘草苷的含有量均有所下降,其中前3个成分降低程度较为明显。结论 甘草蜜炙过程中苷类成分发生了水解,由于其极性较低,导致难以煎出,故甘草素、异甘草素的含有量未明显升高。
关键词:生甘草;炙甘草;黄酮;三萜;HPLC
dol:10.3969/j.issn.1001-1528.2016.02.031
KEY W 0RDS: raw Radix glycyrrhizae;baked Radix glycyrrhizae;f1avonoid;triterPene;HPLC
甘草为豆科植物甘草Glycyrrhiza uralensis Fisch.、胀果甘草Glycyrrhiza inflate Bat.或光果甘草Glycyrrhiza glabra L.的干燥根及根茎[1],根据临床需要,常分别以生甘草和炙甘草两种饮片规格入药[2]。其中,生甘草具有补脾益气、清热解毒、祛痰止咳、缓急止痛和调和药性的功效,而蜜炙后则以补脾和胃、益气复脉为主。中药炮制后药效发生改变的根本原因是炮制引起了中药化学成分的变化,查阅文献发现,对甘草成分分析以及蜜炙前后化学成分的差异虽有不少报道[3-8],但是大多以有机溶剂(不同浓度甲醇、乙醇等)为提取溶媒开展研究,而临床上生甘草、炙甘草饮片均是以水煎液入药,因此并不能很好地反映临床生熟异用的药效特点。本实验针对上述不足,根据临床用药特点,选取甘草主要活性成分[9-12]黄酮和三萜皂苷类成分中的多个成分作为对照,对甘草水煎液中的检出成分进行了含有量测定的方法学研究,同时还对生甘草、炙甘草中成分的含有量进行了测定和比较,分析蜜炙对其的影响。
1 仪器和试药
Agi1ent1200高效液相色谱仪,包括G1315B DAD检测器;R200D电子天平(十万分之一,德国Sartorius公司)。乙腈为色谱纯;水为超纯水;甲醇、甲酸为分析纯。
异甘草苷(批号11052613)、甘草素(批号12022207)、异甘草素(批号11041605)均购自上海经科化学科技有限公司;甘草素葡萄糖芹糖苷(批号FY19790908)购自南通飞宇生物科技有限公司;甘草苷(批号111610-200604)购自中国食品药品检定研究院;甘草酸铵(批号G-003-101105)购自成都瑞芬恩生物科技有限公司。
甘草饮片购自济南市中鲁医院药房(产地内蒙古),经山东省中医药研究院林慧彬研究员鉴定为豆科植物甘草Glycyrrhiza uralensis Fisch.干燥根和根茎加工而成的饮片。
炙甘草饮片为自制,方法为取甘草片适量,按照《中国药典》2010年版中的蜜炙法炒至黄色或深黄色,不黏手时取出,晾凉。100 g甘草饮片可炮制得到110 g炙甘草饮片。
2 试验方法和结果
2.1 色谱条件 HyPerc1one ODS C18色谱柱(4.6 mm×250 mm,5 μm);流动相为乙腈(A)-0.2%甲酸水溶液(B),梯度洗脱(0~10 min,15%~25% A;10~20.3 min,25%~30% A;20.3~50 min,30%~55% A);体积流量为0.5 mL/min(0~10 min)、0.8 mL/min(10.1~50 min);检测波长为276 nm(0~14.5 min)、360 nm(14.5~20.3 min)、248 nm(20.3~50 min);柱温为25℃。
2.2 供试品溶液制备 精密称取甘草饮片粗粉1.2 g,置于圆底烧瓶中,加水回流提取两次,加水量分别为50和30 mL,分别提取1 h和30 min,滤过,合并滤液,加水定容至100 mL,0.45 μm微孔滤膜过滤,即得。
2.3 对照品溶液制备 精密称取各对照品适量,分别加甲醇制成每1 mL含甘草素葡萄糖芹糖苷0.313 6 mg、甘草苷0.176 8 mg、异甘草苷0.161 6 mg、甘草素0.076 mg、异甘草素0.048 mg、甘草酸铵0.172 8 mg的溶液,作为各对照品的贮备溶液。精密吸取1.5 mL,置于10 mL量瓶中,甲醇稀释至刻度,即得。
2.4 方法学考察[13-14]
2.4.1 系统适应性试验考察 精密吸取对照品和供试品溶液各5 μL,依法测定。结果,对照品色谱峰与其他峰均可达到基线分离;供试品色谱峰中可检测到甘草素葡萄糖芹糖苷、甘草苷、异甘草苷、甘草素、异甘草素及甘草酸铵6个色谱峰,而且其保留时间和峰形与对照品一致。对照品和供试品的高效液相色谱图见图1。
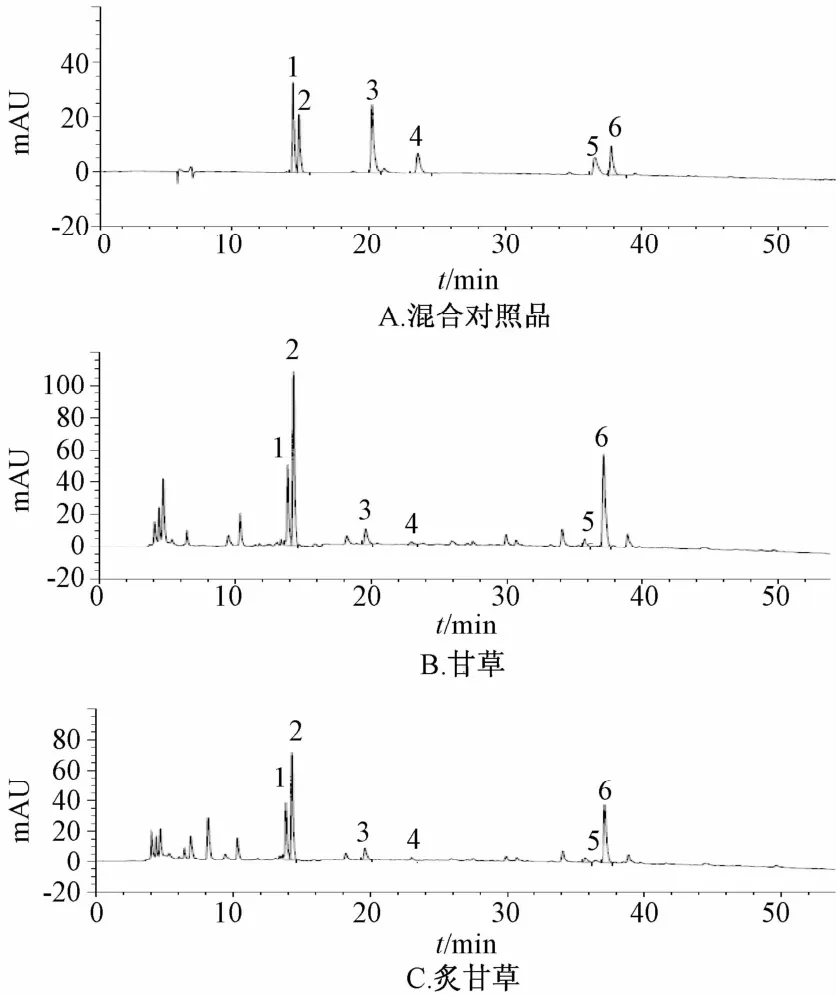
1.甘草素葡萄糖芹糖苷 2.甘草苷 3.异甘草苷 4.甘草素 5.异甘草素 6.甘草酸铵1.1iquiritigenin-7-O-D-aPiosy1-4'-O-D-g1ucoside 2.1iquiritin 3.iso1iquiritin 4.1iquiritigenin 5.iso1iquiritigenin 6.ammonium g1ycyrrhizinate图1 对照品和供试品的HP L C色谱图Flg.1 HPLC chrom atogram s of reference substances and sam ples
2.4.2 线性关系考察 精密吸取混合对照品储备液适量,分别稀释至0.025、0.05、0.1、0.2、0.4、0.6、0.8倍,制成各对照品的的系列标准溶液,在“2.1”项色谱条件下进样5 μL,测定峰面积,以对照品质量浓度(g/L)为横坐标(X)、峰面积积分值为纵坐标(Y)进行线性回归。结果,回归方程分别为甘草素葡萄糖芹糖苷Y= 6 493X+31.46,r=0.999 6,线性范围0.007 8~0.250 9 g/L;甘草苷Y=8 353X+14.82,r= 0.999 5,线性范围0.004 4~0.141 4 g/L;异甘草苷Y=18 255X+2.10,r=0.999 9,线性范围0.004 0~0.129 3 g/L;甘草素Y=8 813X+0.594,r=0.999 9,线性范围0.001 9~0.060 8 g/L;异甘草素Y=13 896X-0.564 6,r=0.999 9,线性范围0.001 2~0.038 6 g/L;甘草酸Y=7 617X+8.63,r=0.999 7,线性范围0.004 3~0.138 2 g/L,表明以上6个成分均具有良好的线性关系。
2.4.3 精密度试验 取混合对照品溶液适量,连续进样6次测定。结果,甘草素葡萄糖芹糖苷、甘草苷、异甘草苷、甘草素、异甘草素及甘草酸铵的峰面积RSD分别为1.1%、1.6%、1.0%、1.2%、1.0%和1.1%,表明仪器精密度良好。
2.4.4 稳定性试验 精密吸取甘草供试品溶液适量,室温下于0、2、4、8、12、24 h测定。结果,甘草素葡萄糖芹糖苷、甘草苷、异甘草苷、甘草素、异甘草素及甘草酸铵的峰面积RSD分别为1.2%、0.8%、2.2%、2.8%、2.0%和1.1%,表明溶液在24 h内稳定性良好。
2.4.5 重复性试验 精密称取同一甘草样品6份,按“2.2”项下方法制备并依法测定。结果,甘草素葡萄糖芹糖苷、甘草苷、异甘草苷、甘草素、异甘草素及甘草酸铵的平均含有量分别为0.533%、0.584%、0.065 0%、0.039 2%、0.020 1%、0.920%,RSD分别为1.3%、0.8%、2.3%、2.5%、1.3%和1.1%,表明该方法重复性良好。
2.4.6 回收率试验 精密称取甘草样品0.6 g,共6份,分别精密加入各组分标准溶液适量(加入量为基础值的100%),按“2.2”项下方法提取测定,计算回收率。结果,甘草素葡萄糖芹糖苷、甘草苷、异甘草苷、甘草素、异甘草素及甘草酸铵的平均回收率分别为97.7%、98.3%、99.0%、100.7%、101.1%和102.3%,RSD分别为2.1%、2.3%、2.3%、3.0%、2.3%和2.1%。同法对炙甘草进行提取测定,结果6个成分的平均回收率分别为100.6%、100.1%、97.2%、97.9%、99.6%和98.6%,RSD分别为1.5%、2.9%、2.1%、2.2%、2.5%和1.3%,见表1和表2。
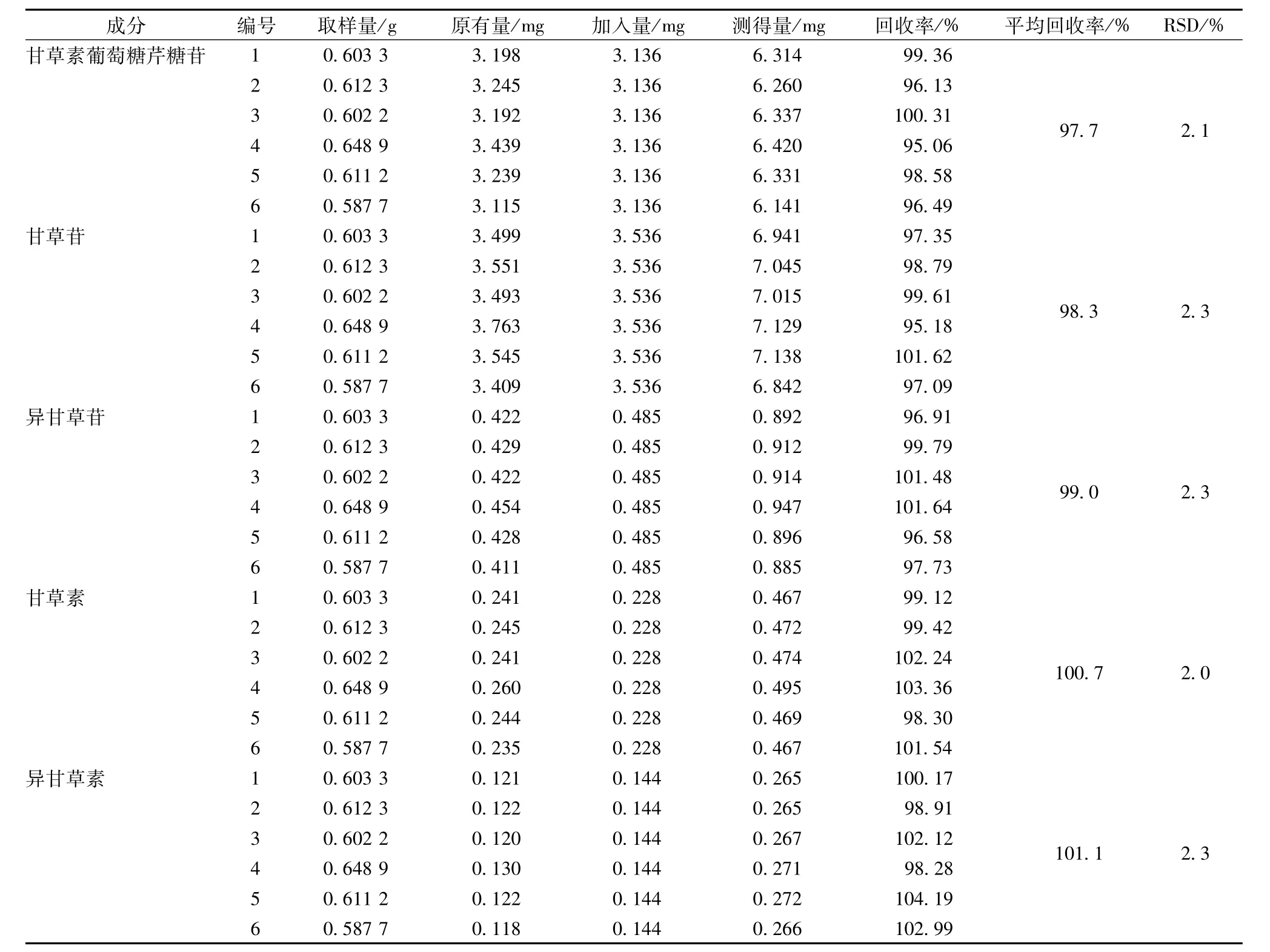
表1 生甘草回收率试验(n=6)Tab.1 Recovery tests for raw Radix glycyrrhizae(n=6)
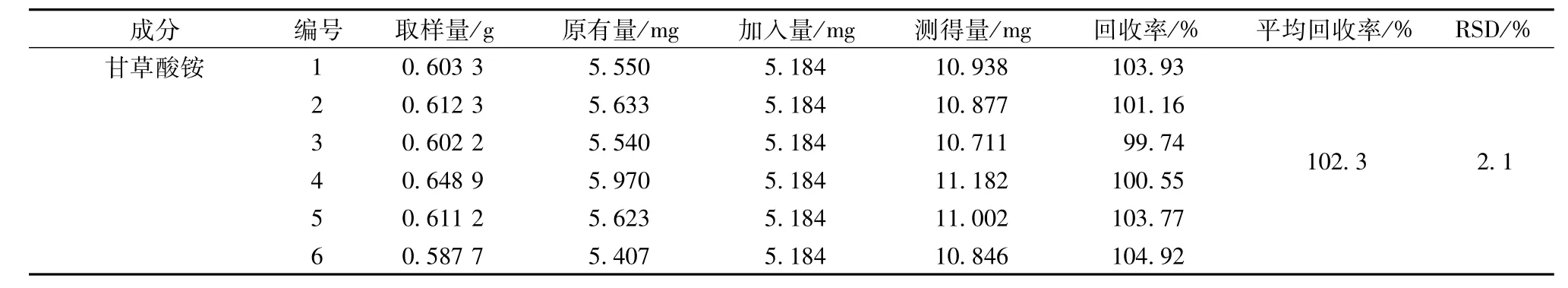
续表1
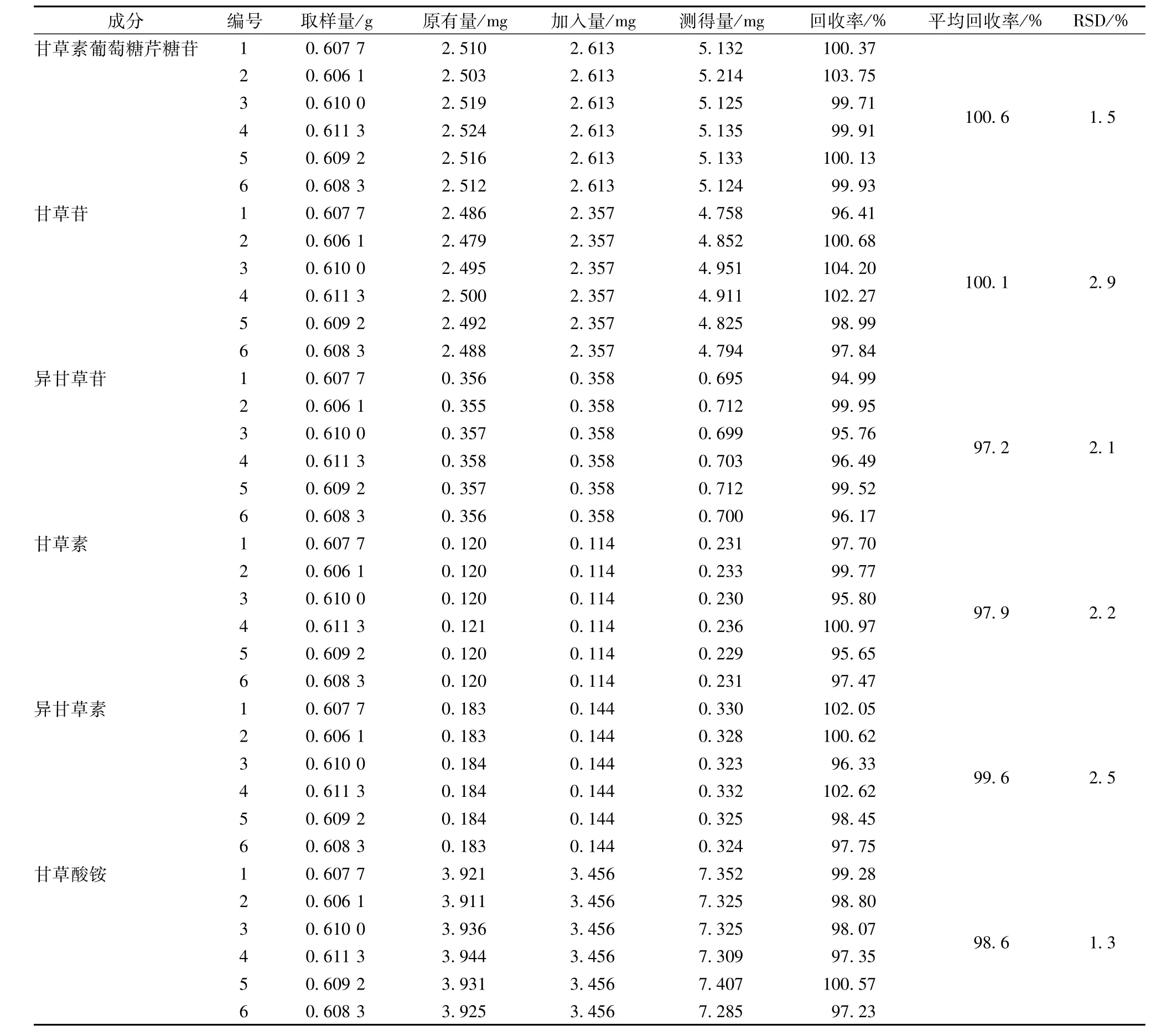
表2 炙甘草回收率试验(n=6)Tab.2 Recovery tests for baked Radix glycyrrhizae(n=6)
2.5 甘草及炙甘草水煎液含有量测定 精密吸取生甘草、炙甘草饮片供试品及对照品溶液,各5 μL,注入液相色谱仪,按上述方法和色谱条件测定,计算含有量,结果见表3。
由表可知,生甘草和炙甘草水煎液中均可检测到上述成分,两者图谱无明显差异,但成分含有量有所不同。
3 讨论
前期对乙腈-0.1%磷酸、乙腈-0.2%甲酸溶液等多个流动相系统进行了比较,发现以乙腈-0.2%甲酸溶液为流动相时,各色谱峰分离度较好,保留时间适中,而且基线稳定,方便后期为HPLC/MS分析优化色谱条件。由于不同柱温对分离效果影响不大,因此选择室温(25℃)。根据待测成分的紫外吸收情况,在不同成分出峰时间点选择适宜波长进行检测。

表3 生甘草、炙甘草测定结果Tab.3 Determ lnatlon results of raw and baked Radix glycyrrhizae
生甘草、炙甘草在临床上以水煎剂入药,因此采用水作为提取溶剂,更能反映出其与药效的密切相关性。通过与对照品色谱图比较,在生甘草和炙甘草水煎液供试品中可检测到甘草素葡萄糖芹糖苷、甘草苷、异甘草苷、甘草素、异甘草素及甘草酸铵6个成分。方法学研究结果表明,在该色谱条件下,HPLC法简便、准确、稳定。其中,黄酮苷类成分甘草素葡萄糖芹糖苷、甘草苷、异甘草苷和以及三萜皂苷甘草酸4个成分的含有量均较高,可作为质量评价指标来控制甘草饮片的质量。
比较生甘草、炙甘草含有量测定结果时发现,甘草素葡萄糖芹糖苷、甘草苷、异甘草苷、甘草酸铵这4个成分的含有量均有一定程度下降,其中甘草素葡萄糖芹糖苷、甘草苷和甘草酸铵降低较为明显,推测可能是在蜜炙过程中苷类成分发生了水解。但因水解产物极性较低,水难以煎出,故甘草素、异甘草素的含有量未明显升高。在今后的研究中,将进一步对其他成分进行定性和定量分析,为解析甘草蜜炙的原理提供科学依据。
参考文献:
[1] 国家药典委员会.中华人民共和国药典: 2010年版一部[S].北京:中国医药科技出版社,2010: 80.
[2] 孙立立,张 泰,周 倩,等.甘草历代炮制方法概述[J].中成药,2010,32(7): 1188-1190.
[3] 周 倩,孙立立.蜜炙对甘草化学成分影响研究[J].中国药学杂志,2013,48(10): 768-772.
[4] 周娅静,常 靖,石海燕,等.甘草中异甘草素和甘草素含量测定方法研究[J].中国药业,2014,23(16): 41-43.
[5] 耿家玲,康绍建,柴文英,等.甘草、炙甘草饮片中甘草苷和甘草酸含量考察[J].中国药师,2011,14(12): 1751-1753.
[6] 魏珊珊,杨 敏,陈 新,等.甘草药材HPLC指纹图谱研究[J].上海中医药大学学报,2014,28(2): 68-71.
[7] 孙 磊,靳 勇,刘晓晴,等.炙甘草药材HPLC指纹图谱研究[J].中国中药杂志,2014,39(11): 2056-2059.
[8] 苏本正,周 倩,孙立立.甘草饮片乙酸乙酯提取部位HPLC指纹图谱研究[J].中成药,2011,33(2): 203-207.
[9] 王 青,苗文娟,向 诚,等.乌拉尔甘草中黄酮类化学成分的研究[J].中草药,2014,45(1): 31-36.
[10] 陶伟伟,段金廒,杨念云,等.乌拉尔甘草皂苷类成分研究[J].中草药,2013,44(12): 1552-1557.
[11] 陈佩东,周 习,丁安伟,等.炙甘草水煎液的HPLC-MS分析[J].中成药,2014,36(10): 2115-2120.
[12] 赵月然,卢 丹.HPLC法同时测定复方甘草片中甘草苷、异甘草苷、甘草素、甘草酸[J].中成药,2014,36(4): 867-869.
[13] 周 倩,戴衍朋,孙立立.石榴皮在炒炭过程中没食子酸和鞣花酸含量变化规律的研究[J].中国中药杂志,2014,39(22): 4349-4351.
[14] 周 倩,孙立立,江 波,等.RP-HPLC法同时测定艾叶及其炮制品中棕矢车菊素和异泽兰黄素的含量[J].中国药房,2013,24(47): 4464-4466.
Determ lnatlon of slx constltuents ln raw and baked Radix glycyrrhizae by HPLC
ZHOU Qian1,2, DAIYan-Peng2, WANG Liang2, GUOWei1,2, ZHOU Hong-1ei1*
(1.Shandong University of Traditional Chinese Medicine,Jinan 250355,China;2.Shandong Provincial Academy of ChineseMedicine,Jinan 250014,China)
ABSTRACT:AIM To estab1ish an HPLCmethod for the determination of five f1avonoids(1iquiritigenin-7-O-D-aPiosy1-4'-O-D-g1ucoside,1iquiritin,iso1iquiritin,1iquiritigenin and iso1iquiritigenin)and one triterPene(ammonium g1ycyrrhizinate)in raw and baked Radix glycyrrhizae.METH0DS The ana1ysis was Performed on a HyPerc1one ODS C18co1umn(250 mm×4.6 mm,5 μm),acetonitri1e-0.2% methanoic acid wasmobi1e Phasewith gradient e1ution,and co1umn temPerature wasmaintained at25℃.RESULTS ComPared with raw Radix glycyrrhizae,the contents of 1iquiritigenin-7-O-D-aPiosy1-4'-O-D-g1ucoside,1iquiritin,iso1iquiritin and ammonium g1ycyrrhizinate in baked Radix glycyrrhizae were decreased,and the former three constituents were reduced more.C0NCLUSI0 N G1ycosides are hydro1yzed in the honey Processing of Radix glycyrrhizae.Because of 1ow Po1arity,they are hard to be extracted,which makes the contents of 1iquiritigenin and iso1iquiritigenin show a 1itt1e increase.
*通信作者:周洪雷(1967—),男,博士,教授,博士生导师,研究方向为中药及天然药物的有效成分和质量控制。E-mai1: zhouhong1eitcm@163.com
作者简介:周 倩(1982—),女,博士生,助理研究员,研究方向为中药及天然药物的有效成分和质量控制。Te1:(0531)82949803,E-mai1: mervei11eqq@163.com
基金项目:山东省自然科学基金课题(ZR2013HQ029)
收稿日期:2015-06-12
中图分类号:R284.1
文献标志码:A
文章编号:1001-1528(2016)02-0378-05
