铁包金在血清、血浆、尿液及粪便中的HPLC指纹图谱
2016-04-08严志孟朱海燕
彭 梅, 严志孟, 杨 娟, 朱海燕*
(1.贵州省中国科学院天然产物化学重点实验室,贵州贵阳550002;2.贵阳医学院,贵州贵阳550004)
铁包金在血清、血浆、尿液及粪便中的HPLC指纹图谱
彭 梅1, 严志孟2, 杨 娟1, 朱海燕1*
(1.贵州省中国科学院天然产物化学重点实验室,贵州贵阳550002;2.贵阳医学院,贵州贵阳550004)
摘要:目的 建立铁包金Berchemia lineata在血清、血浆、尿液及粪便中的HPLC指纹图谱,并进行体内定性分析。方法 大鼠灌胃铁包金水提物后,建立血清、血浆、尿液、粪便中的HPLC指纹图谱,并比较其相似度。结果 与给药前的指纹图谱相比,9个移行成分以原型入血,7个入尿,2个入粪便。结论 铁包金中的大部分成分以原型入血,然后被肾脏代谢,进入尿液。
关键词:铁包金;HPLC指纹图谱;血清;血浆;尿液;粪便
dol:10.3969/j.issn.1001-1528.2016.02.027
KEY W 0RDS: Berchemia PolyPhylla;HPLC fingerPrints;serum,P1asma;urine;stoo1
铁包金Berchemia lineata为鼠李科植物,别名老鼠耳、米拉藤、小叶黄鳝藤,具有祛风利湿、止咳祛痰、活血止痛等作用[1],用于跌打损伤、痈肿疮毒[2]、肿瘤[3]、毒蛇咬伤等[4-5]。由于其作用成分较多,疗效复杂,因此建立准确简单的定性分析方法是其体内研究的基础[6-8]。本实验在前期铁包金体外指纹图谱的基础上,进一步建立其进入血清、血浆、尿液、粪便的指纹图谱,可对铁包金药材的体内代谢进行研究,并为其临床给药提供一定的指导依据。
1 仪器及材料
Agi1ent1100高效液相色谱仪(美国Agi1ent公司);Mi11iPore-0026超纯水机(美国Mi11iPore公司);JA2003精密电子天平(上海恒平科技有限公司);TGL-16B离心机(上海安亭科技有限公司)。乙腈为色谱纯(德国Merck公司);甲醇为色谱纯(美国Tedia公司)。芦丁、槲皮素(中国药品检验所);肝素钠(北京鼎国昌盛生物技术有限责任公司,批号0BC10650)。
铁包金药材采自贵州贵阳,经贵阳中医学院孙庆文副教授鉴定。Wistar大鼠,雌雄各半,由重庆腾鑫实验动物中心提供,合格证号SCXK(渝)2012-0006,体质量180~240 g。
2 方法与结果
2.1 样品的制备
2.1.1 标准品及铁包金体外样品的制备 精密称取槲皮素标准品2.5 mg、芦丁标准品2.0 mg,甲醇溶解,定容至10 mL量瓶中,制成0.25 mg/mL、0.20 mg/mL的对照品溶液。
2.1.2 铁包金供试品溶液的配制 称取铁包金药材5.0 g,加入30倍量蒸馏水,猛火煮沸后文火煎煮45 min,过滤后浓缩滤液,滤渣再按上述方法煎煮2次,合并提取液,浓缩至干,加入甲醇∶乙腈∶水(8∶7∶15)的混合溶剂,定容至25 mL,0.45 μm微孔滤膜滤过,即得。
2.1.3 铁包金样品灌胃液配制及分组 将铁包金药材粉碎称重后,加入30倍量水,按“2.1.2”项下方法煎煮制备成铁包金浸膏,再用CMC-Na配制成含生药125 mg/mL的混悬液,即得灌胃液。然后,将12只Wistar大鼠(雌雄各半)分为血清组和血浆组,置于代谢笼中适应性饲养7 d,采集空白血清、血浆、尿液、粪便后开始给药。每只大鼠给药10 mL/kg,每天2次,连续7 d。
2.1.4 血样供试品的制备[9-10]大鼠适应性饲养7 d后,血清组眼静脉采血0.6 mL,4℃放置过夜,4 500 r/min离心15 min,分离血清,取250 μL,加入2倍量甲醇-乙腈(8∶7)混合溶剂,涡旋振荡30 s后8 000 r/min离心30 min,分离上清液,即得空白血清供试品。然后,连续给药7 d,末次给药前12 h禁食不禁水,给药后眼静脉采血0.6 mL,按空白血清供试品制备方法得含药血清供试品;血浆组眼静脉采血0.6 mL,加入1%肝素抗凝管中,4 500 r/min离心15 min,分离上清液,取250 μL,加入2倍量甲醇-乙腈(8∶7)混合溶剂,涡旋振荡30 s后8 000 r/min离心30 min,分离上清液,即得空白血浆供试品。然后,连续给药7 d,末次给药前12 h禁食不禁水,给药后在设定时间眼静脉采血0.6 mL,按空白血浆供试品制备方法得含药血浆供试品。
2.1.5 空白尿液及粪便的制备[11-12]大鼠适应性饲养7 d后,收集空白尿液,每只1 mL,4 500 r/min离心15 min,取上清液500 μL,加入2倍量甲醇-乙腈(8∶7),涡旋振荡30 s后8 000 r/min离心30 min,分离上清液,即得空白尿液供试品。另外,每只大鼠取粪便0.8 g,加入5倍量甲醇∶乙腈混合溶液,浸泡1 h后超声提取20 min,过滤,滤液4 500 r/min离心10 min,静置10 min后再4 500 r/min离心10 min,分离上清液,即得空白粪便供试品。大鼠连续给药7 d,末次给药前24 h禁食不禁水,给药后在设定时间收集大鼠尿液及粪便,按空白尿液及粪便供试品制备方法得给药尿液及粪便供试品。
2.2 色谱条件 Boston C18色谱柱(250 mm× 4.6 mm,5 μm);流动相甲醇(A)-0.1%磷酸(B)-乙腈(C),梯度洗脱(0~17 min,10%~22% A,90%~78% B;17~35 min,35% A,60% B,5% C;35~45 min,75% B,25% C;45~55 min,35% C,65% B;55~65 min,35% C,65% B;65~75 min,20% A,60% B,20% C;75~80 min,10% A,90% B);检测波长260 nm;柱温37℃;进样量20 μL;体积流量1 mL/min。
2.3 最佳收集时间考察 取Wistar大鼠(雌雄各半),连续给药7 d,于末次给药后0.5、1、2、3.5、5 h眼眶取血,收集尿液、粪便,按“2.1.3”项下方法制备含药血清和血浆供试品,按“2.1.4”项下方法制备含药尿液和粪便供试品,在“2.2”项色谱条件下进行测定,结果见图1~4。

图1 血清HP L C色谱图Flg.1 HPLC chromatogram s of serum

图2 血浆HP L C色谱图Flg.2 HPLC chromatograms of plasma
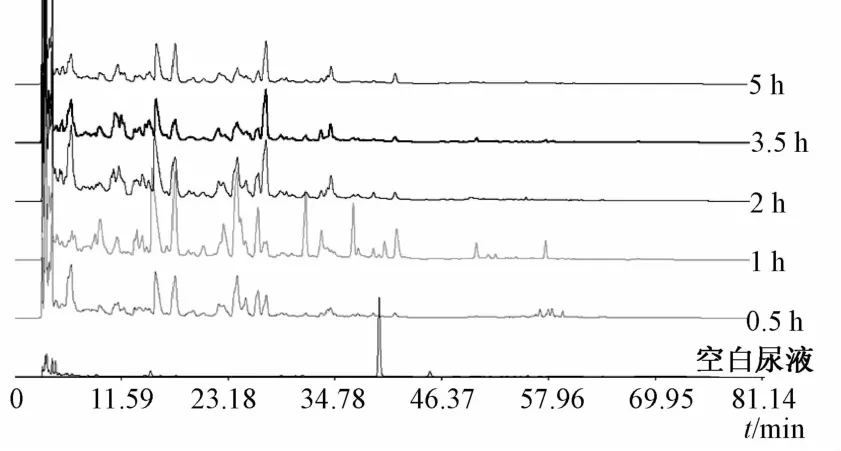
图3 尿液HP L C色谱图Flg.3 HPLC chromatogram s of urlne

图4 粪便HP LC色谱图Flg.4 HPLC chromatograms of stool
由图可知,给药1 h后,血清、血浆及尿液中铁包金样品的移行成分最多,响应值最高,故以给药后1 h为样品采集时间。另外,粪便中由于铁包金样品的移行成分较少,而且内源性成分复杂,代谢随时间的变化不明显,故也以给药后1 h为采集时间。
2.4 精密度、重复性试验 取同一份含药血清、血浆、尿液、粪便样品,在“2.2”项条件下连续进样6次,记录80 min色谱图,然后以血清中11号峰、血浆中13号峰、尿液中11号峰、粪便中9号峰为参比峰,计算各样品中主要共有色谱峰的相对保留时间和相对峰面积。结果显示,血清样品各共有峰的相对保留时间RSD均小于0.06%,相对峰面积RSD均小于3.16%;血浆样品各共有峰的相对保留时间RSD均小于0.04%,相对峰面积RSD均小于2.88%;尿液样品各共有峰的相对保留时间RSD均小于0.1%,相对峰面积RSD均小于4.89%;粪便样品各共有峰的相对保留时间RSD均小于0.97%,相对峰面积RSD均小于4.59%,说明仪器精密度良好。
取给药后1 h每组大鼠的血清、血浆、尿液及粪便6份,在“2.2”项条件下连续进样,记录80 min色谱图,然后以血清中11号峰、血浆中13号峰、尿液中11号峰、粪便中9号峰为参比峰,进行计算。结果,血清样品中主要共有色谱峰的相对保留时间RSD均<0.02%,相对峰面积RSD<2.26%;血浆样品各共有峰的相对保留时间RSD<0.03%,相对峰面积RSD<1.87%;尿液各共有峰的相对保留时间RSD<0.15%,相对峰面积RSD<3.73%;粪便样品各共有峰的相对保留时间RSD<0.77%,相对峰面积RSD<4.45%,说明该方法重复性良好。
2.5 含药血清指纹图谱建立 图5是空白血清、原药材及含药血清的指纹图谱,原药材中含有14个成分,其中11号峰鉴定为芦丁,13号峰鉴定为槲皮素。空白血清中有6个成分,扣除血清中内源性成分,初步判定原药材中有1、2、3、4、7、11、13这6个成分以原型进入血清,其余3个成分可能为原型成分的代谢物。

图5 药材、含药血清、空白血清的H P L C色谱图Flg.5 HPLC chromatograms of sam ples,medlcated serum and blank serum
图6是6个批次的血清指纹图谱,将其导入“中药色谱指纹图谱相似度评价系统(2004年A版)”计算相似度,设置中位数法生成对照图谱,时间窗0.4 min,系统自动匹配,以11号峰为内参比峰。结果,各共有峰的相对保留时间RSD<0.69%,各共有峰的相对峰面积RSD<4.23%,6个批次铁包金含药血清指纹图谱相似度均0.85以上。另外,各共有峰的相对保留时间相差不大,但各共有峰的相对峰面积存在差异,说明铁包金样品在大鼠体内的吸收存在个体差异。
2.6 含药血浆指纹图谱的建立 图7是空白血浆、药材、含药血浆的指纹图谱。由图可知,扣除空白血浆中的5个内源性成分后,血浆中共含有15个成分,通过与原药材中成分的保留时间及相似度比较,初步推断其中9个移行成分以原型入血,其余5个成分可能为原药材的代谢成分。

图6 6批血清样品中铁包金的H P L C色谱图Flg.6 HPLC chrom atogram s of Berchem ia polyphylla ln slx batches of serum samples
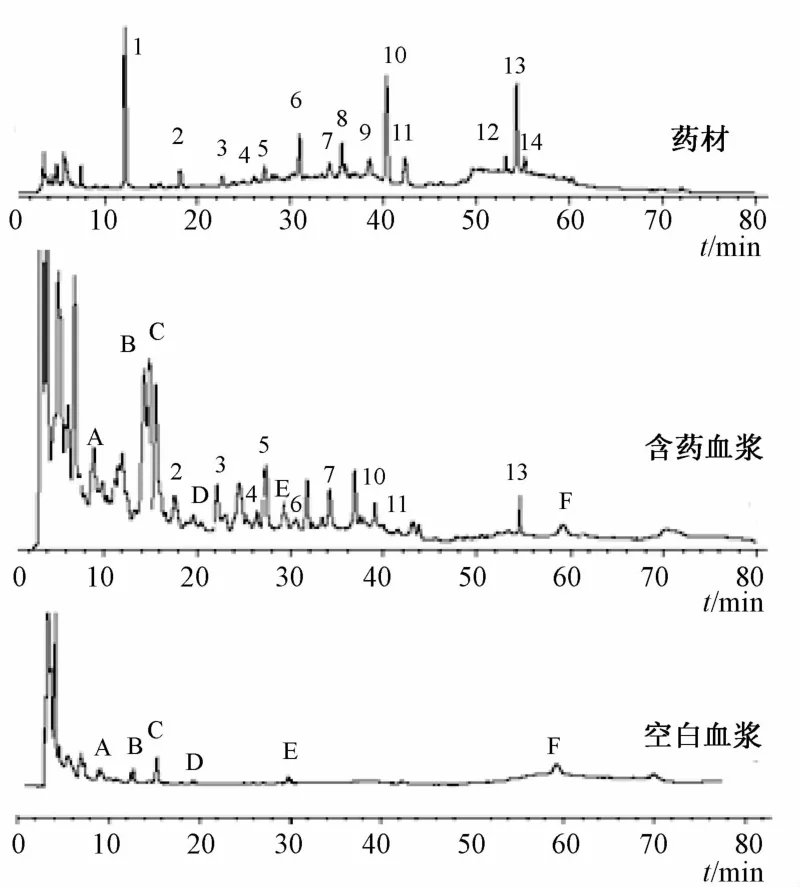
图7 药材、含药血浆、空白血浆的H P L C色谱图Flg.7 HPLC chromatograms of samples,medlcated plasma and blank plasma
图8是6个批次大鼠血浆的指纹图谱,将其导入“中药色谱指纹图谱相似度评价系统(2004 年A版)”计算相似度,以13号峰为参比峰。结果,各共有峰的相对保留时间RSD<0.91%,相对峰面积RSD<3.45%,相似度在0.95以上。
2.7 尿液中指纹图谱的建立 图9是铁包金药材、含药尿液、空白尿液的指纹图谱,其尿液中内源性成分有3个,扣除后共有19个峰。其中,有7个成分与原药的保留时间及相似度初步判定,以原型进入尿液;有11个峰初步判定为其原药材的代谢成分。

图8 6批血浆样品中铁包金的H P L C色谱图Flg.8 HPLC chromatogram s of Berchem ia polyphylla ln slx batches of plasma samples

图9 药材、含药尿液、空白尿液的H P L C色谱图Flg.9 HPLC chromatogram s of sam p les,m ed lcated urlne and blank urlne
图10是6个批次的尿液指纹图谱,将其导入“中药色谱指纹图谱相似度评价统(2004年A版)”计算相似度,以11号峰为参比峰。结果,各共有峰的相对保留时间RSD<0.89%,相对峰面积RSD<4.47%,相似度在0.87以上。另外,各共有峰相对保留时间的差异不大,但相对峰面积有明显的差异,说明铁包金各成分在大鼠体内代谢的时间基本一致,但吸收和被代谢有明显差异。
2.8 粪便中指纹图谱的建立 图11是铁包金样品、含药粪便、空白粪便指纹图谱。由图可知,粪便中的成分比较复杂,扣去内源性成分,共有6个峰,其中9号和12号峰初步判定为原药材中的原型成分,其余4个成分可能为原型成分的代谢产物。

图1 0 6批尿液样品中铁包金的HP LC色谱图Flg.10 HPLC chromatogram s of Berchem ia polyphylla ln slx batches of urlne samp les

图1 1 药材、含药粪便、空白粪便的HP L C色谱图Flg.11 HPLC chromatogram s of sam ples,medlcated stool and blank stool
图12是6个批次的大鼠粪便指纹图谱,将其导入“中药色谱指纹图谱相似度评价系统(2004 年A版)”计算相似度,以9号峰为参照峰,其各共有峰的相对保留时间RSD<0.16%,相对峰面积RSD<5.17%,相似度在0.85以上。

图1 2 6批粪便样品中铁包金的HP LC色谱图Flg.12 HPLC chromatograms of Berchemia polyphylla ln slx batches of stool sam ples
3 讨论
在处理血清、血浆中的蛋白质时,曾采用甲醇或乙腈单独处理,发现其中铁包金样品的移行成分减少,杂质较多,处理效果较差,而甲醇和乙腈混合溶剂的效果较理想。另外,还比较了铁包金样品在血清、血浆、尿液及粪便中吸收及代谢的HPLC指纹图谱,可初步判定其在血浆中被吸收的成分比在血清中多。而且,大部分成分在尿液中被检测到,说明铁包金样品中的大部分成分以原型成分进入血液,并被肾脏代谢,进入尿液。
本实验建立了血清、血浆、尿液及粪便样品中铁包金的HPLC指纹图谱,其各共有峰的相对保留时间RSD<0.90%,相对峰面积RSD<5.0%,6批血清、血浆、尿液及粪便样品指纹图谱的相似度均在0.85以上,说明该图谱相对稳定、准确,可以用于体内成分的定性分析。
参考文献:
[1] 中国科学院《中国植物志》编辑委员会.中国植物志:第48卷第1分册[M].北京:科学出版社,1982: 106.
[2] 梁启成,钟 鸣.中国壮药学[M].南宁:广西民族出版社,2005: 432.
[3] 陈小龙,滕红丽,沈玉霞,等.铁包金总黄酮体内对S180实体瘤的抑制作用[J].中国药理学通报,2011,27(1): 121-124.
[4] 张国利,滕红丽,陈科力,等.壮药铁包金的化学成分及药理作用研究进展[J].中国医药导报,2011,8(6): 5-8.
[5] 滕红丽.壮药铁包金的药学及临床应用进展[J].中国药师,2010,13(6): 876-878.
[6] 沈 岚,林 晓,洪燕龙,等.大川芎方效应组分血浆及脑脊液HPLC特征指纹图谱研究[J].中国中药杂志,2012,37(13): 2017-2021.
[7] 田友清,尚 靖,何 婷,等.基于中药血清化学及血清药理学方法探讨香青兰保护心肌细胞缺氧/复氧损伤物质基础[J].中国中药杂志,2012,37(5): 620-624.
[8] 王学志,李文兰,白 晶,等.穿心莲体内血清指纹图谱建立[J].中药材,2013,25(4): 513-514.
[9] 沈 岚,林 晓,洪燕龙,等.大川芎方效应组分血浆及脑脊液HPLC特征指纹图谱研究[J].中国中药杂志,2012,37(13): 2017-2021.
[10] 牟玲丽,陈 丽,李 峰,等.基于衰老大鼠模型的银杏叶提取物血清指纹图谱研究[J].中草药,2012,43(4): 690-693.
[11] 闫海霞.鼠尾草酸在大鼠体内的药物动力学及代谢研究[D].沈阳:沈阳药科大学,2008.
[12] 陈广通,杨 敏,果德安,等.人参皂苷Re在大鼠体内的代谢研究[J].中国中药杂志,2009,34(12): 1540-1543.
[饮片炮制]
HPLC flngerprlnts of Berchem ia polyphylla ln serum,plasma,urlne and stool
PENG Mei1, YAN Zhi-meng2, YANG Juan1, ZHU Hai-yan1*
(1.The Key Laboratory of Chemistry for Natural Productsof Guizhou Provincial and Chinese Academy of Sciences,Guiyang 550002,China,2.Guiyang Medical College,Guiyang 550004,China)
ABSTRACT:AIM To estab1ish the HPLC fingerPrints of Berchemia PolyPhylla in serum,P1asma,urine and stoo1 for qua1itative ana1ysis in vivo.METH0DS After ratswere intragastrica11y administrated with B.PolyPhylla water extract,the HPLC fingerPrints in serum,P1asma,urine and stoo1were estab1ished,then their simi1arities were comPared.RESULTS ComPared with the fingerPrints before administration,nine PrototyPe constituents were absorbed into b1ood,seven constituents were absorbed into urine,and two constituents were absorbed into stoo1.C0NCLUSI0N Most constituents in B.PolyPhylla exist in b1ood in their origina1 forms,then they are metabo1ized by kidney and enter urine.
*通信作者:朱海燕(1978—),女,助理研究员,从事天然活性成分研究。Te1:(0851)83804370,E-mai1: 1itt1e_ zhy@163.com
作者简介:彭 梅(1985—),女,硕士,助理研究员,从事天然产物分离纯化及活性研究。Te1: 15086020961,E-mai1: Pengmei520@ 163.com
基金项目:贵州高层次人才科研条件特助经费项目(TZJF-2011-55)
收稿日期:2015-04-23
中图分类号:R284.1
文献标志码:A
文章编号:1001-1528(2016)02-0356-05
