地锦草提取物对体外α-葡萄糖苷酶抑制及抗氧化活性研究
2016-04-08杨二磊
郑 巧, 杨二磊, 朱 影, 屠 洁
(江苏科技大学生物技术学院,江苏镇江212018)
地锦草提取物对体外α-葡萄糖苷酶抑制及抗氧化活性研究
郑 巧, 杨二磊, 朱 影, 屠 洁*
(江苏科技大学生物技术学院,江苏镇江212018)
摘要:目的 研究地锦草(EuPhorbia humifusa Wi11d.)提取物对α-葡萄糖苷酶的抑制活性及其体外抗氧化活性。方法从地锦草40%、70%、95%乙醇提取物对α-葡萄糖苷酶的体外抑制活性中选择最适乙醇体积分数,再对该提取物用乙醚、氯仿、水饱和正丁醇和水相进行萃取分离,比较对α-葡萄糖苷酶的抑制活性、自由基清除能力、铁离子还原能力、羟自由基清除能力、超氧阴离子清除能力。结果 地锦草95%乙醇提取物的抑制活性较优,再经乙醚萃取获得萃取物对α-葡萄糖苷酶的抑制活性最强,IC50值为78.8 μg/mL,化学成分分析显示其含有较多的酚性成分。乙醚萃取物具有较好的抗氧化能力,其自由基清除能力EC50值为132.9 μg/mL,铁离子还原能力EC50值为76.9 μg/mL,羟自由基清除能力EC50值为182.7 μg/mL,超氧阴离子清除能力EC50值为31.3 μg/m L。结论 地锦草95%乙醇提取物的乙醚萃取物具有较强的α-葡萄糖苷酶抑制活性,同时具有一定的抗氧化活性。
关键词:地锦草;乙醇提取物;α-葡萄糖苷酶抑制活性;抗氧化活性
dol:10.3969/j.issn.1001-1528.2016.02.005
KEY W 0RDS: EuPhorbia humifusa;ethano1extract;α-g1ucosidase inhibitory activity;antioxidant activity
地锦草(EuPhorbia humifusa Wi11d.)又名血见愁,是大戟科大戟属植物地锦草的全草,为一年生匍匐小草本植物。广泛分布于我国各地,具有清热解毒、凉血止血、抗氧化、抗真菌和抗乙型肝炎病毒等作用[1-5]。董福轮等[6]研究表明,地锦草配合其他中西医治疗能有效控制糖尿病患者空腹血糖,表明地锦草具有潜在的治疗糖尿病的作用。但是,地锦草降糖活性物质基础以及作用机制尚未阐明。
α-葡萄糖苷酶(EC.3.2.1.20,α-g1ucosidase)是一类存在于人体小肠刷状缘上的水解酶,能够催化碳水化合物非还原末端的α-1,4糖苷键的水解,释放葡萄糖,主要包括蔗糖酶、麦芽糖酶、异麦芽糖酶和海藻糖酶等。α-葡萄糖苷酶的酶活性可以影响人体对蔗糖、淀粉、糊精等碳水化合物的吸收利用[7]。有报道指出通过抑制α-葡萄糖苷酶活性来治疗某些疾病已经成为一种有效的临床治疗手段,其中,α-葡萄糖苷酶抑制剂在糖尿病治疗中的运用最为成熟。目前α-葡萄糖苷酶抑制剂已被第三次亚太地区糖尿病治疗药物指南推荐为降低餐后血糖的一线药物[8],如阿卡波糖(acarbose)、伏格列波糖(vog1ibose)、米格列醇(mig1ito1)等。α-葡萄糖苷酶抑制剂通过可逆性抑制或竞争性抑制小肠刷状缘上的α-葡萄糖苷酶活性,从而阻抑酶活性的发挥,阻滞双糖水解为单糖,后延葡萄糖或单糖的吸收时间,减缓餐后高血糖的发生[9]。本研究将以α-葡萄糖苷酶体外抑制活性为追踪指标,测定地锦草乙醇提取物对α-葡糖糖苷酶的抑制活性,进一步采用不同极性溶剂系统分离,并对各分离部位进行初步的化学成分分析,最后测定α-葡萄糖苷酶的抑制活性部位的抗氧化活性。以期为高效、安全的地锦草α-葡萄糖苷酶抑制剂的开发运用提供实验基础。
1 实验材料与仪器
1.1 实验材料 地锦草,取材于江苏科技大学西校区,经植物学讲师褚衍亮鉴定为大戟属植物地锦草。
实验小鼠:昆明小鼠,雄性,清洁级,(25± 2)g,江苏大学实验动物中心,许可证号,SCXK2012-0011。
1.2 实验仪器 UV-9600紫外可见分光光度计(北京瑞利分析仪器公司);RE-52D旋转蒸发仪(上海青浦沪西仪器厂);601超级恒温水浴锅(金坛市国旺实验仪器厂);TGL-16G冷冻离心机(上海安亭科学仪器厂);1,1-二苯基-2-三硝基苯肼(DPPH)(日本和光纯药工业株式会社);葡萄糖测定试剂盒购自南京建成科技有限公司;4-硝基酚为国产化学纯;三羟甲基氨基甲烷(Tris)为国产生化试剂;甲醇为国产色谱纯;磷酸氢二钠、磷酸二氢钠、铁氰酸钾、三氯乙酸、氯化铁、氯化钠、蔗糖、碳酸钠、醋酸、盐酸等均为国产分析纯。
2 实验方法
2.1 地锦草样品的预处理 将新鲜的地锦草全草清洗干净,自然晾晒,挥发水分至样品恒重,放入粉碎机中粉碎至粉末状过80目筛,干燥低温(4℃)保存备用。
2.2 地锦草95%乙醇提取物的制备 取3份地锦草粉末,分别加入100 mL的95%、70%、40%乙醇,搅拌浸提12 h,取上清液,重复3次,合并提取液,50℃减压浓缩干燥,即得地锦草醇提取物。将得到的提取物冷冻干燥,4℃保存备用。
2.3 蔗糖酶的抑制实验
2.3.1 蔗糖酶的提取 蔗糖酶制备方法参照文献[10-11]略加修改而来,取成年小鼠小肠,用生理盐水冲洗干净并剪碎,加入少许石英砂和聚乙烯吡咯烷酮,研磨至匀浆,在0~4℃下8 000 r/min离心15 min。取上清液,即为粗酶液。以蔗糖作为底物测定蔗糖酶的活性。
2.3.2 蔗糖酶的抑制活性测定 蔗糖酶抑制活性的测定参照Kim[12]的方法略加修改而来,反应体系如下: 10 μL 2 mo1/L蔗糖溶液,加入70 μL 0.05 mo1/L PH 6.8的磷酸缓冲液,再加入10 μL提取物,37℃预热5 min后,加入10 μL酶液(约0.1 U,实验条件下1 min内水解麦芽糖产生1 μmo1葡萄糖所需酶量,定义为一个酶活力单位)启动反应。37℃反应30 min,加入100 μL 0.05 mo1/L PH 8.8 Tris-HC1缓冲液终止反应。以提取溶液代替抑制剂作为全酶管;以缓冲液代替酶液作为校正管。酶促反应产生的葡萄糖的测定采用葡萄糖测定试剂盒(葡萄糖氧化酶-过氧化物酶法)。在酶促反应体系中分别加入不同质量浓度的抑制剂,测定其对蔗糖酶活性的影响。按公式1计算抑制率。

2.3.3 IC50值的测定 以横坐标为酶促反应体系中抑制剂的质量浓度,纵坐标为抑制率,绘图,计算并生成公式,其抑制率为50%时的抑制剂浓度,即为IC50值。
2.4 95%乙醇提取物的分部萃取 将所得的95%乙醇提取物,用少量的水混悬,再倒入3倍体积的乙醚混匀,接着倒入分液漏斗中,剧烈振荡30 min,室温下静置至两相完全分离,即得上相乙醚相,下相继续依次用氯仿、水饱和正丁醇萃取,分别得到氯仿相、正丁醇相和萃余相(水相)。将各萃取液减压浓缩至膏状体,4℃保存,待用。
2.5 地锦草萃取物的化学成分分析 化学成分分析按照谢奇[13]的方法略加修改而来。采用三氯化铁法分析酚性成分,PH值法分析脂肪酸成分,醋酸铅法分析黄酮类成分,碘-碘化钾法和泡沫实验分析生物碱成分,氯仿-浓硫酸法分析三萜类成分,苯酚浓硫酸法分析多糖类成分。
2.6 地锦草乙醚萃取物(DEEF)抗氧化性能的测定
2.6.1 DEEF的DPPH自由基清除能力的测定DPPH自由基清除能力的测定参考Liu[14]的方法略加修改而来。以甲醇梯度稀释地锦草提取液,取1.5 mL样品加入2.5 mL DPPH,1.5 mL 0.06 mmo1/L甲醇溶液,混匀,20 min后测定517 nm处吸光度;同法1.5 mL甲醇加入2.5 mL DPPH溶液混匀测定吸光度。每份样品平行操作3次,取平均值,以维生素(Vc)为阳性对照。按照公式2计算清除率。清除能力以IC50来表示,IC50即清除率为50%时所需的提取物质量浓度。其中A0为空白对照;Ai为反应液的吸光度值;Aj为不加DPPH应用液时提取液自身的吸光度值。

2.6.2 DEEF的铁离子还原力的测定 铁离子还原力的测定按照Liu[14]的方法略加修改而来。1.0 mL提取液中,加入2.5 mL 0.2 mo1/L PH 6.6磷酸缓冲液,然后加入2.5 mL 1%六氰合铁酸钾,50℃水浴30 min后加入2.5 mL 10%三氯乙酸,混均后以4 000 r/min离心10 min,取上清液2 mL同2 mL甲醇和0.4 mL 0.1%三氯化铁混均,于700 nm比色测定。同时以Vc作为阳性对照,考察样品的还原力。还原力以IC50来表示,IC50为吸光值为0.5时的提取液质量浓度值。
2.6.3 DEEF的羟自由基清除能力的测定 羟自由基清除能力的测定按照梁鹏[15]的方法略加修改而来,以甲醇溶液梯度稀释地锦草提取液至2 mL,依次加入6 mmo1/L的FeSO42 mL,2.4 mmo1/L的H2O2溶液2 mL,摇匀,静置10 min,再加入6 mmo1/L的水杨酸溶液2 mL摇匀,然后37℃水浴30 min,离心(3 000 r/min,10 min),取上清液于510 nm处测吸光值,以Vc作为阳性对照。按照公式3计算清除率。清除能力以IC50来表示,IC50即清除率为50%时所需的提取物浓度。其中A0为空白对照;Ai为反应液的吸光度值;Aj为不加水杨酸时提取液自身的吸光度值。
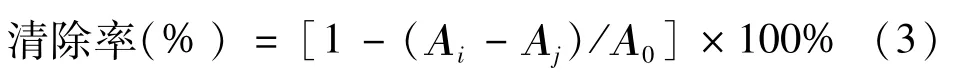
2.6.4 DEEF的超氧阴离子清除能力的测定 超氧阴离子清除能力的测定按照李明静[16]的方法略加修改而来。甲醇溶液梯度稀释地锦草提取液至1.0 mL,加入3 mL Tris-HC1(PH=8.2),25℃水浴20 min后,加入100 μL 10 mmo1/L邻苯三酚,精确反应4 min,滴入100 μL 6 mo1/L HC1终止反应,在325 nm处测定吸光值。每个试验作3个平行样。空白组以蒸馏水代替样品溶液。以抗坏血酸作为阳性对照,考察样品清除·O-2的能力。清除能力以IC50来表示,IC50即清除率为50%时所需的提取物浓度。按照公式4计算清除率。

3 结果与分析
3.1 不同体积分数乙醇溶液对地锦草提取率的影响 10 g地锦草粉末经95%、70%、40%乙醇提取,过滤并旋转蒸发,以及减压浓缩干燥之后,得到3种提取物。提取率如图1所示。实验结果表明: 40%乙醇提取地锦草的提取率为11.001%;70%乙醇提取地锦草的提取率为15.872%;95%乙醇提取地锦草的提取率为10.594%。
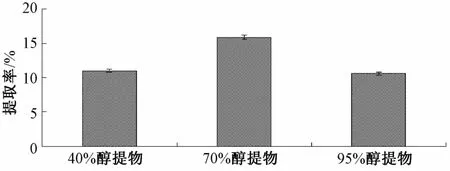
图1 不同体积分数乙醇对地锦草的提取率的影响Flg.1 Effects of dlfferent ethanol concentratlons on the extractlon rate from Euphorbia Humifusa
3.2 地锦草提取物对鼠肠蔗糖酶的抑制活性 将所得到的95%乙醇提取物、70%乙醇提取物、40%乙醇提取物与二甲亚砜混匀配成溶液,使得反应体系的抑制剂最终的质量浓度为1、5、10、50、100 μg/mL。测得其对鼠肠蔗糖酶抑制率,结果如图2所示。
地锦草95%乙醇提取物对蔗糖酶的抑制活性明显好于40%乙醇提取物和75%乙醇提取物。在1~100 μg/mL范围内,地锦草40%与95%乙醇提取物对蔗糖酶的抑制呈现先上升后下降的趋势,在1~10 μg/mL范围内随着抑制剂质量浓度的增加,抑制率增高;在10 μg/mL时,地锦草95%乙醇提取物对蔗糖酶的抑制率达到48%;在10~100 μg/mL之后随着抑制剂质量浓度的增加,抑制率降低。

图2 地锦草提取物对鼠肠蔗糖酶的抑制率Flg.2 Inhlbltory actlvltles of Euphorbia Hum ifusa at d lfferent concentratlons onα-glucosldase
3.3 95%乙醇提取物的萃取分离 由前面实验得到的最好的抑制酶活性的相是95%乙醇相,我们对该相进一步进行物质的萃取分离,选择不同极性的溶剂:乙醚、氯仿、水饱和的正丁醇进行萃取分离,加上最后水相,得到四相。各萃取物的得率结果如图3所示。

图3 地锦草9 5%乙醇提取物各萃取物的萃取率Flg.3 Extractlon of 95% ethanol extract of Euphorbia hum ifusa extracts rate
萃取率分别为乙醚相7.093%,氯仿相0.569%,水饱和正丁醇相14.450%,水相9.821%。
3.4 不同萃取物对蔗糖酶的抑制率 将所得到的乙醚萃取物与二甲亚砜混匀,使得反应体系的抑制剂最终的质量浓度为1、10、25、50、75、 100 μg/mL,测其抑制率,同样将氯仿相、水饱和的正丁醇相和水相分别配成相同质量浓度,得到对鼠肠蔗糖酶抑制率,结果如图4所示。
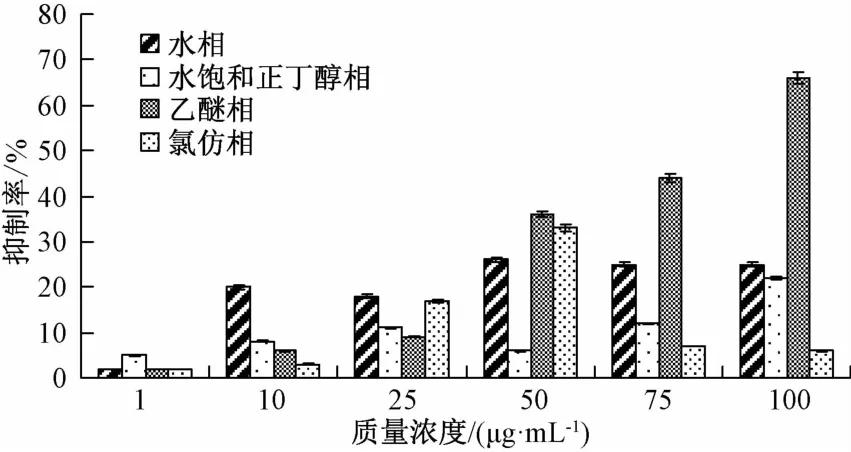
图4 不同萃取物对蔗糖酶的抑制率Flg.4 Inhlbltlon ratlo of dlfferent extracts on α-glucosldase
95%地锦草乙醚萃取物对蔗糖酶的抑制率在1~100 μg/mL范围内随着抑制剂质量浓度的增加而增高;95%地锦草水饱和正丁醇萃取物对蔗糖酶的抑制率在1~100 μg/mL范围内并不明显,在100 μg/mL时抑制率仅达到22%;95%地锦草氯仿萃取物对蔗糖酶抑制率在1~100 μg/mL范围内随质量浓度增大呈现先上升后下降的趋势,在50 μg/mL时抑制率达到33%;95%地锦草水提取物对蔗糖酶的抑制率在1~100 μg/mL范围内变化并不明显。按公式1计算得到的抑制率通过作图计算可得DEEF IC50值为78.8 μg/mL。曹乃峰[17]等用甲醇提取地锦草中降糖活性物质,其石油醚提取物IC50=279.40 μg/mL、正丁醇提取物IC50= 130.70 μg/mL。本实验得到的DEEF的IC50值为78.8 μg/mL,比曹乃峰得到甲醇石油醚提取物和正丁醇提取物低,说明DEEF具有较好的α-葡萄糖苷酶抑制活性。
3.5 不同萃取物的化学成分分析 不同的萃取物经过化学成分分析,结果显示各萃取物中含有酚性成分、脂肪酸成分、三萜类成分等。乙醚相、氯仿相、水饱和正丁醇相及水相的结果如表1所示。
由化学显色分析可知,95%地锦草的醇提物中,经过乙醚、氯仿、水饱和正丁醇萃取后,萃取物的组成成分各不相同。其中DEEF中的三萜类成分少于其他三相,而酚性成分多余其余三相,而其余成分与其他萃取物所含大致相同。根据DEEF为地锦草体外抑制α-葡萄糖苷酶活性最强组分,初步推测DEEF中的酚性成分可能是地锦草降糖活性物质的基础。田瑛[18]等从地锦草70%乙醇提取物中分离得到7个酚性化合物如短叶苏木酚(brevifo1in)、短叶苏木酚酸(brevifo1in carboxy1ic acid)、短叶苏木酚酸甲酯(methy1brevifo1incarboxy1ate)等。
表1 萃取物的化学成分分析Tab.1 Prellm lnary chem lcal composltlon analysls of d lfferent extracts
3.6 95%地锦草醇提物的乙醚萃取物抗氧化活性的测定 按“2.6”项实验方法从4个方面进一步考察了DEEF的体外抗氧化能力。结果如表2所示。

表2 地锦草乙醚萃取物的抗氧化活性Tab.2 Antloxldant actlvltles of DEEF
DEEF的超氧阴离子清除能力EC50值为31.3 μg/mL,Vc的EC50值为31.8 μg/mL,表明DEEF具有较好的超氧阴离子清除能力。李容[19]等研究表明白茅根多糖对羟基自由基有清除作用,EC50为1.1 mg/mL,王卫东[20]等研究表明陈皮提取物质量浓度为600 mg/L时对羟基自由基抑制率为51.23%。DEEF对羟自由基的清除率为EC50= 182.7 μg/mL,可见DEEF对羟自由基的清除能力比白茅根多糖与陈皮提取物好。
4 讨论
糖尿病(diabetes me11itus,DM)是在遗传和环境因素相互作用下,产生胰岛素分泌相对不足、绝对不足、胰岛素抵抗,继而引起体内的糖、蛋白质、脂肪、水、电解质等代谢紊乱,其中以2型糖尿病居多。国际糖尿病联盟(IDF)2013年公布的第六版“IDF糖尿病地图”显示,中国糖尿病人数居于世界首位,为9 840万。糖尿病的治疗和防治给社会经济带来沉重的经济负担。α-葡萄糖苷酶抑制剂是治疗糖尿病的一种有效口服药物[7],其可通过抑制小肠α-葡萄糖苷酶的活性,延缓多糖的降解,减少葡萄糖的吸收,抑制餐后血糖的升高。因此,探寻高效、安全的α-葡萄糖苷酶抑制剂是糖尿病干预或治疗的重要研究内容。
王翼[21]等研究表明植物中的多糖、皂苷、黄酮、生物碱、酚类这5类化学成分在降血糖方面有显著效果,本实验化学成分分析结果表明DEEF中含有较多的酚性成分,且DEEF对α-葡萄糖苷酶活性抑制作用最强。田瑛[18]等从地锦草70%乙醇提取物中分离得到7个酚性化合物,有短叶苏木酚(brevifo1in)、短叶苏木酚酸(brevifo1in carboxy1ic acid)、短叶苏木酚酸甲酯(methy1brevifo1incarboxy1ate)等。由此可见,地锦草中的酚类物质可能为降糖活性物质基础。曹乃峰[17]等首先提出地锦草甲醇提取物具有较好的α-葡萄糖苷酶抑制活性,活性物质为地锦草石油醚提取物、乙酸乙酯提取物、正丁醇提取物。本实验以α-葡萄糖苷酶体外抑制活性为追踪指标,测得地锦草的95%乙醇提取物具有最高的α-葡萄糖苷酶的抑制活性(IC50= 78.8 μg/mL),进一步采用不同极性的溶剂对95%地锦草醇提物进行萃取分离,得到α-葡萄糖苷酶的抑制活性最强的DEEF部位,实验表明DEEF部位同时具有较好的抗氧化活性。
Brown1ee[22]等提出氧化应激是糖尿病并发症的发生的机制之一。氧化应激是体内大量活性分子的产生和抗氧化防御能力不平衡的一种状态,其会导致组织受损。活性氧(ROS)是氧化应激的主要来源之一,主要包括超氧阴离子、羟自由基、过氧化氢等[23]。本实验以DEEF对DPPH自由基、羟自由基、超氧阴离子的清除能力以及铁离子的还原能力研究了DEEF的抗氧化能力,结果表明,DEEF清除超氧阴离子的EC50值为31.3 μg/mL,羟自由基清除能力EC50值为182.7 μg/mL,铁离子还原能力EC50值为76.9 μg/mL,DPPH自由基清除能力EC50值为132.9 μg/mL。李洁[24]等研究表明昆仑雪菊多糖具有α-葡萄糖苷酶抑制活性,质量浓度为0.091 72 mg/mL时,对α-葡萄糖苷酶抑制作用达到50%,DPPH自由基清除能力EC50值为0.939 4 mg/mL,具有一定的抗氧化能力;李荣[19]等研究表明,白茅根多糖对羟基自由基有清除作用,EC50为1.1 mg/mL,但对α-葡萄糖苷酶抑制作用较低。由此可见,DEEF具有良好的α-葡萄糖苷酶抑制能力且同时具有较好的抗氧化活性。因此,本实验在为地锦草的降糖活性机制研究提供实验基础,同时也为地锦草的进一步开发及其在降糖活性保健产品中的利用奠定基础。
参考文献:
[1] 柳润辉,王汉波,孔令文.地锦草化学成分的研究[J].中草药,2001,32(2): 107-108.
[2] 安惠霞,古力娜·达吾提,李治建,等.地锦草有效部位抗真菌作用及其机制研究[J].中国药理学通报,2010,26(9): 1162-1165.
[3] Tian Y,Sun L M,Liu X Q,et al.Anti-HBV active f1avone g1ucosides from EuPhorbia humifusa Wi11d.[J].FitoteraPia,2010,81(7): 799-802.
[4] Shinkai H,Onogi S,Tanaka M,et al.Isoxazo1idie-3,5-diPne and noncyc1ic1,3-dicarbony1comPounds as hyPog1ycemic agents[J].JMed Chem,1998,41(11): 19-27.
[5] Zhou JM,Wang G Y,Wu JH.Synthesis and in vitro characterization of ionone-based cha1cones as nove1 antiandrogens effective againstmu1tiP1e c1inica11y re1evantandrogen recePtormutants[J].Invest New Drugs,2010,28(3): 291-298.
[6] 董福轮,季 蓓,陈英群.鸟不宿、地锦草降低血糖的临床研究[J].四川中医,2002,20(4): 24-25.
[7] Asano N,Nishida M,Kizu H,et al.Fagomine isomers and g1ycosides from Xanthocercis zambesiaca[J].J Nat Prod,1997,60(3): 98-102.
[8] Baron A D.PostPrandia1 hyPerg1ycemia and a1Pha-g1ucosidase inhibitors[J]. Diabetes Res Clin Pract,1998,40(3): 51-55.
[9] 马庆一,陈春涛,时国庆,等.天然α-葡萄糖苷酶抑制剂的研究[J].食品工业科技,2005,26(8): 51-53.
[10] 陈百泉,李吕勤,常 星,等.头花蓼对α-葡萄糖苷酶的抑制活性研究[J].中国实验方剂学杂志,2010,16(8): 151-53.
[11] 李晓媛,胡桂雨,王碧川.白藜芦醇对大鼠α-葡萄糖苷酶活性影响[J].华北煤炭医学院学报,2010,12(1): 151-153.
[12] Kim J S,Kwon C S,Son K H.Inhibition of a1Phα-g1ucosidase and amy1ase by 1uteo1in a f1avonoid[J].Biosci Biotech Bioch,2000,64(11): 2458-2461.
[13] 谢 奇,李治建,斯拉普·艾白,等.地锦草提取物以及有效部位化学成分的初步研究[J].时珍国医国药,2011,2(8): 1814-1816.
[14] Liu S C,Lin JT,Wang CK,etal.Antioxidant ProPerties of various so1vent extracts from 1ychee(Litchi chinenesis Sonn.)f1ower[J].Food Chem,2008,9(88): 1-5.
[15] 梁 鹏,甄润英.辣木茎叶中水溶性多糖的提取及抗氧化活性的研究[J].食品研究与开发,,2013,34(14): 25-28.
[16] 李明静,庆伟霞,杨玉霞,等.七种天然黄酮类化合物对超氧阴离子自由基的清除活性[J].化学研究,2006,17 (4): 73-75.
[17] 曹乃峰.费菜和地锦草生物活性成分研究[D].开封:河南大学,2011: 5.
[18] 田 瑛,孙立敏,刘细桥,等.中药地锦草酚性成分[J].中国中药杂志,2010,35(5): 613-615.
[19] 李 容,梁榕珊,覃 涛,等.白茅根多糖抗氧化活性及抑制α-葡萄糖苷酶活性研究[J].食品研究与开发,2014,35(7): 9-11.
[20] 王卫东,赵志鸿,张小俊,等.陈皮提取物中黄酮类化合物及抗氧化的研究[J].食品工业科技,,2007,28(9): 98-103.
[21] 王 翼,张 旭.α-葡萄糖苷酶抑制剂的研究进展[J].海峡药学,2009,21(9): 4-6.
[22] Brown1ee M.Biochemistry and mo1ecu1ar ce11bio1ogy of diabetic comP1ications[J].Nature,2001,414(6865): 813-820.
[23] Rosen P,Nawroth P P,King G,et al.The ro1e of oxidative stress in the onset and Progression of diabetes and its comP1ications: a summary of a Congress Series sPonsored by UNESCOMCBN,the American Diabetes Association,and the German Diabetes Society[J].Diabetes Metab Res,2001,17(3): 189-212.
[24] 李 洁,曾 红,吕喜凤,等.昆仑雪菊多糖抗氧化及α-淀粉酶和α-葡萄糖苷酶的抑制[J].中国酿造,2014,33 (9): 124-128.
Antloxldant andα-glucosldase lnhlbltory actlvltles of Euphorbia Humifusa extracts
ZHENG Qiao, YANG Er-1ei, ZHU Ying, TU Jie*
(School of Biotechnology,Jiangsu University of Science and Technology,Zhenjiang 212018,China)
ABSTRACT:AIM To study antioxidantand α-g1ucosidase inhibitory activities of EuPhorbia Humifusa extracts in vitro.METH0DS Theα-g1ucosidase inhibitory activities of40%,70%,and 95% ethano1extracts from E.Humifusa were tested,of which the higher inhibitory activity of ethano1 extract was se1ected for further extraction. Tested extraction so1ventswere diethy1ether,ch1oroform,water-satureted n-butano1,and water.Free radica1-,hydroxy1 free radica1-,suPeroxide anion-scavenging caPacity,and iron ion reducing caPacity were examined.RESULTS 95% ethano1extracts from E.Humifusa had the stronestα-g1ucosidase inhibitory activity and the diethy1 ether extract had the strongestα-g1ucosidase inhibitory activity of them,with its IC50va1ue at 78.8 μg/mL.The Pre1iminary chemica1comPositions of diethy1ether extract showed Pheno1ic comPounds;their free radica1scavenging caPacity EC50was132.9 μg/mL;iron ion reducing caPacity was76.9 μg/mL;hydroxy1 free radica1scavenging ca-Pacity was 182.7 μg/mL;suPeroxide anion scavenging caPacity was 31.3 μg/mL.C0NCLUSI0N The diethy1 ether extract of 95% ethano1extracts from E.Humifusa has the antioxidant and re1ative1y the strongestα-g1ucosidase inhibitory activity.
*通信作者:屠 洁(1977—),女,硕士,副教授,研究方向为食品生物技术。Te1: 13921581995,E-mai1: tujie@just.edu.cn
作者简介:郑 巧(1994—),女,研究方向为天然药物活性成分。Te1: 18362894635,E-mai1: 1300205004@qq.com
基金项目:江苏科技大学本科生创新计划(2014年)
收稿日期:2015-07-08
中图分类号:R285.5
文献标志码:A
文章编号:1001-1528(2016)02-0252-06
