制何首乌对大鼠肝CYP1A2酶活性及mRNA表达的抑制作用
2016-04-06杨红莉孙震晓北京中医药大学中药学院北京100102
吴 双 杨红莉 李 浩 孙震晓(北京中医药大学中药学院,北京,100102)
制何首乌对大鼠肝CYP1A2酶活性及mRNA表达的抑制作用
吴 双 杨红莉 李 浩 孙震晓
(北京中医药大学中药学院,北京,100102)
摘要目的:考察制何首乌水提物对大鼠肝细胞色素P450酶亚型CYP1A2的酶活性及mRNA表达的影响。方法:水回流提取得制何首乌水提物,HPLC确定主要成分并测定其含量。大鼠随机分为空白对照组、制何首乌水提物组(2 g/kg和20 g/kg),给药组每天按10 mL/kg量灌胃给予制何首乌水提物,连续7 d。取肝分离肝微粒体,HPLC测定肝微粒体对CYP1A2酶的底物非那西丁的代谢消除率,考察肝微粒体CYP1A2酶活性;实时荧光定量PCR技术检测肝组织中CYP1A2基因mRNA的表达。结果:与空白对照组相比,制何首乌水提物20 g/kg组大鼠肝CYP1A2酶活性和mRNA的表达均明显降低(CYP1A2酶活性,P<0. 01;CYP1A2的mRNA表达,P<0. 05)。结论:制何首乌水提物20 g/kg对大鼠肝CYP1A2酶活性和mRNA的表达有明显抑制作用。
关键词制何首乌水提物;CYP1A2;大鼠肝微粒体;酶活性;mRNA表达
Prohibitive Effect of Processed Polygonum Multiflorum on CYP1A2 Activities and mRNA Expressions of Rats
Wu Shuang,Yang Hongli,Li Hao,Sun Zhenxiao
(College of Chinese Medicine,Beijing University of Chinese Medicine,Beijing 100102,China)
Abstract Objective:To observe the effects of water extraction of processed Polygonum multiflorum on enzymatic activities and mRNA expressions of CYP1A2 in rats. Methods:The water extraction of processed Polygonum multiflorum was obtained through extraction with water and vacuum drying and the main components were detected by HPLC. Rats were randomly divided into the blank control group and 2 g/kg BW and 20 g/kg BW the water extraction of processed Polygonum multiflorum group. The administration group was continuously given with water extraction of processed Polygonum multiflorum 10 mL/kg a day,and the blank control group was given the same volume distilled water. After successive administration of 7 d,the liver microsomes were prepared from isolated rat liver,and metabolism elimination rates of phenacetin of CYP1A2 enzyme substrate were assayed by HPLC to determine CYP1A2 enzyme activities in rat liver microsomes of each group. Meanwhile,total RNA of rat liver were extracted to determine the mRNA expressions of CYP1A2 in rat liver by qRT-PCR. Results:Compared with those in blank control group,the enzymatic activities and the mRNA expressions of CYP1A2 in 20 g/kg water extraction of processed Polygonum multiflorum treated group were significantly decreased(enzymatic activities of CYP1A2,P<0. 01;mRNA expressions of CYP1A2,P<0. 05). Conclusion:20 g/kg water extraction of processed Polygonum multiflorum has significant inhibitory effect on the enzymatic activities and the mRNA expressions of CYP1A2 in rat's liver microsomes.
Key Words Water extraction of processed Polygonum multiflorum;CYP1A2;Rat liver microsome;Enzymatic activities;mRNA expressions
细胞色素P450酶(Cytochrome P450,CYP450)是生物界普遍存在的血红素单加氧酶超家族,参与许多结构各异的外源化合物(药物、毒物等)以及内源性物质(甾体、脂肪酸等)的氧化代谢[1]。CYP450通常表现底物特异性和抑制剂敏感性,其活性容易在药物的作用下受到抑制或激活[2]。已有研究表明,CYP450抑制是有害的药物间相互作用(Drugdrug Interactions,DDIs)产生的主要原因,占代谢性DDIs的70%[3]。
在人P450s超家族中CYP1~3是参与药物代谢的主要家族,参与70%~80%的临床药物的生物转化,P450s的表达有种属特异性[4]。CYP1A2主要在肝中表达,约占肝CYP450总量的13%,参与约8%的药物I相代谢反应,在许多临床药物的代谢中起着重要作用[5]。由于人和大鼠的CYP1A2具有较高的同源性:基因同源性高达80%[6],同源氨基酸达70%[7],故动物的实验结果可以外推到人,药物对其活性及表达的研究有助于了解药物的相互作用或对药物可能的毒性等做出预测。
中药何首乌为蓼科植物何首乌Polygonum multiflorum Thunb.的干燥块根,制何首乌则为其炮制加工后的产品,功在补肝肾,益精血,乌须发,强筋骨,化浊降脂[8]。临床上制何首乌常与其他药物配伍使用。本研究以制何首乌水提物为研究对象,考察其对大鼠肝CYP1A2的酶活性和mRNA表达的影响,有助于预测制何首乌与临床其他药物之间可能存在的DDIs,从而指导其临床合理用药,避免不良反应的产生,降低潜在的风险。
1 材料与方法
1. 1 药物 非那西丁(CYP1A2底物)、NADP+、D-葡萄糖-6-磷酸二钠、葡萄糖-6-磷酸脱氢酶均购自北京拜耳迪生物技术有限公司;2,3,5,4'-二苯乙烯-2-O-β-D-葡萄糖苷(批号:140317)、大黄素(批号:140422)、大黄素-8-O-β-D-葡萄糖苷(批号140822)、大黄素甲醚(批号:140211)标准品均购自四川维克奇生物技术有限公司;内标五味子醇甲(批号:110857201010)购自中国食品药品检定研究院;
1. 2 试剂及仪器 考马斯亮蓝G-250购自Sigma公司;无核酶水购自QIAGEN公司;总RNA提取试剂盒购自Invitrogen公司;SYBR®Select Master Mix购自ABI公司;PrimeScriptTM第一链反转录试剂盒购自宝生物工程有限公司;乙腈和甲醇为色谱纯,其余试剂均为分析纯。实验所用制何首乌(批号:701001039)购自北京同仁堂饮片有限责任公司,由北京中医药大学中药学院张贵君教授鉴定为正品。Waters高效液相色谱仪(1525型二元高压梯度泵系统,2487型二级管阵列检测器,1500型柱温控制系统),Waters SymmetryShieldTMC18柱(4. 6 mm×150 mm,5. 0 μm);Agilent1100高效液相色谱仪,迪马(钻石)C18柱(4. 6 mm×250 mm,5. 0 μm);F8型超细匀浆机(德国FLUKO公司);CU-420电热恒温水浴箱(上海一恒科学仪器公司);荧光定量PCR仪(美国ABI公司);超低温冰箱(美国REVCO公司);低温高速台式离心机(美国Kendro公司)。
2 方法
2. 1 制何首乌水提物制备及其主要成分含测 准确称取400 g制何首乌,稍粉碎后回流提取。第1次加10倍量蒸馏水,回流提取2 h,纱布过滤留滤液;第2次加8倍量蒸馏水,回流提取1. 5 h,过滤留滤液。合并两次所得水提液,旋转蒸发至少量,转移后水浴蒸干,减压干燥得制何首乌水提物(Water Extract of Processed Polygonum multiflorum,PWE)粉末。分别取制何首乌水提物与2,3,5,4'-二苯乙烯-2-O-β-D-葡萄糖苷(THSG)、大黄素-8-O-β-D-葡萄糖苷(PMEG)、大黄素、大黄素甲醚标准品适量,精密称定,甲醇溶解,0. 45 μm微孔滤器过滤制成储备液。参考文献[9-10],HPLC方法学考察后测定制何首乌水提物图谱(图1),与标准品比对知1、2、3、4分别为THSG、PMEG、大黄素与大黄素甲醚。根据测得制何首乌水提物高效液相图谱峰高选择THSG、PEMG、大黄素进行含量测定,建立标准曲线(峰面积Y,质量x)用外标一点法测其主要成分的含量。结果如表1所示,在相应范围内,峰面积Y与质量x线性良好。

表1 各主要成分标准曲线及含量测定
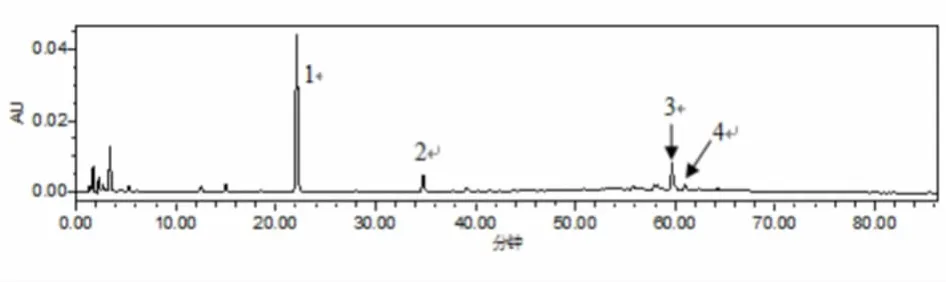
图1 制何首乌水提物HPLC色谱图
2. 2 动物及分组 雄性SD大鼠,体质量(200± 10)g(动物合格证号:SCXK 2011-0012),购自维通利华。随机分为3组,每组5只。空白对照组、PWE 2和20 g/kg(相当人临床用药量的10和100倍)。灌胃给予,空白组给予生理盐水。给药1次/d,连续给药7 d。
2. 3 HPLC检测大鼠肝微粒体CYP1A2酶活性
2. 3. 1 大鼠肝微粒体的制备 参考文献[11],制何首乌灌胃实验结束后大鼠禁食12 h,麻醉处死,将肝脏用冰生理盐水冲洗干净后取出剪碎,加入3倍量匀浆液匀浆(冰上操作)。将匀浆6 500 r/min离心15 min(4℃),取上清液再次离心。所得上清在4℃,以1 200 r/min离心60 min,弃上清液得到粉红色沉淀,重悬缓冲液重悬即制得大鼠肝微粒体(可分装后于-80℃冻存)。取少量Bradford法测定蛋白含量。2. 3. 2 HPLC方法学验证 参考文献[12],HPLC条件为:流动相:A:磷酸氢二铵缓冲盐(pH 3. 6),B:乙腈;梯度洗脱:B液含量32%保持4 min,由32%线性增长至55%(4~25 min),再由55%降至32%(25 ~35 min);检测波长:230 nm;流速:1 mL/min;柱温:40℃。精密量取不同浓度非那西丁溶液于EP管中,氮吹,加(NH4)2HPO4复溶,离心取上清进行HPLC分析。各浓度设立3组平行,建立工作曲线,并计算非那西丁和内标物的峰面积比(Y)对非那西丁的浓度(X)的回归方程。选择低、中、高3个浓度的非那西丁,与空白对照组大鼠肝微粒体制成质量控制样品。每个浓度取3份样品,按前述方法连续测定5 d,考察其精密度和准确度。根据峰面积比与底物浓度,求得方程为Y=0. 122 3X-0. 007 9(r=0. 999 9),表明非那西丁在0. 687 5~22. 00 μg/mL浓度范围内线性良好。测得3种浓度下回收率为96. 57%~100. 6%,RSD为0. 79%~3. 14%,精密度为1. 53%~5. 68%,大鼠肝微粒体内源性杂质对样品的测定没有影响,稳定性和日内精密度符合实验要求(RSD≤10%),HPLC方法可行,高效。
2. 3. 3 CYP1A2酶活性的测定[13]孵育体系(反应总体积200 μL):非那西丁(25 μmol/L),大鼠肝微粒体蛋白(2 g/L),磷酸缓冲溶液(0. 1 mol/L,PH 7. 4)。37℃水浴中振荡3 min,加入NADPH发生体系:NADP+(2 mmol/L),D-葡萄糖葡萄糖-6-磷酸二钠(40 mmol/L)、葡萄糖-6-磷酸脱氢酶(4 UI/L)、MgCl2(40 mmol/L),37℃反应30 min。取出,立即加入冰乙腈终止反应,加入10 μL内标五味子醇甲(0. 06 g/L),1 200 r/min离心20 min(4℃)。吸取上清液,氮吹,加200 μL(NH4)2HPO4复溶,9 400 r/min离心15 min,取上清液进行HPLC分析(进样量30 μL)。按下列公式计算底物代谢清除百分率:

2. 4 实时荧光定量PCR考察大鼠肝CYP1A2 mRNA表达
2. 4. 1 肝组织总RNA的提取 用Trizol试剂盒提取各组大鼠肝组织总RNA,操作严格按照说明书进行。
2. 4. 2 RNA的质量检测 分别吸取5 μL各组大鼠肝总RNA样品与1 μL 6×上样缓冲液(Loading Buffer)充分混匀,在制备的1%琼脂糖凝胶上点样,使RNA由负极向正极电泳(180 V,10 min)。结束后,在紫外透射检测仪上观察电泳结果并拍照。取4 μL RNA与196 μL无核酶水混匀,加入微量比色杯中,紫外分光光度计测RNA吸收值。如图2,提取的总RNA中28 s亮度为18 s两倍,说明完整性好;A260/A280值在1. 8~2. 0之间,A260/A230值大于2. 0,说明所得总RNA纯度较高,酶抑制物残留少,符合后续实验要求。

图2 各组大鼠肝脏总RNA琼脂糖凝胶电泳
2. 4. 3 引物特异性验证 Rat-CYP1A2与β-肌动蛋白(内参)引物由上海生物工程技术服务有限公司设计合成,引物序列见表2。内参β-肌动蛋白与目的基因的溶解曲线由MiniOptinTMReal-Time PCR System软件自带的溶解曲线程序测得,其中横坐标表示温度,纵坐标则表示对应的荧光强度,波峰的个数代表扩增产物的特异性。图3为CYP1A2基因的cDNA的实时荧光定量PCR测定的溶解曲线,可知在80~90℃呈现单一特异性峰,说明引物特异性好,即实时荧光定量PCR中所测荧光均为扩增目的基因cDNA得到的DNA双链发出。

表2 PCR引物序列

图3 大鼠CYP1A2(目的基因)和β-actin(内参基因)实时荧光定量PCR的溶解曲线
2. 4. 4 CYP1A2 mRNA表达量测定 以1. 5. 1记述方法提取的大鼠肝组织总RNA为模板,逆转录合成第1条互补脱氧核糖核酸链(cDNA)。然后通过特异性引物PCR扩增CYP1A2基因和内参管家基因β-actin,PCR反应体系包含:2 μL cDNA,10 μL Power SYBR®Green PCR Master Mix和上、下游引物各0. 54 μL。无核酶水补足至总体积20 μL。反应程序均设定为:预变性95℃,10 min;变性95℃,15 s;退火延伸60℃,1 min。循环40次。用PCR仪自带软件进行荧光定量分析,得出Ct值,结果用2-ΔΔCt法计算mRNA的表达量。
3 结果
3. 1 制何首乌水提物对大鼠肝微粒体CYP1A2酶活性的影响 如表3所示,对比空白对照组与各给药组的大鼠肝微粒体对底物非那西丁代谢消除百分率,可知人临床用药100倍剂量(20 g/kg)的制何首乌水提物能显著抑制大鼠肝CYP1A2酶的活性(P<0. 01)。
表3 制何首乌水提取物对大鼠肝微粒体CYP1A2 mRNA表达的影响(±s,n=5)

表3 制何首乌水提取物对大鼠肝微粒体CYP1A2 mRNA表达的影响(±s,n=5)
注:与空白对照组相比,*P<0. 05,**P<0. 01。
组别 代谢清除率/%空白对照19. 8±2. 0 PWE(2 g/kg) 17. 0±2. 8 PWE(20 g/kg) 13. 2±1. 6**
3. 2 制何首乌水提物对大鼠肝微粒体CYP1A2 mRNA表达的影响 如表4所示,对比给药组与空白对照组的大鼠肝CYP1A2 mRNA,制何首乌水提物20 g/kg组大鼠肝CYP1A2 mRNA的表达受到明显抑制(P<0. 05)。
表4 制何首乌水提取物对大鼠肝微粒体CYP1A2 mRNA表达的影响(±s,n=5)

表4 制何首乌水提取物对大鼠肝微粒体CYP1A2 mRNA表达的影响(±s,n=5)
组别 CYP1A2 mRNA相对表达量(2-ΔΔCt)空白对照1. 00±0. 01 PWE(2 g/kg) 0. 78±0. 04 PWE(20 g/kg) 0. 70±0. 02*
4 讨论
本研究发现,20 g/kg制何首乌水提物(约临床用药100倍剂量)能显著抑制大鼠肝微粒体CYP1A2酶活性及CYP1A2 mRNA的表达,提示PWE可以在基因转录水平上下调CYP1A2的表达,从而影响其酶活性,这与课题组前期何首乌水提物10 g/kg(相当于人临床用药量的100倍)灌胃大鼠可以抑制大鼠肝CYP1A2酶活性及CYP1A2 mRNA的表达的研究结果一致[14]。
CYP1A2不仅是人肝P450s主要成员之一,该酶在人群中表达也具有遗传多态性,可产生2种药物代谢差异表型:慢代谢型、快代谢型。CYP1A2除了参与代谢包括非那西丁、咖啡因、华法林等药物之外,还涉及代谢活化前致癌物和毒素的过程[15]。这些药物中有些治疗窗较窄(如华法林2. 0~3. 0 ng/mL),极易达到中毒剂量。Nishimura[16]等研究表明,P450s抑制是临床治疗药物的DDIs主要的成因之一,药物对CYP450s抑制使其血药浓度升高,如果药物治疗窗较窄,可能致使协同药物产生毒性。因此,当CYP1A2抑制剂与经其代谢的药物联用时,CYP1A2被抑制,尤其是慢代谢者,对被代谢药物的代谢减慢,清除率降低,将会使得药物在体内蓄积,从而产生DDIs,引发一系列严重的不良反应或毒副作用。
制何首乌因其乌发补益之功效,在临床上得到广泛使用。近年来,有文献报道制何首乌可导致不良反应,特别是存在肝毒性,造成肝损伤[17]。对于制何首乌的肝毒性研究也在不断深入[18-19],但对于其产生毒性的机制还有待进一步明确。探究制首乌导致肝毒性的机制,有助于防范制何首乌引起的不良反应。制何首乌抑制CYP1A2酶活性与mRNA的表达,因此临床上需注意制何首乌与药物联用时可能产生的不良后果。研究制首乌与肝脏药物代谢酶CYP1A2的相互作用,不仅为临床安全用药提供依据,也为揭示制何首乌相关肝毒性提供思路。最近临床研究表明,何首乌相关的肝损伤患者的CYP1A2的遗传多态性表现与正常对照组人群的不同,表现CYP1A2*1C比例显著升高,意味着何首乌引起肝损伤患者的CYP1A2酶活性降低[20]。由此推测,制何首乌相关的肝毒性可能与人群中CYP1A2遗传多态性及制何首乌双重作用下的CYP1A2酶活性急剧下降,造成制何首乌中某些肝毒性成分在肝脏中积聚有关,相关结论需要进一步临床及实验数据支持。另外,制何首乌中何种成分可以抑制CYP1A2酶活性,以及制何首乌导致肝毒性的分子作用机制,都还有待进一步的研究。
参考文献
[1]Huang Q,Deshmukh RS,Ericksen SS,et al. Preferred binding orientations of phenacetin in CYP1A1 and CYP1A2 are associated with isoform-selective metabolism[J]. Drug Metab Dispos,2012,40(12):2324-2331.
[2]于敏,张双庆,闻镍.细胞色素P450酶系体外药物代谢研究方法进展[J].中国药事,2013,27(1):81-87.
[3]Kamel A,Harriman S. Inhibition of cytochrome P450 enzymes and biochemical aspects of mechanism-based inactivation(MBI)[J]. Drug Discov Today Technol,2013,10(1):177-189.
[4]Zanger UM,Schwab M. Cytochrome P450 enzymes in drug metabolism:regulation of gene expression,enzyme activities,and impact of genetic variation[J]. Pharmacol Ther,2013,138(1):103-141.
[5]Faber MS,Jetter A,Fuhr U. Assessment of CYP1A2 activity in clinical practice:why,how,and when?[J]. Basic Clin Pharmacol Toxicol,2005,97(3):125-134.
[6]Martignoni ML,Groothuis GM,Kanter R. Species differences between mouse,rat,dog,monkey and human CYP-mediated drug metabolism,inhibition and induction[J]. Expert Opin Drug Metab Toxicol,2006,2(6):875-894.
[7]张晓璐,乐江.细胞色素P450的工具药选择及种属差异的研究进展[J].中国药理学与毒理学杂志,2012,26(5):697-701.
[8]国家药典委员会.中华人民共和国药典[S].一部.北京:中国医药科技出版社,2015:177.
[9]罗文,刘斌,王伟,等.何首乌药材HPLC指纹图谱研究[J].北京中医药大学学报,2008,30(8):557-560.
[10]Liang ZT,Chen HB,Yu ZL,et al. Comparison of raw and processed Radix Polygoni Multiflori(Heshouwu)by high performance liquid chromatography and mass spectrometry[J]. Chin Med,2010,5 (29):1-9.
[11]杨芳.人和鼠肝微粒体药物代谢检测平台的建立及初步应用研究[D].西安:西北大学,2008.
[12]张艳辉,于超,郭延垒,等.高效液相色谱法测定鼠肝微粒体中CYP1A2酶的活性及动力学考察[J].药物分析杂志,2012,32 (2):189-193.
[13]韦灵玉,张玉杰,魏宝红,等.黄连黄芩及配伍诱导对大鼠肝微粒体5种CYP450亚酶活性的影响[J].中国中药杂志,2013,38 (9):1426-1429.
[14]李浩,杨红莉,李登科,等.何首乌水提物对大鼠肝脏CYP1A2,CYP2E1酶活性及mRNA表达抑制作用研究[J].中国中药杂志,2015,40(7):1370-1375.
[15]Zhou SF,Wang B,Yang LP,et al. Structure,function,regulation and polymorphism and the clinical significance of human cytochrome P450 1A2[J]. Drug Metab Rev,2010,42(2):268-354.
[16]Nishimura Y,Kurata N,Sakurai E,et al. Inhibitory effect of antituberculosis drugs on human cytochrome P450-mediated activities[J]. J Pharmacol Sci,2004,96(3):293-300.
[17]孙震晓,张力.何首乌及其制剂相关肝损害国内文献回顾与分析[J].药物不良反应杂志,2010,12(1):26-30.
[18]张思玉,朱晓光,张广平,等.制首乌提取液毒理学研究[J].毒理学杂志,2013,27(4):261-264.
[19]李晓菲,李娜,涂灿,等.基于内毒素特异质模型的生首乌与制首乌肝毒性比较研究[J].中草药,2015,46(10):1481-1486.
[20]Ma KF,Zhang XG,Jia HY. CYP1A2 polymorphism in Chinese patients with acute liver injury induced by Polygonum multiflorum[J]. Genet Mol Res,2014,13(3):5637-5643.
(2015 -06 -19收稿 责任编辑:张文婷)
中图分类号:R285. 5
文献标识码:A
doi:10. 3969/j. issn. 1673 -7202. 2016. 03. 028
通信作者:孙震晓(1967. 01—),女,博士,教授,研究方向:主要从事中药分子药理及毒理学研究,Tel:(010)84738646,E-mail:sunzxcn@hotmail. com
作者简介:吴双(1992. 08—),女,北京中医药大学中药学院硕士研究生;杨红莉(1987. 04—),女,北京中医药大学中药学院硕士研究生,为共同第一作者
基金项目:国家自然科学基金项目(编号:81473418)
