三乙烯四胺基淀粉的合成及抗癌活性
2016-04-06程如梅步叶旭
程如梅,步叶旭
(温州医科大学 眼视光学院,纳米生物材料研究所,浙江 温州 325027)
三乙烯四胺基淀粉的合成及抗癌活性
程如梅,步叶旭
(温州医科大学 眼视光学院,纳米生物材料研究所,浙江 温州 325027)
[摘 要]目的:设计合成高分子基多胺抗癌药物(三乙烯四胺基淀粉,CTS),研究其对人端粒DNA d[G3(T2AG3)3]的作用机制和细胞毒性,提供高分子靶向抗癌药物的另一种开发思路。方法:以三乙烯四胺为出发点,通过环氧氯丙烷为桥梁连接到廉价淀粉上获得化合物CTS,通过各种光谱手段对CTS进行表征,运用圆二色CD光谱研究其与人端粒DNA的相互作用机制,采用CCK-8方法研究CTS对人眼脉络膜黑色素瘤(OCM-1)细胞的抑制作用。结果:CTS可以诱导人端粒DNA形成反平行G-四链体,对于OCM-1细胞具有较强的毒性,可以抑制其生长,而CTS对正常的人视网膜色素上皮(ARPE-19)细胞毒性极低,表明CTS可以作为以G-四链体为靶点的癌细胞潜在的靶向药物。结论:CTS可以促进G-四链体的生成,并对OCM-1细胞具有较强的抑制性,而对正常细胞影响微小。
[关键词]三乙烯四胺基淀粉;G-四链体;CD光谱;抗癌
端粒DNA是位于染色体末端的特殊DNA结构,高度重复的[TTAGGG]n序列具有防止染色体末端重组、融合和降解的功能[1]。端粒酶是一类逆转录核糖核蛋白酶,它能够以自身携带的一段RNA为模板在染色体端粒末端合成端粒DNA并逐渐加入到染色体末端[2],以补足在每次细胞分裂中丢失的端粒DNA而使染色体保持稳定。研究[3]发现,约90%的恶性肿瘤细胞的端粒酶都表达较高的活性,而正常体细胞内几乎检测不到,因此近年来对于端粒酶活性的抑制成为了设计新型抗肿瘤药物的靶点[4-5]。人端粒DNA d[G3(T2AG3)3]序列中连续鸟嘌呤(GGG)通过Hoogsteen氢键形成的平面结构经表面堆积后形成端粒G-四链体构型[6],这种端粒G-四链体结构的DNA能够抑制端粒酶的活性。如果药物分子能够稳定G-四链体结构或诱导其形成,则可使端粒酶难以发挥其逆转录酶活性合成端粒DNA,从根本上抑制端粒酶活性和阻断端粒DNA合成,最终导致肿瘤细胞的凋亡或死亡。
多胺化合物能与DNA产生较强作用并具有抗癌活性[7]。研究表明癌细胞表面的负电荷比正常细胞多,多胺化合物易带上正电荷而在癌细胞表面凝集。脂肪多胺可以调控c2m yc基因表达,稳定G-四链体的形成[8]。精胺也可以促进DNA的定性排列,调控DNA的表达[9]。然而,许多多胺化合物在抑制癌细胞的同时,对正常细胞也产生严重的伤害,多胺化合物的抗癌活性与其结构、代谢过程、靶向性等相关[10]。本研究将多胺化合物修饰到淀粉上,合成表征了三乙烯四胺改性淀粉衍生物(CTS,分子示意见图1),通过光谱发现了其与G-四链体的作用和抑制癌细胞的作用,为高分子抗癌药物的开发提供了另一种思路,并揭示了多胺淀粉化合物与端粒DNA的作用机制。
1 材料和方法
1.1主要试剂 马铃薯淀粉、三乙烯四胺、环氧氯丙烷、高氯酸、氢氧化钠、三羟甲基氨基甲烷Tris缓冲溶液、磷酸系PBS缓冲溶液和乙醇均购自国药集团上海试剂公司;PAGE纯化d[G3(T2AG3)3]购自上海基康生物有限公司;含10%胎牛血清和50 μg/mL庆大霉素的DMEM/F12(1:1)完全培养液、含10%胎牛血清和50 μg/mL庆大霉素的1640细胞培养液均购自美国Hyclone公司;CCK-8试剂盒购自上海酶联生物科技有限公司。
1.2实验仪器 红外光谱仪(Nicolet FT-IR NEXUS,溴化钾压片),热重分析仪(STA 409 PC/4/H Luxx,氮气气氛,升温速度为10 ℃/min),圆二色CD光谱(Jascol 810),自动温控细胞培养箱(Thermo Scientific Form),酶标仪(Thermo Multiskan MK3)。
1.3实验细胞 人视网膜色素上皮(ARPE-19)细胞和人眼脉络膜黑色素瘤(OCM-1)细胞购自中科院细胞生物学研究所上海细胞库。
1.4CTS的合成 取10 g淀粉置于三颈瓶中,置于20 mL水溶液中,搅拌均匀后加入环氧氯丙烷溶液1.0 mL,用高氯酸调节溶液pH至2,水浴40 ℃加热,在磁力搅拌器上加热搅拌10 h;所得的醚化淀粉在碱性水溶液环境中继续与5 mL多胺溶液作用,将所得产物调至中性,过滤,分别用蒸馏水、乙醇洗涤3次,低温烘干,保存,即得到CTS。
1.5CD光谱测试 所有测试均在pH=7.4的Tris/ HCl缓冲溶液中进行,将d[G3(T2AG3)3]的浓度固定在5 μmol/L,测试前将CTS溶液和d[G3(T2AG3)3]溶液混合后放置6 h,再进行CD光谱测定,测定200~320 nm范围的光谱吸收。
1.6细胞毒性研究 ARPE-19细胞利用含10%胎牛血清、50 μg/mL庆大霉素的DMEM/F12(1:1)完全培养液培养,OCM-1细胞利用含10%胎牛血清、50 μg/mL庆大霉素的1640细胞培养液培养,并置于37 ℃、5% CO2及饱和湿度的恒温培养箱中。培养时加入不同浓度的样品进行培养。细胞培养使用标准96孔板,采用CCK-8方法测定细胞增殖[11]。
2 结果
2.1CTS表征 淀粉和CTS的红外光谱示意见图2,可以看出两个物质的红外光谱比较接近,均在3 384 cm-1附近出现典型的发生氢键作用的多羟基O-H伸缩振动峰,在931 cm-1附近出现葡萄糖环的C1-H完全振动,证明了环的完整性。从热分析(见图3)看CTS的分解速率要低于原淀粉。

图2 淀粉和CTS的红外光谱
2.2CD光谱 图4显示了化合物CTS与人端粒DNA序列d[GGG(TTAGGG)3]作用。该DNA序列在Tris缓冲溶液中(无金属离子存在下)于295 nm处出现正的最大吸收峰,同时在252 nm附近出现了另外一个正的强度吸收峰,强度稍弱,另外在240 nm附近产生负的最大吸收,这种特征为平行和反平行混合的G-四链体共存,表明了该DNA序列在无金属离子存在时形成了2种混合的G-四链体,而且比例相当。接着研究了不同浓度CTS对不含金属离子人端粒DNA序列体系的影响。
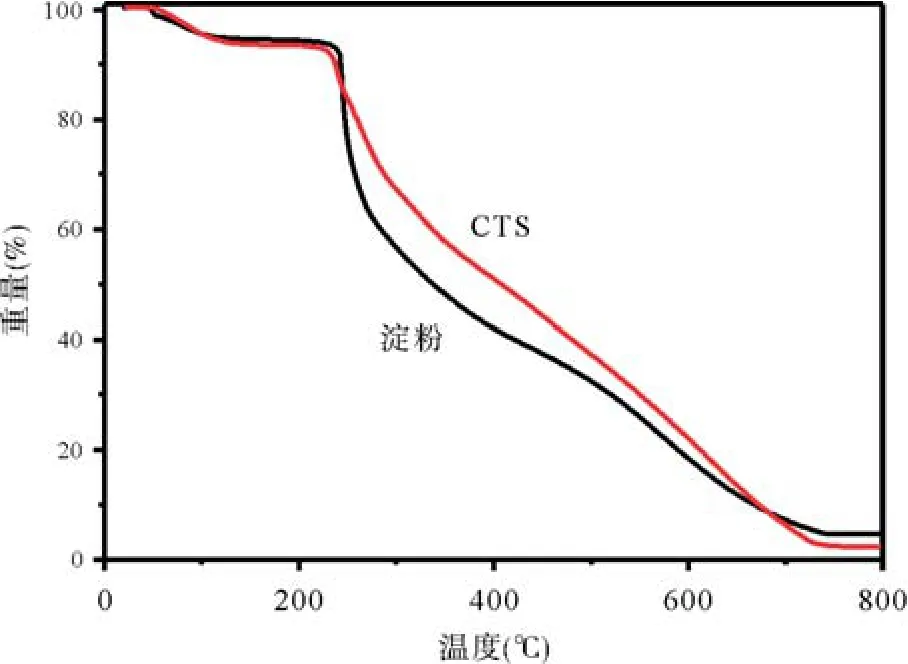
图3 淀粉和CTS的热重分析图

图4 多种体系中G-四链体的CD光谱
由图5可以看到,随着CTS浓度的增大,体系在252 nm处的正的吸收逐渐减弱,当CTS的浓度增大到DNA的5倍时,在252 nm处的吸收为0,而在260 nm处出现了明显的负的吸收,浓度继续增大,260 nm处负的吸收继续增强,在CTS浓度为DNA的10倍时达到最大,而后浓度增大观察不到明显的变化,说明体系达到饱和。而260 nm处的负的吸收是反平行G-四链体的典型特征。这表明CTS可以诱导反平行G-四链体结构的形成。
2.3细胞毒性 为了进一步研究CTS对正常细胞和肿瘤细胞的作用,利用ARPE-19细胞和OCM-1细胞调查研究淀粉、醚化淀粉、CTS对不同细胞的毒性。各个样品的浓度均为200 μg/mL。ARPE-19细胞的毒性结果见图6A,相比于其他样品,无论24 h还是48 h,淀粉在ARPE-19细胞的孵化中都表现出最高的存活率,CTS在ARPE-19细胞的孵化中细胞存活率仍达到80%以上,而醚化淀粉的存活率反而是最低的。我们进一步调查了不同浓度CTS对OCM-1细胞的毒性影响。图7结果显示,当CTS浓度低于100 μg/mL时,体现出较低的细胞毒性。当浓度高至200 μg/mL时,分别孵化24 h和48 h后发现,OCM-1细胞的存活率分别低于50%和40%,随着浓度的加大,OCM-1细胞的存活率进一步降低。对正常细胞影响较小,CTS显示了较高的生物相容性,而对癌细胞具有一定的靶向性,对OCM-1细胞的抑制作用比较明显。与淀粉和醚化淀粉相比,CTS的这种抑制作用和其中的多胺基基团密不可分。
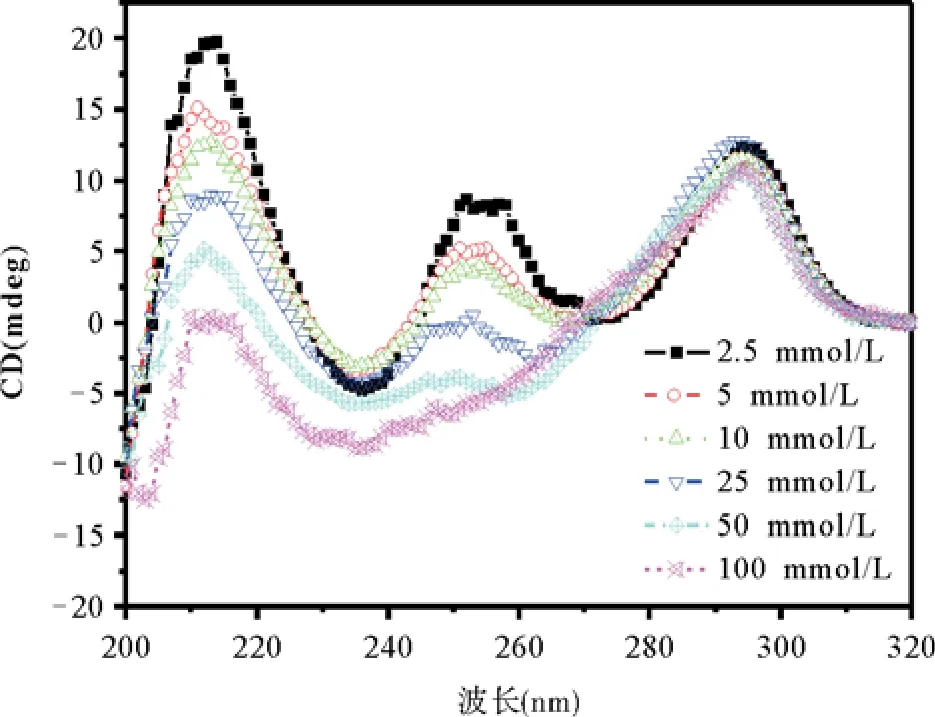
图5 不同浓度CTS存在下人端粒DNA序列d[GGG(TTAGGG)3]形成的G-四链体的CD光谱图
3 讨论
CTS和淀粉的最大区别在于CTS具有多个氨基,而淀粉没有氨基,因此其光谱和热行为发生了变化。从红外光谱(见图2)看出淀粉在1 656 cm-1的峰为结合水的δH2O弯曲振动峰,而CTS在1 645 cm-1振动峰显得稍弱,且向低频移动,归属为δN-H和δH2O弯曲振动峰。CTS还有一处典型的变化,就是位于1 231 cm-1处的νC-N。而热分析(见图3)表明淀粉和CTS的热分解过程均可以分为四个过程。第一阶段失重发生在50~110 ℃之间,为化合物失去结晶水的过程。第二阶段失重发生在220~260 ℃区间,部分羟基发生了断裂脱水[12]。第三阶段则发生了高分子链的断裂和葡萄糖单元环的剪切裂解,处于260~380 ℃之间[13]。最后发生高分子材料的碳化[14]。CTS的分解速率要低于淀粉,可能是由于氨基的加入,增加了分子链之间的作用,比如氢键增强了链的缠绕,使得分解速率下降。而最后的CTS的碳化率低于淀粉,原因仍在于引入了氨基,在高温下容易生成氮氧化物挥发掉。多胺基的引入,增强了CTS与其他分子产生氢键的能力,因此我们将CTS与富含鸟嘌呤的端粒DNA来作用,研究形成G-四链体的可能性以及抑制肿瘤的特性。

A:ARPE-19细胞;B:OCM-1细胞图6 200 μg/mL不同样品的溶液对不同细胞毒性的结果
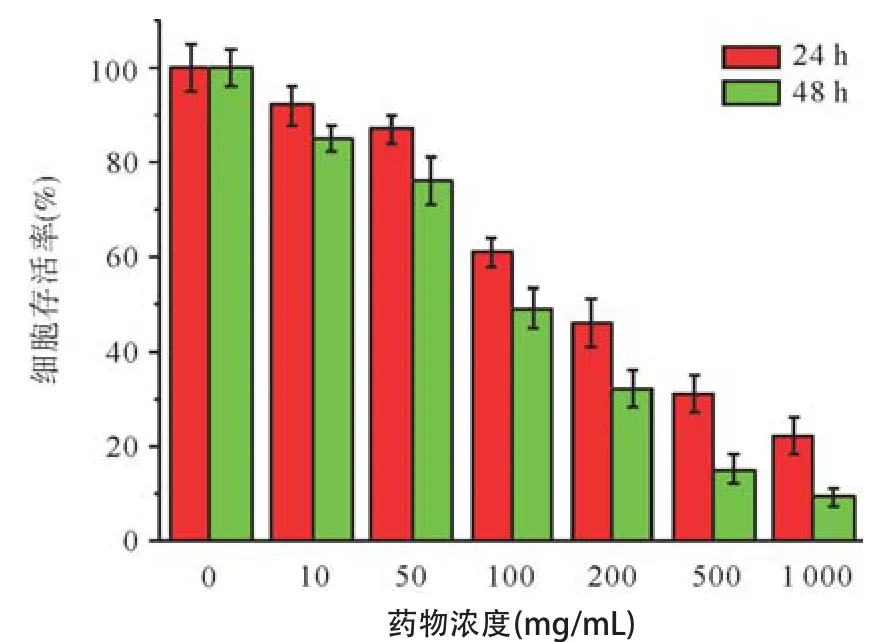
图7 不同浓度的CTS化合物对OCM-1细胞的毒性
G-四链体是一种特殊的DNA二级结构,它是在特定的条件下形成的,因此研究小分子与G-四链体相互作用首先需要确认G-四链体结构的存在。CD光谱被广泛用来研究G-四链体的热力学行为。CD光谱显示该DNA序列在无金属离子存在时形成了2种混合的G-四链体,平行G-四链体在260 nm有正的最大cotton吸收,而在240 nm有负的最大cotton吸收,而反平行G-四链体在295 nm有正最大的cotton吸收,260 nm有负的最大cotton吸收,这种特殊的cotton效应使我们很容易将G-四链体同其他DNA二级结构相区别[15]。图4表明当体系中存在0.1 mol/L 的Na+时,DNA体系在295 nm处出现正的最大吸收,同时在265 nm处出现了负的最大吸收,为典型的反平行G-四链体的特征。在0.1 mol/L的K+存在下,体系在290 nm处出现正的最大吸收,235 nm有负的最大吸收,在260 nm附近出现一对正的肩峰,这表明G-四链体是以平行和反平行混合的形式存在的,比较与无金属离子的情况,反平行的比例大一些;当在含0.1 mol/L K+的体系中同时加入2.5 μmol/L的CTS后,体系的cotton吸收发生明显的变化,260 nm附近的一对肩峰强度明显减弱,这表明了CTS诱导G-四链体发生变化,朝着反平行的G-四链体方向变化,因此CTS能够与G-四链体产生相互作用。
细胞毒性实验显示了淀粉、醚化淀粉、CTS 对ARPE-19细胞和OCM-1细胞不同的细胞毒性结果。ARPE-19细胞在醚化淀粉中较低的细胞存活率,可能与醚化淀粉有未反应的环氧基团有关,经过胺化后环氧基打开,降低了环氧基攻击细胞的DNA、蛋白的不良反应。而对于肿瘤细胞,醚化淀粉由于环氧基的存在,也对肿瘤细胞造成一定的损伤,使得48 h后的存活率几乎降低到50%。但CTS对肿瘤细胞的影响更大,可以使得OCM-1细胞的存活率下降到35%,这可能是由CTS与DNA的相互作用引起。
综上所述,我们合成得到了一种潜在的抗癌高分子药物CTS,与淀粉和醚化淀粉相比,其主要显现的官能团为三乙烯四胺,造成了CTS对OCM-1细胞较强的生长抑制性,而对正常细胞影响不大。CTS可以诱导人端粒DNA形成反平行的G-四链体,从而预防了肿瘤细胞的快速增殖,为高分子抗癌药物的开发提供了另一种思路。
参考文献:
[1]BOCHMAN M L,PAESCHKE K,ZAKIAN V A.DNA secondary structures:stability and function of G-quadruplex structures [J].Nat Rev Genet,2012,13(11):770-780.
[2]CHOW T T,ZHAO Y,MAK S S,et al.Early and late steps in telomere overhang processing in normal human cells:the position of the fi nal RNA primer drives telomere shortening [J].Genes Dev,2012,26(11):1167-1178.
[3]DINSHAW J P,ANH T P,VITALY K.Human telomere,oncogenic promoter and 5’-UTR G-quadruplexes:diverse higher order DNA and RNA targets for cancer therapeutics[J].Nucleic Acids Res,2007,35(22):7429-7455.
[4]LIU T,LIANG X,LI B,et al.Telomerase reverse transcriptase inhibiton stimulates cyclooxygenase 2 expression in cancer cells and synergizes with celocoxib to exert anti-cancer effects [J].Br J Cancer,2013,108(11):2272-2280.
[5]MOCELLIN S,POOLEY K A,NITT D.Telomerase and the search for the end of cancer[J].Trends Mol Med,2013,19(2):125-133.
[6]BIFFI G,TANNAHILL D,MCCAFFERTY J,et al.Quantitative visualization of DNA G-quadruplex structures in human cells [J].Nat Chem ,2013,5(3):182-186.
[7]MELCHIORRE C,BOLOGNESI M L,MINARINI A,et al.Polyamines in drug discovery:from the universal template approach to the multitarget-directed ligand design strategy[J].J Med Chem,2010,53(16):5906-5914.
[8]LIU J,GUO L,YIN F,et al.Characterization and antitumor activity of triethylene tetramine,a novel telomerase inhibitor [J].Biomed Pharmacother,2008,62(7):480-485.
[9]IGARASHI K,KASHIWAGI K.Modulation of cellular function by polyamines[J].Int J Biochem Cell Biol,2010,42(1):39-51.
[10]WONG P E,TETLEY L,DUFES C,et al.Polyamine azacyclic compounds demonstrate anti-proliferative activity in vitro but fail to control tumour growth in vivo[J].J Pharm Sci,2010,99(11):4642-4657.
[11]褚茂平,胡晨,周爱华,等.川崎病血清特异相关miR-23a对人脐静脉内皮细胞生长及迁移的影响[J].温州医科大学学报,2015,45(5):321-326.
[12]ATHWALE V D,LELE V.Thermal studies on granular maize starch and its graft copolymers with vinyl monomers[J].Starch,2000,52(6-7):205-213.
[13]ZHANG X,GOLDING J,BURGAR I.Thermal decompositon chemistry of starch studied by 13C high resolution solidstate NMR spectroscopy[J].Polymer,2002,43(22):5791-5796.
[14]LIU X,YU L,LIU H,et al.In situ thermal decomposition of starch with constant moistrue in a sealed system[J].Polym Degrad Stability,2008,93:260-262.
[15]WILLIAMSON J R,RAGHURAMAN M K,CECH T R.Monovalent cation-induced structure of telomeric DNA:the G-quartet model[J].Cell,1989,59(5):871-880.
(本文编辑:吴昔昔)
·消 息·
Synthesis of triethylenetetramine-starch and its antitumor effects
CHENG Rumei,BU Yexu.School ofOphthalmology & Optometry,Wenzhou Medical University,Institute of Advanced Materials for Nano-Bio Applications,Wenzhou,325027
Abstract:Objective:To design and synthesize the potential antitumor drug,CTS (triethylenetetraminestarch).Its interactions with the human telomere DNA (d[G3(T2AG3)3series]) and cytotoxicity to OCM-1 tumor cells are investigated.As a consequence,it provides a new strategy to develop targeted antitumor drugs.Methods:The triethylenetetramine reacted with the epichlorohydrin crosslinked-starch (CS) to produce the CTS.It was characterized by various methods.The circular dichroism (CD) spectra were used to clarify the interaction mechanism between the CTS and human telomere DNA.Its cytotoxity to OCM-1 cells was determined by CCK-8 method.Results:The antiparallel G-quadruplex could be induced and stabilized by CTS.This may be the reason that CTS inhibited the growth of OCM-1 cells,and moreover it showed very low cytotoxicity to ARPE-19 human cells.Such observations indicated that CTS was a promising antitumor drug.Conclusion:The CTS can stabilize the G-quadruplex and has higher cytotoxicity to OCM-1 cells.It has insignifi cant effects on the growth of normal human cells.
Key words:triethylenetetramine-starch; G-quadruplex; CD spectra; antitumor
作者简介:程如梅(1978-),女,河北邯郸人,助理研究员,博士。
基金项目:国家自然科学基金资助项目(21405115);浙江省医药卫生科研项目(2015KYB254);温州市科技局科技计划项目(Y20120218);温州医科大学附属眼视光医院项目(YNCX2014 08)。
收稿日期:2015-09-01
[中图分类号]R979.1
[文献标志码]A
DOI:10.3969/j.issn.2095-9400.2016.01.004
