利用基因工程提高酿酒酵母半乳糖代谢
2016-04-05张建才
邹 静,孟 军,张建才,郭 硕
(河北科技师范学院食品科技学院,河北 秦皇岛,066000)
利用基因工程提高酿酒酵母半乳糖代谢
邹 静*,孟 军,张建才,郭 硕
(河北科技师范学院食品科技学院,河北 秦皇岛,066000)
为了提高酿酒酵母半乳糖利用速率,减弱葡萄糖阻遏半乳糖代谢,研究了负代谢调控基因GAL80,GAL6以及MIG1基因对半乳糖代谢的影响。通过重复利用loxp-KanMX-loxp抗性基因对GAL80,GAL6以及MIG1基因进行单敲除、双敲除及三敲除,共构建了7株工程菌株。结果表明,7株工程菌株的半乳糖利用速率、乙醇产率均加快。其中,GAL80和MIG1双敲除菌株FY-501α的半乳糖代谢速率为0.916 g·(L·h)-1,较亲本提高44.71%,乙醇产率为0.329 g·(L·h)-1,较亲本提高46.22%,而在FY-501α基础上继续敲除GAL6得到GY-501α,其半乳糖代谢速率以及乙醇产率均未见提高。7株菌的葡萄糖阻遏效应也得到减弱,其中FY-501α的葡萄糖阻遏效应较亲本减弱42.11%,其次为EY-502α,FY-502α和FY-503α,减弱31.57%。阻断半乳糖代谢途径的负调控基因可以加速半乳糖代谢、减弱葡萄糖阻遏效应。
GAL基因;半乳糖代谢;葡萄糖阻遏;MIG1;GAL80
工业上用糖蜜、木质纤维素生产乙醇时,酵母首先会将其分解成半乳糖和葡萄糖的混合物。对于酵母而言,葡萄糖是优势碳源,可以快速利用,而半乳糖作为酵母非常规碳源,葡萄糖的存在会抑制半乳糖的代谢,这就是所谓的葡萄糖阻遏效应。因此,半乳糖的代谢速度成为限制上述有机碳源利用的限速因素。
研究表明,酵母胞内半乳糖是通过Leloir途径进行代谢的,而该途径所需酶是由GAL系列基因编码[1~3]。GAL属于诱导调控型基因,由1个激活蛋白Gal4和3个抑制蛋白Gal8,Gal6和Mig1来调控[4~7]。本次主要研究MIG1,GAL80及GAL6 3个基因对酿酒酵母半乳糖代谢的影响,通过单敲除、双敲除及3个基因全部敲除共构建了7株转化子,通过对比这7株突变子的半乳糖代谢速率及葡萄糖阻遏情况,来分析阻断负调控基因在加速半乳糖代谢上的作用。
1 实验材料
1.1 菌株和质粒
本实验所用的酵母菌株、大肠杆菌菌株及质粒列于表1,表2,其中pUC-MABK质粒用于敲除MIG1基因,pUC-G6ABK质粒用于敲除GAL6基因,pUC-G8ABK质粒用于敲除GAL8基因。
1.2 主要溶液
微量元素溶液:3 g/L EDTA,0.09 g/L CaCl2·2H2O,0.90 g/L ZnSO4·7H2O,0.60 g/L FeSO4·7H2O,200 mg/L H3BO3,156 mg/L MgCl2·2H2O,80 mg/L Na2MoO4·2H2O;60 mg/L CoCl2·2H2O,60 mg/L CuSO4·5H2O以及20 mg/L KI。用NaOH调pH值至4.0,高温蒸汽灭菌后备用。
维生素溶液:50 mg/L生物素,200 mg/L氨基苯甲酸,1 g/L烟酸,1 g/L泛酸钙,1 g/L盐酸吡哆醇,1 g/L维生素B1,以及25 g/L肌醇,pH 6.5,膜过滤后4 ℃储存。

表1 本实验所用菌株性质及来源
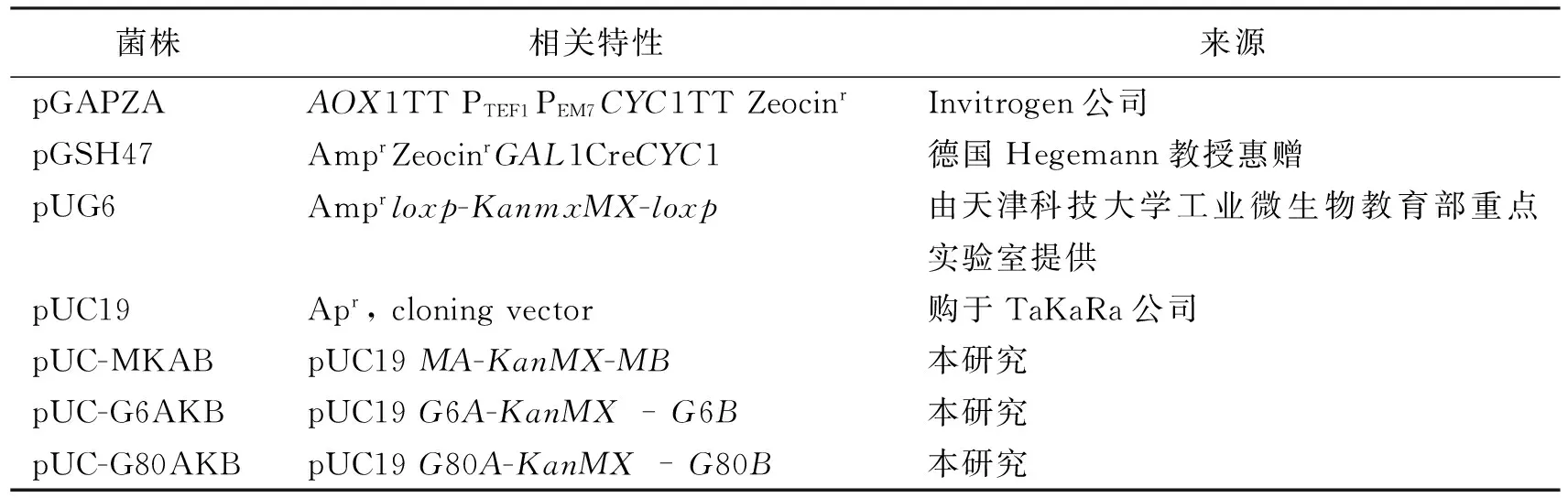
表2 本实验所用质粒性质及来源
1.3 主要培养基
LB培养基用于DH5α的培养;YEPD用于酵母菌的培养;重组子筛选培养基为YEPD中添加200 μg/mL的G418。半乳糖培养基(成分为半乳糖60 g/L,(NH4)2SO45 g/L,KH2PO41 g/L,MgSO4·7H2O 0.5 g/L,10 mL/L 微量元素溶液以及1 mL/L 维生素溶液)用于测定重组菌株半乳糖利用能力;葡萄糖培养基(成分为葡萄糖60 g/L,(NH4)2SO45 g/L,KH2PO41 g/L,MgSO4·7H2O 0.5 g/L,10 mL/L微量元素溶液以及1 mL/L 维生素溶液)主要用于测定重组菌株葡萄糖利用能力;葡萄糖阻遏培养基(成分为半乳糖30 g/L,葡萄糖30 g/L,(NH4)2SO45 g/L,KH2PO41 g/L,MgSO4·7H2O 0.5 g/L,10 mL/L微量元素溶液以及1 mL/L维生素溶液)用于测定重组菌株葡萄糖阻遏情况。
2 实验方法
2.1 质粒的构建
以酿酒酵母AY5α基因组为模板,利用PCR技术分别扩增3个抑制子基因(GAL80,GAL6,MIG1基因)的上下游片段,通过限制性内切酶链接到受体质粒pUC19上。然后以pUG6为模板,扩增出loxp-KanMX-loxp卡那霉素抗性片段插入到已连接抑制子基因片段的质粒中,分别得到3个敲除质粒pUC-G8ABK,pUC-G6ABK和pUC-MABK。3个敲除质粒图谱见图1,所需PCR引物见表3。
2.2KanMX抗性基因的重复利用
来源于P1噬菌体的Cre重组酶(Cause Recombination Enzyme),是可以特异性识别靶位点(loxp位点),并催化靶位点断裂然后重新连接DNA的一种重组酶,属于Int家族。pGSH47质粒在半乳糖诱导下可以编码Cre重组酶,从pUG6质粒上扩增出的KanMX抗性基因的两侧各含有1个loxp位点,且2个loxp位点同向,因此当Cre重组酶表达时,2个loxp位点中的KanMX基因可以被切除,再把2个loxp位点的剩余部分重新连接在一起,从而实现KanMX筛选标记的敲除[9]。
2.3 突变株的构建
利用PCR法,以已构建的3个敲除质粒为模板,分别扩增出MIG1基因同源重组片段MIG1A-KanMX-MIG1B,GAL6基因同源重组片GAL6A-KanMX-GAL6B片段,以及GAL80基因同源重组片段GAL80A-KanMX-GAL80B基因片段,采用醋酸锂转化法化转AY5α。挑在抗性平板上菌落较大的为目的菌,然后进行PCR法验证,重组子验证引物见表4。

表3 质粒构建过程中所需引物

表4 重组子重组验证引物
2.4 重组子半乳糖、葡萄糖利用能力测定
将7株突变株及其亲本AY5α用YEPD培养基150 r/min振荡培养12 h后,经无菌水离心洗涤后,分别接种到150 mL葡萄糖培养基和半乳糖培养基中,30 ℃静止培养,每隔一定时间利用HPLC法测发酵液中的葡萄糖或半乳糖的质量浓度,以此计算半乳糖和葡萄糖的利用情况。
2.5 重组子葡萄糖阻遏情况测定
将7株突变株及亲本AY5α经过一级培养后,用无菌水离心洗涤3次后,分别接种到葡萄糖阻遏培养基中。每隔一定时间测定培养基中残存的葡萄糖和半乳糖,以此计算7株重组子和亲本的葡萄糖阻遏情况。
2.6 发酵液中糖含量的测定
对不同发酵时间的发酵液进行取样,然后迅速过0.45 μm的醋酸纤维膜,然后放入到-20 ℃冰箱冷冻。所有发酵液中的糖、乙醇均用高效液相色谱(HPLC)法来测定。测定条件为:流动相为5 mmol/L的稀硫酸溶液,流速为0.6 mL/min,采用示差检测器,柱温为65 ℃,柱子为Aminex HPX-87H C18柱子。
3 结果与分析
3.1 敲除质粒的构建
通过PCR扩增技术分别扩增出半乳糖代谢阻遏基因片段,并将其链接在pUC19基础质粒上,然后将PCR扩增出的loxp-KanMX-loxp片段插入到2个阻遏基因片段中间,构建成半乳糖代谢阻遏基因的敲除质粒,3个敲除质粒的质粒图谱见图1。pUC-MABK质粒构建过程验证的凝胶电泳图见图2,pUC-G8ABK质粒构建过程验证的凝胶电泳图见图3,pUC-G6ABK质粒构建过程验证的凝胶电泳图见图4。

图1 半乳糖代谢阻遏基因敲除质粒A,MIG1基因敲除质粒pUC-MABK;B,GAL80基因敲除质粒pUC-G8ABK;C,GAL6基因敲除质粒pUC-G6ABK

图2 pUC-MABK构建验证A,pUC-MA酶切及PCR结果(M,DL5000 marker;1,pUC-MA用KpnI和BamHI双酶切,可以切出535 bp和2 686 bp两条带;2,以pUC-MA为模板,以Mup1,Mdown1为引物扩增上游同源臂MIG1A结果)。B,pUC-MAB酶切及PCR结果(M,DL5000 marker;1,pUC-MAB用HindIII和EcoRI双酶切,切出457 bp和3 221 bp两条带;2,以pUC-MAB为模板,以Mup2,Mdown2为引物,PCR扩增下游同源臂MIG1B结果)。C,pUC-MABK酶切及PCR结果(M,DL5000 marker;1,pUC-MABK用EcoRI和BamHI双酶切,切出1 613 bp和3 678 bp两条带;2,以pUC-MABK为模板,以Kanup2和Kandown2为引物,PCR扩增出抗性基因KanMX结果)。

图3 重组质粒pUC-G8ABK构建验证M,DL5000 Marker;1,质粒pUC-G8A用EcoRI进行单酶切,切出677 bp和2 686 bp两条带;2,以pUC-G8A质粒为模板,以G80up1和G80down1为引物,PCR扩增上游同源臂GAL8A结果;3,pUC-G8AB质粒用KpnI进行单酶切,切出720 bp和3 363 bp两条带;4,以pUC-G8A质粒,以G80up2和G80down2为引物,PCR扩增下游同源臂GAL8B结果;5,pUC-G8AKB质粒用HindIII进行单酶切,切出1 613 bp和4 083 bp两条带; 6,以pUC-G80AKB质粒为模板,以Kanup1和Kandown1为引物,PCR扩增抗性基因KanMX结果。

图4 重组质粒pUC-G6AKB构建验证M,DL5000 Marker; 1,质粒pUC-G6A使用EcoRI和进行单酶切,切出646 bp和2 686 bp两条带; 2,以质粒pUC-G6A为模板,以G6up1和G6down1为引物,PCR扩增上游同源臂GAL6A结果;3,质粒pUC-G6AB用HindIII进行双酶切,切出664 bp和3 332 bp两条带; 4,以质粒pUC-G6AB为模板,以G6up2和G6down2为引物,PCR扩增下游同源臂GAL6B结果;5,质粒pUC-G6AKB用KpnI进行双酶切,切出1 613 bp和3 996 bp两条带; 6,以质粒pUC-G6AKB为模板,以Kanup1和Kandown1为引物,PCR扩增抗性基因KanMX结果。
3.2 阻遏基因缺失对菌株葡萄糖利用的影响
基因改造过程中,基因的表达或者敲除可能会对细胞的一些生理特性产生影响[8],为了确认敲除这3个阻遏基因是否会对菌体产生影响,分别测试了亲本和7株突变株厌氧情况下葡萄糖利用情况。结果表明,7株菌葡萄糖利用情况与亲本一致,葡萄糖利用速率、乙醇产率相同,耗糖曲线一致(表5)。因此在厌氧条件下,分别敲除3个阻遏基因对微生物利用葡萄糖无影响。

表5 亲本及7株突变株葡萄糖发酵数据比较
3.3 阻遏基因缺失对菌株半乳糖利用的影响
将亲本与7株突变株分别接种到半乳糖发酵培养基中,30 ℃厌氧发酵72 h,每隔12 h取样,用高效液相色谱测培养液中糖的质量浓度,半乳糖耗糖曲线见图5(A,B),具体计算数值见表6。结果表明,亲本AY5α半乳糖消耗速率最慢,发酵72 h后残糖为11.52 g/L,半乳糖利用速率为0.633 g·(L·h)-1,而其它7株突变株发酵72 h后的残糖均低于亲本,说明敲除半乳糖阻遏基因可以加速半乳糖的利用。在3株单敲除菌株中,敲除GAL80基因的EY-502α的半乳糖利用速率最快为0.775 g·(L·h)-1。其次为敲除MIG1基因的菌株EY-501α,其半乳糖利用速率为0.75 g·(L·h)-1。耗时最长的为Δgal6突变株EY-503α,发酵72 h后残糖的质量浓度为6.2 g/L,半乳糖利用速率为0.707 g·(L·h)-1。3株单敲除菌株的乙醇生成速率与其耗糖速率一致,即半乳糖消耗的越快、乙醇产生的越快。这表明对于工程菌AY5而言,厌氧条件下GAL80基因对半乳糖利用影响最大,其次为MIG1基因,影响最小的为GAL6基因。
3株双敲除菌株中,Δmig1Δgal80突变株FY-501α的半乳糖消耗速率最快,为0.916 g·(L·h)-1。其次为Δgal80Δgal6突变株FY-502α,其半乳糖利用速率为0.879 g·(L·h)-1。而Δmig1Δgal6菌株FY-503α半乳糖利用速率最慢,且低于Δgal80单敲菌株EY-502α。三敲除菌株GY-501α半乳糖利用速率也较快,72 h内完成发酵,半乳糖利用速率为0.900 g·(L·h)-1,但较Δmig1Δgal80突变株FY-501α慢,且乙醇终浓度及乙醇生成速率也较FY-501α低。Ostergaard等[8]以野生型菌株为受体菌,分别研究了在耗氧条件下Δgal6,Δgal80Δmig1,Δgal6Δgal80Δmig1突变株半乳糖利用情况。虽然3个基因的缺失也均可以加速半乳糖的利用,但是3个基因对半乳糖消耗速率的影响却与本次研究的结果有较大差异:其在耗氧情况下,Δgal6Δgal80Δmig1突变株利用半乳糖最快,其最大比半乳糖消耗率为4.25 mmol·(L·h)-1,其次为Δgal6突变株,而影响最小的为Δgal80Δmig1突变株。这就表明,在耗氧情况下,GAL6基因对半乳糖利用的影响最大;在厌氧情况下,GAL6基因的影响明显减小。而GAL80,MIG1成为抑制半乳糖利用的主要阻遏基因。因此,在本次实验条件下,MIG1,GAL80基因缺失是加速半乳糖利用的最佳组合,而继续敲除GAL6对加速半乳糖利用影响不大,反倒会影响菌体的其它性能。

图5 亲本与7株突变株半乳糖消耗曲线
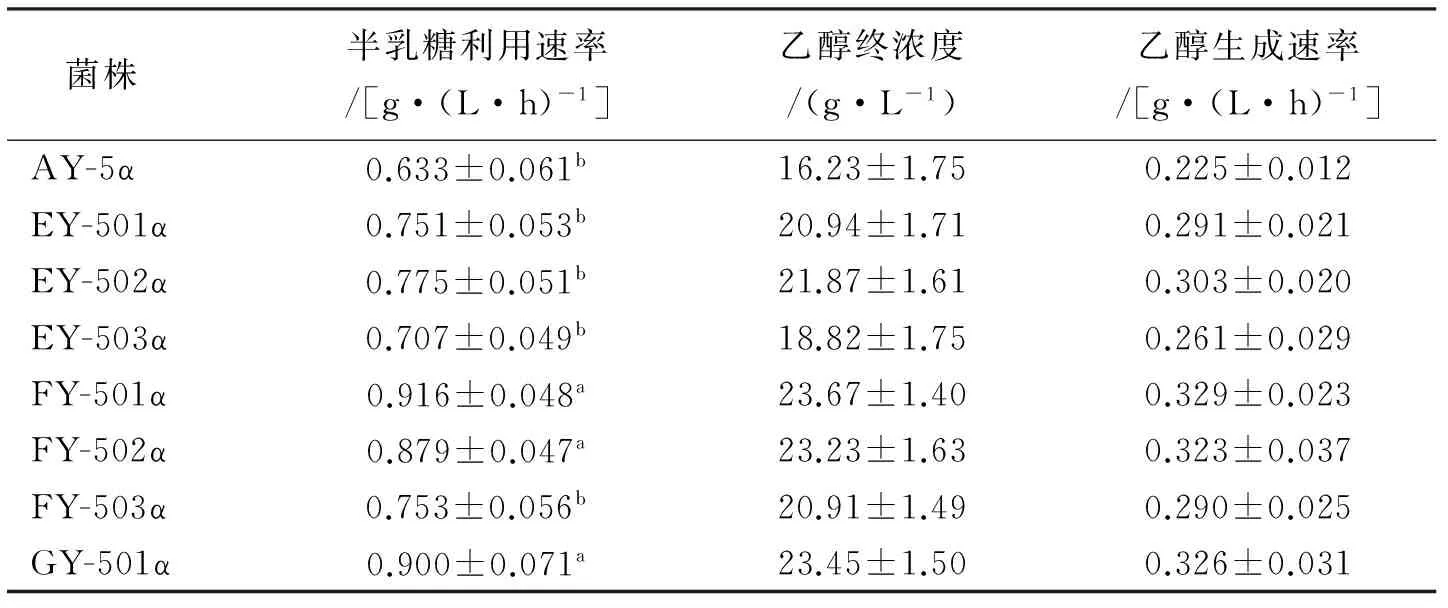
菌株 半乳糖利用速率/[g·(L·h)-1]乙醇终浓度/(g·L-1)乙醇生成速率/[g·(L·h)-1]AY-5α0.633±0.061b16.23±1.750.225±0.012EY-501α0.751±0.053b20.94±1.710.291±0.021EY-502α0.775±0.051b21.87±1.610.303±0.020EY-503α0.707±0.049b18.82±1.750.261±0.029FY-501α0.916±0.048a23.67±1.400.329±0.023FY-502α0.879±0.047a23.23±1.630.323±0.037FY-503α0.753±0.056b20.91±1.490.290±0.025GY-501α0.900±0.071a23.45±1.500.326±0.031
注:a为发酵60 h内的半乳糖利用速率;b为发酵72 h内的半乳糖利用速率。
3.4 阻遏基因缺失对菌株葡萄糖阻遏效应的影响
利用高效液相色谱测试亲本与7株菌接种到葡萄糖-半乳糖混合培养基中2种糖的消耗情况。结果表明,亲本AY5α存在较为严重的葡萄糖阻遏现象(图6 A),当葡萄糖存在时半乳糖基本不消耗,只有葡萄糖基本耗尽时半乳糖才开始被利用,整个发酵周期为114 h。对于7株突变株而言,葡萄糖阻遏得到不同程度的消弱。在3株单敲除菌株中,3株菌均可在葡萄糖存在的情况下利用半乳糖,发酵周期均较亲本缩短,其中葡萄阻遏程度减缓最明显的为Δgal80菌株EY502α(图6 C),为78 h,较亲本的114 h缩短了31.6%。阻遏程度减缓最少的为Δgal6菌株EY503α,耗时102 h,较亲本缩短了12 h。
在3株双敲除菌株中,葡萄糖阻遏程度较3株单敲除菌株得到进一步的消弱,发酵时间也进一步缩短。其中,缩短最明显的为Δgal80Δmig1突变株FY-501α,仅为66 h(图6 E),较亲本缩短了42.1%。而Δgal80gal6菌株FY-502α与Δgal6mig1突变株FY-503α2株菌的耗糖曲线基本相同,整个发酵周期均为78 h(图6 F,图6 G)。对于三敲除菌株GY-501α而言,其葡萄糖阻遏现象也得到消弱,但是减缓程度要低于Δgal80mig1突变株FY-501α,发酵周期为78 h。Ostergaard等[10,11]研究表明,耗氧条件下,单敲除、双敲除以及3个阻遏基因全部敲除都可以减缓葡萄糖阻遏现象,但是减缓效果最好的是Δgal6Δgal80Δmig1突变株。而厌氧条件下,从上述数据可以看出,在缓解葡萄糖阻遏方面,双敲除要优于单敲除的效果,其中敲除GAL80和MIG1的效果最为明显。综合考虑,确定敲除GAL80和MIG1为加速半乳糖利用的最佳组合。
3.5 突变株遗传稳定性
7株突变株中选FY-501α来验证其遗传稳定性。将FY-501α在无抗性的YEPD斜面上进行反复传代20代,并取第1,5,10,15,20代进行PCR验证、半乳糖发酵实验和混合糖发酵实验。
PCR验证结果显示,各代在无抗性的条件下,均保持了MIG1和GAL80基因完全缺失的特性。半乳糖发酵和混合糖发酵实验的结果表明,各代菌株发酵周期相同,糖的质量浓度变化曲线区别较小,说明各代重组菌株发酵性能稳定(数据未列出)。
4 结 论
酿酒酵母中半乳糖代谢作为替补代谢途径是受到严格调控的,3个负调控蛋白对半乳糖代谢速率均有影响。3个调控蛋白中,gal80对半乳糖代谢影响最大,其次是mig1,最后是gal6。而mig1在减弱葡萄糖阻遏效应方面影响最明显,其次是gal80,gal6的影响最小。
3个阻遏蛋白两两敲除中,效果最好的是gal80和mig1双敲除菌株,其半乳糖代谢速率增加44.71%,葡萄糖阻遏减弱42.11%,乙醇产率增加46.22%;其次是gal80和gal6双阻遏菌株,其半乳糖代谢速率增加38.86%,葡萄糖阻遏减缓31.57%,乙醇产率增加43.56%。而在双敲除基础上,重复利用KanMX抗性基因得到Δgal80gal6mig1三敲除菌株,其半乳糖利用速率没有继续提升,反倒略降,葡萄糖阻遏现象也没有继续得到缓解,而且菌体细胞出现形状上的改变,因此酿酒酵母在以半乳糖为碳源生产乙醇的过程中,去除MIG1和GAL80对加速半乳糖代谢、缓解葡萄糖阻遏现象更有效。

图6 亲本及7株突变株的葡萄糖阻遏效应其中A为亲本AY5α;B为EY-501α;C为EY-502α;D为EY-503α;E为FY-501α;F为FY-502α;G为FY-503α;H为GY-501α
[1] Bhat P J,Murthy T V S.Transcriptional control of theGAL/MELregulon of yeastSaccharomycescerevisiae:mechanism of galactose-mediated signal transduction[J].Molecular microbiology,2001,40(5):1 059-1 066.
[2] Lee K S,Hong M E,Jung S C,et al. Improved galactose fermentation ofSaccharomycescerevisiaethrough inverse metabolic engineering[J].Biotechnology and Bioengineering,2011,108(3):621-631.
[3] Rubio-Texeira M.A comparative analysis of the GAL genetic switch between not-so-distant cousins:Saccharomycescerevisiaeversus Kluyveromyces lactis[J].FEMS Yeast Research,2005,5(12):1 115-1 128.
[4] Zachariae W,Breunig K D. Expression of the transcriptional activator LAC9 (KlGAL4) inKluyveromyceslactis is controlled by autoregulation[J].Molecular and cellular biology,1993,13:3 058-3 066.
[5] Zenke F,Zachariae W,Lunkes A,et al.Gal80 Proteins ofKluyveromyceslactisandSaccharomycescerevisiaeAre Highly Conserved but Contribute Differently to Glucose Repression of the Galactose Regulon[J].Molecular and Cellular Biology,1993,13(12):7 566-7 576.
[6] Verma M,Bhat P J,Venkatesh K V.Steady-state analysis of glucose repression reveals hierarchical expression of proteins underMig1pcontrol in Saccharomyces cerevisiae[J].Biochemical Journal,2005,388:843-849.
[7] Traven A,Jelicic B,Sopta M.YeastGal4:A transcriptional paradigm revisited[J].Nature,2006,7(5):496-499.
[8] Ostergaard S,Olsson L,Johnston M,et al.Increasing galactose consumption bySaccharomycescerevisiaethrough metabolic engineering of the GAL gene regulatory network[J].Nature Biotechnology,2000,18(12):1 283-1 286.
[9] Güldener U,Heck S,Fiedler T,et al.A new efficient gene disruption cassette for repeated use in budding yeast[J].Nucleic acids research,1996,24(13):2 519-2 124.
[10] Zhou H X,Xu J L,Chi Z,et al.β-galactosidase over-production by a mig1 mutant ofKluyveromycesmarxianusKM for efficient hydrolysis of lactose[J].Biochemical Engineering Journal,2013,76(15):17-24.
[11] Ostergaard S,Roca C,Rønnow B,et al. Physiological studies in aerobic batch cultivations ofSaccharomycescerevisiaestrains harboring the MEL1 gene[J].Biotechnology and bioengineering, 2000,68(3):252-259.
(责任编辑:朱宝昌,杨静)
Improvement of Galactose Metabolism ofSaccharomycescerevisiaevia Gene Engineering
ZOU Jing, MENG Jun, ZHANG Jiancai, GUO Shuo
(College of Food Science and Technology, Hebei Normal University of Science & Technology,Qinhuangdao Hebei,066600,China)
The galactose metabolism productivity is much lower than that of glucose inSaccharomycescerevisiae. An effective approach was undertaken to improve galactose utilization ability and ethanol productivity via deleting the negative regulated genes (GAL80,GAL6 andMIG1) that controlled the expression of theGALgenes. A resistance gene fragmentloxp-KanMX-loxpwas used repeatedly to knockout the negative regulated genesGAL80,GAL6 andMIG1, and seven engineered transformants were constructed. Compared with parent AY-5α, galactose metabolism rates increased in all seven engineered transformants. The galactose uptake rates and ethanol productivity ofΔgal80mig1 strain FY-501α reached as high as 0.916 g·(L·h)-1and 0.329 g·(L·h)-1, respectively, which increased 44.71% and 46.22% with the wild-type strain AY-5α. The glucose repression was also relieved in seven engineered strains. The consumption time in galactose-glucose mixture media of FY-501α was 66 h, with 42.11% down-off.GAL80 andMIG1 played more important roles in galactose fermentation ofSaccharomycescerevisiaethanGAL6 did.
GALgenes; galactose metabolism; glucose repression;MIG1;GAL80
10.3969/J.ISSN.1672-7983.2016.04.003
河北科技师范学院博士启动基金项目资助项目(项目编号:2013YB015)。
2016-12-05; 修改稿收到日期: 2016-12-19
S332.5
A
1672-7983(2016)04-0014-09
邹静(1979-),女,博士,讲师。主要研究方向:果酒微生物选育、果酒酿造以及工业微生物的基因工程改造。
*通讯作者,女,博士,讲师,主要研究方向:果酒微生物选育、果酒酿造以及工业微生物的基因工程改造。E-mail:zoujing520315@126.com。
