黑曲霉(CGMCC 3.316)β-葡萄糖苷酶酿造因子耐性分析
2016-04-05阎贺静齐兵兵赵琳琳
阎贺静,齐兵兵,赵琳琳,刘 畅
(1 河北科技师范学院,河北 秦皇岛,066600;2 国家粮食储备局武汉科学研究设计院)
黑曲霉(CGMCC 3.316)β-葡萄糖苷酶酿造因子耐性分析
阎贺静1*,齐兵兵1,赵琳琳2,刘 畅1
(1 河北科技师范学院,河北 秦皇岛,066600;2 国家粮食储备局武汉科学研究设计院)
为了确定黑曲霉(CGMCC 3.316)β-葡萄糖苷酶在葡萄酒增香中的应用潜力,考察了该酶对葡萄酒酿造温度、酒精的体积分数、pH值、糖的质量浓度及SO2的质量浓度等酿造因子的耐性。结果表明,该β-葡萄糖苷酶最适反应温度为60 ℃,酿造温度条件(20~30 ℃)下具有很高的耐性;少量的酒精对该酶有激活作用,酒精的体积分数大于0.08(酒精度大于8% vol)时耐性迅速降低;其最适反应pH值为4.55,酿造环境pH 3.4条件下活性较低,酸耐受性差;SO2的质量浓度低于40 mg/L时较稳定;该酶具有一定的葡萄糖耐受性。综合该酶对以上葡萄酒酿造因子的耐性,若用于葡萄酒的增香处理,建议处理时间控制在大约6~8 d。若要进一步提高葡萄酒增香效果,需提高该酶低温时的酶活性及其酸耐受性。
β-葡萄糖苷酶;酿造因子;耐性
β-葡萄糖苷酶(EC.3.2.1.21)是一种具有生物催化功能的蛋白质,全称β-D-葡萄糖苷水解酶,广泛存在于植物的种子和微生物当中[1]。β-葡萄糖苷酶可以水解葡萄中的键合态呈香物质,使原来不呈香的芳香物质以游离态存在并呈现出香气[2]。因此,β-葡萄糖苷酶用于葡萄酒增香处理,可以增加葡萄汁(酒)中芳香物质的种类和含量,从而可增加葡萄酒的香气,对于突出葡萄酒的品种香气至关重要,因此β-葡萄糖苷酶在葡萄酒增香领域的应用备受关注[3,4]。
通常,葡萄浆果和酵母均可以产生β-葡萄糖苷酶,但由于葡萄酒的酿造环境pH值低和温度低,而酒精的体积分数和糖的质量浓度较高,同时具有一定量的SO2,以上来源的β-葡萄糖苷酶的活性受到很大抑制,因此对葡萄酒的增香作用有限[5,6]。微生物来源的β-葡萄糖苷酶,一般具有较高的活性和良好的稳定性,目前已应用于葡萄酒增香[7]。据报道[8,9],真菌具有广泛的水解酶系,具有较高的β-葡萄糖苷酶分泌能力,尤其黑曲霉,不仅β-葡萄糖苷酶产酶能力高,且耐热性较高,在葡萄酒增香领域具有一定的应用潜力[11,12]。
本次研究通过分析黑曲霉(CGMCC 3.316)β-葡萄糖苷酶在不同酿造环境下的稳定性,以确定该β-葡萄糖苷酶的葡萄酒酿造因子耐性,探讨该酶用于葡萄酒增香的应用潜力。
1 材料与方法
1.1 实验材料和培养基
黑曲霉:河北科技师范学院食品科技学院保藏。
PDA培养基:琼脂糖15 g,蔗糖30 g,NaNO33 g,MgSO4·7H2O 0.5 g,KCl 0.5 g,FeSO4·4H2O 0.01 g,K2HPO41 g,蒸馏水1 L,pH6.0~6.5。
种子培养基:蔗糖30 g,NaNO33 g,MgSO4·7H2O 0.5 g,KCl 0.5 g,FeSO4·4H2O 0.01 g,K2HPO41 g,pH6.5,蒸馏水1 L。
基础发酵培养基:麸皮 30 g,CaCl20.3 g,MgSO40.3 g,K2HPO42.0 g,NaNO34.0 g,pH5.5;蒸馏水1 L。
1.2 实验方法
1.2.1 β-葡萄糖苷酶粗酶液制备 取一环PDA培养基中培养的黑曲霉溶于生理盐水,按10%的接种量接入种子培养基,30 ℃恒温振荡培养(150 r/min)60 h后,再按10%的接种量接入液体发酵培养基,30 ℃恒温培养(150 r/min)7 d,取发酵液5 000 r/min离心15 min,收集上清液,即为粗酶液,4 ℃保存备用[13]。
1.2.2 β-葡萄糖苷酶活性测定 取1 mL适当稀释的酶液,加入0.5 mL 质量浓度为5.0 g/L的水杨苷溶液(溶于0.1 mol/L,pH 4.8的醋酸缓冲液中),55 ℃反应20 min,加入1 mL 3,5-二硝基水杨酸(DNS)试剂,煮沸5 min,冷却,蒸馏水定容至10 mL,以加热灭活酶液为空白,于540 nm处测OD值。酶活定义:在上述条件下1 mL酶液1 min水解产生1 μmol葡萄糖的酶活力定义为1个单位(U)酶活[1]。
1.2.3 β-葡萄糖苷酶的最适反应温度和温度耐性分析 在不同温度下(45,50,55,60,65,70 ℃)按照1.2.2所示方法测定β-葡萄糖苷酶活性,确定其最适反应温度;将酶液分别置于常用葡萄酒酿造温度条件下(15,20,25,30 ℃)保温不同的时间(0,1,2,4,8,12,24 h)后,按照1.2.2所示方法测定残留酶活性,确定该酶的温度稳定性。
1.2.4 β-葡萄糖苷酶对酒精度的耐性分析 在1.2.2所示酶活性测定体系内,加入不同量的乙醇,测定不同体积分数的乙醇(0,0.05,0.10,0.12,0.15,0.20,0.25,0.30)条件下该β-葡萄糖苷酶活性;25 ℃条件下,将酶液保存于不同体积分数的酒精(0,0.04,0.08,0.12,0.16)溶液中,保存一定时间(0,2,4,6,8,12,24,48 h)后取样按照1.2.2所示方法测定残留酶活性,确定该酶对酒精度的耐性。
1.2.5 β-葡萄糖苷酶的最适pH值和pH耐性分析[14]在不同pH值条件下(3.45,4.08,4.55,4.80,5.13,5.57,5.90),按照1.2.2所示方法测定β-葡萄糖苷酶活性,确定其最适反应pH值;将酶液分别置于不同的pH值条件下(3.45,4.08,4.80),25 ℃保温不同时间(0,1,2,4,8,12,24 h)后,按照1.2.2所示方法测定残留酶活性,确定该酶的pH值稳定性。
1.2.6 SO2对β-葡萄糖苷酶活性的影响及其对SO2的耐性分析 将酶液分别置于不同质量浓度的SO2条件下(20,40,60,80,100 mg/L),25 ℃保温不同的时间(0,1,2,4,8,12,24,48 h)后,按照1.2.2所示方法测定残留酶活性,确定该酶对SO2的耐受性。
1.2.7 糖对β-葡萄糖苷酶活性的影响 在1.2.2所示酶活性测定体系内,加入不同质量的葡萄糖,然后测定不同质量浓度糖(0~200 g/L)条件下该酶活性,确定糖的质量浓度对该酶活性的影响。1.2.8 β-葡萄糖苷酶在模拟葡萄酒酿造环境中的稳定性 将β-葡萄糖苷酶置于SO2质量浓度40 mg/L,葡萄糖质量浓度200 g/L和乙醇的体积分数0.10,pH 3.6的溶液中,25 ℃温度条件下保存16 d,定时取样,按照1.2.2所示方法测定残留酶活性,以确定该酶在葡萄酒酿造环境中的稳定性。
2 结果与分析
2.1 黑曲霉β-葡萄糖苷酶对温度的耐性
该酶的最适反应温度为60 ℃,在20~30 ℃表现出较强的稳定性(图1)。20,25,30 ℃条件下保存24 h后,该酶残留酶活性分别为90.26%,88.05%,83.09%。由此可见,随着温度的升高该酶的稳定性降低。葡萄酒在酿造过程对发酵温度有要求,红葡萄酒的发酵温度为25~30 ℃,白葡萄酒的发酵温度为15~20 ℃。图1(a)数据显示,45 ℃时酶活为最适反应温度(60 ℃)酶活性的32.47%。由此表明,虽然低温条件下该酶非常稳定,但酶反应活性较低,葡萄酒的增香作用受到一定限制。但若葡萄酒酿造采用皮渣热浸提工艺(处理温度在大约60~80 ℃),此条件下该酶活性高,稳定性也较好,对于葡萄酒增香具有一定的应用潜力。
2.2 黑曲霉β-葡萄糖苷酶对酒精的耐性
少量酒精的存在会对β-葡萄糖苷酶有激活作用(图2(a)),这一结果与Riccardo等[15]的报道一致,可能是由于酒精作为底物催化水解过程中糖基阳离子的受体。该酶在酒精的体积分数较低范围内(酒精度0~4% vol)具有一定的稳定性,酒精的体积分数为0.04时(酒精度4% vol),25 ℃保存48 h后残留酶活性为65.37%(图2(b))。酒精的体积分数大于0.05时(酒精度大于5% vol),随酒精体积分数的升高及保存时间的延长,该酶的稳定性随之下降显著(图2(b))。在红白葡萄酒的酿造过程中,随着发酵的进行酒精的体积分数不断增加,一般酒精的体积分数最终会达到0.10~0.14(酒精度10%~14% vol)。以上结果表明,该黑曲霉β-葡萄糖苷酶在葡萄酒发酵的前期和中期对酒进行增香具有一定的潜力,在发酵的后期和贮酒阶段,由于酒精的体积分数较高会影响该酶的稳定性,从而影响其对酒的增香作用。因此,在葡萄酒发酵起始阶段添加β-葡萄糖苷酶可能会对葡萄酒起到一定的增香作用。

图1 温度对β-葡萄糖苷酶活性的影响
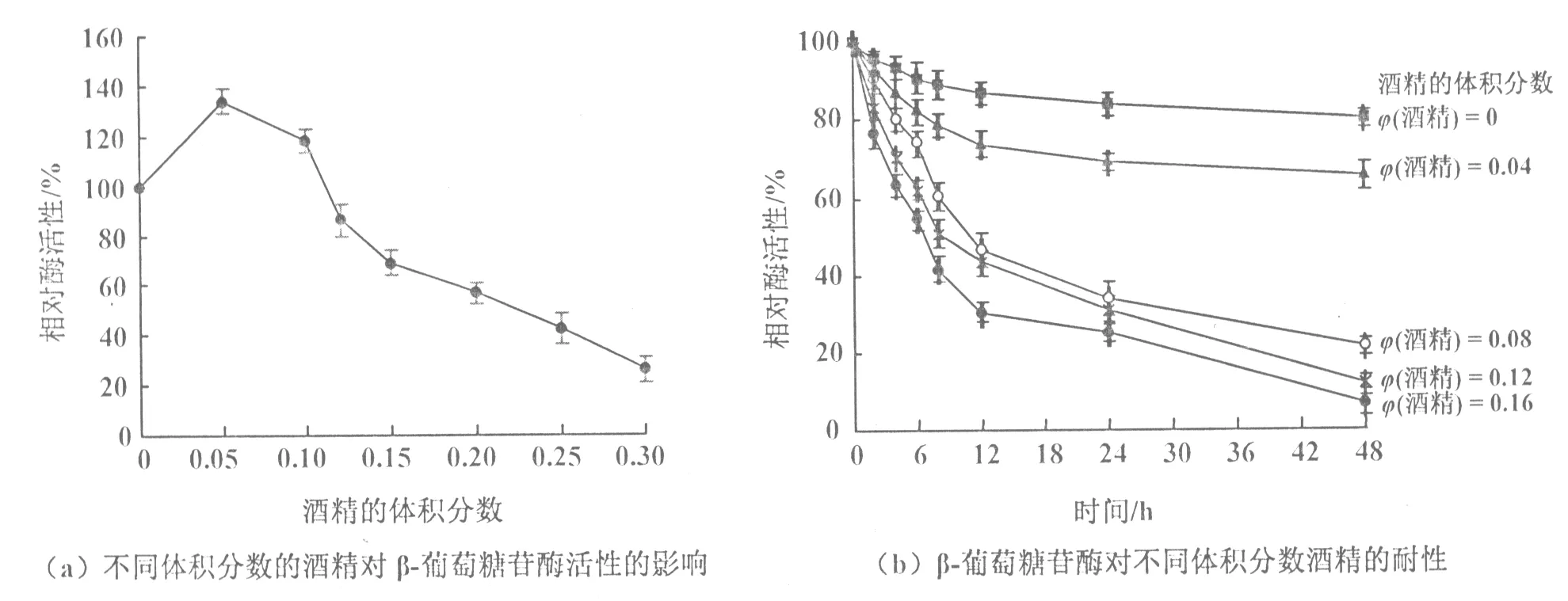
图2 不同体积分数的酒精对β-葡萄糖苷酶活性的影响
2.3 黑曲霉β-葡萄糖苷酶对pH值的耐性
不同pH值条件下该黑曲霉β-葡萄糖苷酶活性的测定结果表明(图3(a)),该酶的最适反应pH值为4.55。pH3.4条件下该酶活性为最高酶活性时的35.14%。25 ℃条件下,随pH值降低该酶的稳定性显著降低(图3(b)):pH 3.45,4.08,4.80分别保存12,24 h后,该酶的残留酶活性分别为20.50%,40.67%,64.60%,6.90%,15.43%,46.70%,表明该酶在较低的pH值条件下稳定性较差。通常在葡萄酒酿造过程中,葡萄汁的pH值一般低于3.6,因此该酶在葡萄酒酿造环境活性和稳定性受到不利影响,对葡萄酒的增香作用有限。若要增加该β-葡萄糖苷酶在葡萄酒发酵阶段的增香作用,应该筛选耐酸性高的β-葡萄糖苷酶,或进一步对该酶实施固定化增加其耐受性,以期达到更好的葡萄酒增香作用。

图3 不同pH值对β-葡萄糖苷酶活性的影响
2.4 黑曲霉β-葡萄糖苷酶对SO2的耐性
SO2的质量浓度低于40 mg/L时较为稳定。随SO2质量浓度的升高,酶稳定性降低(图4)。SO2的质量浓度为40 mg/L和60 mg/L时,保存48 h后残留酶活性分别为72.31%,42.70%,表明该酶对较低的SO2质量浓度具有一定的耐受力。葡萄酒原料含有杂菌,酿酒过程中常加入SO2来防腐杀菌和抗氧化。SO2的添加量受原料好坏程度的影响,原料无损害、无霉变、成熟度高、含酸量低时,红白葡萄酒需分别加入30~50,40~60 mg/L的SO2;葡萄原料无损害、无霉变、成熟度中、含酸量高时,红白葡萄酒需分别加入50~80,60~80 mg/L的SO2;葡萄原料破损、霉变时红白葡萄酒需加入80~100 mg/L的SO2。根据该酶的耐受程度,该酶适于葡萄原料比较好时的酿造条件。

图4 不同质量浓度的SO2对β-葡萄糖苷酶活性的影响
2.5 黑曲霉β-葡萄糖苷酶对糖的耐性
黑曲霉β-葡萄糖苷酶在不同质量浓度的葡萄糖条件下,其酶活性随葡萄糖质量浓度的增加而降低(图5)。当葡萄糖的质量浓度为160,180,200 g/L时,该酶活性分别为原酶活性的59.89%,53.13%和48.01%,表现出较好的糖耐受性。有文献报道[13,16],葡萄浆果和酿酒酵母均还有β-葡萄糖苷酶,但这些内源酶对葡萄酒酿造环境耐性低,对葡萄酒的增香作用不明显。微生物来源的β-葡萄糖苷酶对糖的耐受性较低,尤其是酵母来源的β-葡萄糖苷酶对糖的耐受性较低,不适合于葡萄酒的酿造环境[17,18],由此可见,该黑曲霉来源的β-葡萄糖苷酶糖耐受性相对较高,应用于葡萄酒增香领域具有一定的优势。

图5 不同质量浓度的糖对β-葡萄糖苷酶活性的影响
2.6 黑曲霉β-葡萄糖苷酶对模拟酿造环境的耐受性
在模拟葡萄酒酿造环境下,该黑曲霉β-葡萄糖苷酶稳定性的测定结果表明,该酶在葡萄酒酿造环境中具有一定的耐受性,保存2,4,6 d后残留酶活性分别为24.03%,18.93%,13.25%;保存10 d后残留酶活性为0。由此,若用于葡萄酒的增香处理,建议处理时间控制在大约6~8 d(图6)。
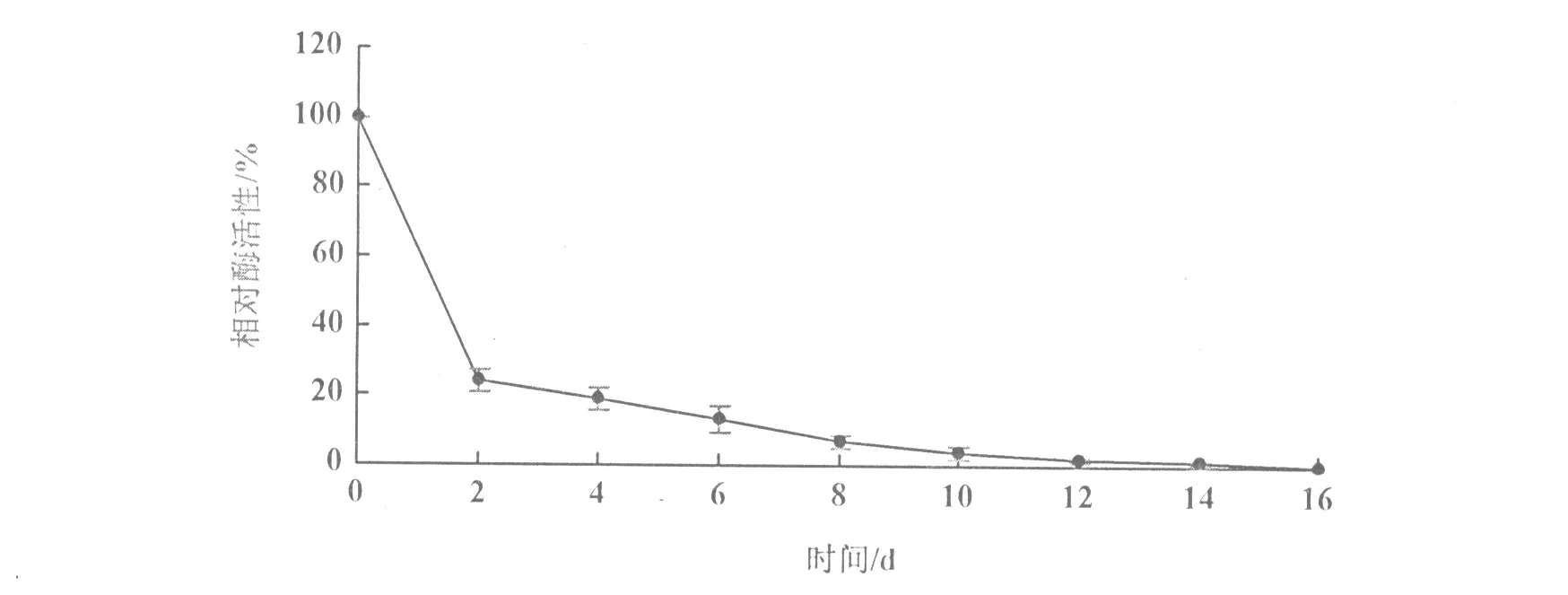
图6 黑曲霉β-葡萄糖苷酶在模拟酿造环境中的稳定性
3 讨论和结论
黑曲霉(CGMCC 3. 316)β-葡萄糖苷酶的最适反应温度为60 ℃,最适反应pH值为4.55,低温时(20~30 ℃)该酶表现出较强的稳定性,但反应活性较低,对葡萄酒增香不利;在葡萄酒酿造pH 3.4条件下酶活性较低,对酸的耐性较差,对葡萄酒增香不利;少量酒精对该β-葡萄糖苷酶有激活作用,在酒精的体积分数为0~0.04范围内(酒精度0~4%vol)具有较高的稳定性,稳定性随酒精的体积分数增加而下降,在酒精发酵前期用于葡萄酒增香较好;该β-葡萄糖苷酶在SO2的质量浓度低于40 mg/L时较为稳定,随SO2质量浓度的升高酶稳定性降低,适用于质量较好的葡萄原料;该酶表现出较好的糖耐受性。综合该酶在酿造环境中的耐受性,若用于葡萄酒的增香处理,建议处理时间控制在6~8 d。
[1] 侯晓瑞.甘肃河西走廊葡萄酒产区产β-葡萄糖苷酶酵母菌株的筛选[D].兰州:甘肃农业大学, 2014.
[2] 郭慧女,康文怀,徐岩,等.微生物β-D-葡萄糖苷酶对玫瑰香(Muscat)葡萄结合态香气物质的影响[J].食品工业科技,2011,32(1):81-84,88.
[3] 刘玥珊.葡萄果实糖苷酶活性、香气糖苷总量及其与成熟指标的关联分析[D].杨凌:西北农林科技大学, 2015.
[4] 问亚琴,崔婧,潘秋红.葡萄果实糖苷键合态萜烯物质的研究进展[J].园艺学报, 2012,39(9):1 679-1 686.
[5] 乔慧.葡萄酒中酒酒球菌分离鉴定及不同产区菌株糖苷酶活性研究[D].杨凌:西北农林科技大学, 2014.
[6] 桑苇,唐柯,徐岩,等.黑曲霉β-葡萄糖苷酶对葡萄酒酶解增香调控及香气物质的影响[J].食品与发酵工业,2015,41(5):8-13.
[7] 马腾.高产耐热β-葡萄糖苷酶的黑曲霉菌株选育及其基因克隆[D].秦皇岛: 河北科技师范学院,2012.
[8] Souza,F H M,Nascimento C V,Rosa J C,et al.Purification and biochemical characterization of a mycelial glucose- and xylose-stimulated β-glucosidase from the thermophilic fungusHumicolainsolens[J].Processbiochemistry,2010,45(2): 272-278.
[9] Hu H L,Brink J,Gruben B S,et al.Improved enzyme production by co-cultivation ofAspergillusnigerandAspergillusoryzaeand with other fungi[J].International Biodeterioration & Biodegradation,2011,65:248-252.
[10] 李丽阳,吴志军,葛文中,等.总状毛霉酶水解大豆异黄酮苷条件的优化[J].黑龙江八一农垦大学学报,2014,26(4):40-45.
[11] 高玉荣,徐国栋,李大鹏,等.富含游离态异黄酮豆豉的制曲工艺优化[J].黑龙江八一农垦大学学报,2015,27(2):57-61.
[12] 张杨,李莹,艾士奇,等.基于WSC-9 的人工组建的简化复合菌系的纤维素分解能力与酶活特性[J].黑龙江八一农垦大学学报,2016,28(2):80-84.
[13] Swangkeaw J,Vichitphan S,Butzke C E,et al.Characterization of β-glucosidases fromHanseniasporasp.andPichiaanomalawith potentially aroma-enhancing capabilities in juice and wine[J].World Microbiol Biotechnol, 2011,27(10):423-430.
[14] 杨芮.葡萄酒乳酸菌中β-葡萄糖苷酶性质研究[D].杨凌:西北农林科技大学,2013.
[15] Barbagallo R N,Spagna G,Palmeri R,et al.Selection,characterization and comparison of β-glucosidase from mould and yeasts employable for enological applications[J].Enzyme and Microbial Technology,2004,35(1):58-66.
[16] Wang Y,Kang W,Xu Y,et al.Effect of different indigenous yeast β-glucosidases on the liberation of bound aroma compounds[J].Journal of the Institute of Brewing,2012,117(2):230-237.
[17] Leite R S R,Alves-Prado H F,Cabral H,et al.Production and characteristics comparison of crude β-glucosidases produced by microorganisms Thermoascus aurantiacus e Aureobasidium pullulans in agricultural wastes[J].Enzyme Microb Technol,2008,43(6):391-395.
[18] Swangkeaw J,Vichitphan S,Butzke C E,et al.The characterisation of a novelPichiaanomalaβ-glucosidase with potentially aroma-enhancing capabilities in wine[J].Ann Microbiol,2009,59(2):335-343.
(责任编辑:朱宝昌)
Stabilities of β-glucosidases from Aspergillus niger (CGMCC 3.316) in Wine Brewing Conditions
YAN Hejing1, QI Bingbing1, ZHAO Linlin2, LIU Chang1
(1 Hebei Normal University of Science & Technology, Qinhuangdao Hebei, 066600; 2 Wuhan Scientific Research & Design Institute, State Administration for Grain Reservation, Wuhan, Hubei, 430079; China)
In order to evaluate the application potentiality ofAspergillusniger(CGMCC 3.316) β-glucosidases in wine aroma enhancing, the stabilities of the enzyme on the brewing temperature, alcohol content, sugar content and SO2content were studied in this test. The results indicated that 60 ℃ was the optimal temperature for the enzyme, meanwhile it expressed very stable in brewing temperature (20~30 ℃). A small content of alcohol could activate the enzyme activity, but the activity was greatly inhibited when the alcohol content overpassed 8% or more. pH4.55 would be the optimal for the enzyme, while its activity might be lower at brewing pH3.4 and it displayed unstable in such acidic condition. The enzyme was stable when the SO2content lowed 40 mg/L. The enzyme also showed some stability in the presents of different contents of sugar. Based on the above studies, 6~8 days treatment of the enzyme would be recommended when used in wine-making process. In addition, some engineering techniques could be employed to increase the enzyme activity in low temperature and its stability in acidic condition so as to enhance wine aroma.
Aspergillusniger; β-glucosidase; brewing factor; stability
10.3969/J.ISSN.1672-7983.2016.04.002
河北科技师范学院2013年博士科研启动基金项目;河北省教育厅项目(项目编号:QN2014143);秦皇岛市科学技术研究与发展计划项目(项目编号:201101A176)。
2016-10-17; 修改稿收到日期: 2016-11-23
TS262.6
A
1672-7983(2016)04-0008-06
阎贺静(1978-),女,博士,副教授。主要研究方向:酿造微生物。
*通讯作者,女,博士,副教授。主要研究方向:酿造微生物。E-mail: yhj2203yhj@163.com。
