苏子油干预血管内皮细胞miR-21靶向调控MMP-9的机制
2016-04-05黄楦槟陈金水吴天敏陈金雄
黄楦槟,陈金水,吴天敏,陈金雄
(福建医科大学附属第一医院中医科,福建福州 350005)
◇中医药研究◇
苏子油干预血管内皮细胞miR-21靶向调控MMP-9的机制
黄楦槟,陈金水,吴天敏,陈金雄
(福建医科大学附属第一医院中医科,福建福州 350005)
目的 探讨不同浓度苏子油干预人脐静脉血管内皮细胞(HUVEC) miR-21和基质金属蛋白酶MMP-9的表达,为苏子油改善动脉粥样硬化提供依据。方法 体外培养HUVEC,以TNF-α诱导细胞进行造模,将细胞分为空白组、模型组及苏子油高、中、低剂量组。MMT法检测各组细胞A值;PT-PCR检测细胞miR-21、MMP-9基因水平;脂质体转染法将miR-21模拟物转入HUVEC细胞,Western blot检测转染后MMP-9蛋白的表达。结果 苏子油高、中、低剂量能明显改善TNF-α诱导的HUVEC损伤,且苏子油对内皮细胞的保护作用呈剂量依赖关系;RT-PCR结果显示,模型组miR-21及MMP-9的表达高,苏子油干预后,miR-21及MMP-9基因的表达逐渐减弱,且二者分别与模型组比较,差异有统计学意义(P<0.05);细胞转染miR-21后,MMP-9蛋白的表达显著增强;miR-21与MMP-9 mRNA 3′UTR区经生物信息学软件预测存在靶向结合位点。结论 苏子油可能通过干预miR-21靶向调控MMP-9的表达对血管内皮细胞发挥保护作用,从而发挥抗动脉粥样硬化作用。
苏子油;微小RNA-21;基质金属蛋白酶-9;靶向调控;抗动脉粥样硬化
动脉粥样硬化(atherosclerosis, AS)是众多心脑血管疾病共同的病理基础,也是心血管系统疾病中最常见的疾病,严重危害人类健康[1]。血管内皮细胞( vascularendothelial cell, VEC)功能失调和损伤是AS形成的始动环节,会继发脂质斑块沉积、血管内膜增生、免疫细胞浸润等事件[2]。细胞外基质金属蛋白酶-9(matrix metalloproteinase 9, MMP-9)是介导动脉粥样硬化发病的一种重要炎症介质,高表达的MMP-9可促进动脉粥样硬化形成以及斑块破裂[3]。miRNA通过靶向作用于mRNA的3′UTR区域,引起mRNA的翻译抑制或降解[4],从而在转录后水平上抑制靶基因的表达,血管内皮细胞中存在miR-21的表达,当内皮损伤时,miR-21的表达发生改变,并通过mRNA剪切和抑制蛋白翻译的方式负调控靶基因的表达[5]。苏子油是从唇形科紫苏属植物苏子(Perillafrutescens(L.) Britt.)中提取的一种富含α-亚麻酸的植物油,其含量超过60%。苏子油具有明显的调血脂作用,还能降低血小板花生四稀酸水平和血栓素TXA2生成,减弱血小板凝集活性,起到抗血栓作用,对防治动脉粥样硬化具有重要意义[6]。基于以上背景,本课题通过检测TNF-α诱导血管内皮细胞miR-21和MMP-9的表达,以及二者的靶向关系,阐释苏子油保护血管、抗AS的作用。
1 材料与方法
1.1 实验动物与药物
Wistar大鼠30只,雄性,180~220 g,购于福建医科大学附属第一医院实验动物中心。苏子油制剂采用苏子油软胶囊(福州三爱药业有限公司,国药准字Z20070052),以41.3 mmol/L羧甲基纤维素钠液配成所需浓度的乳液,备用。
1.2 细胞来源与主要试剂
人脐静脉血管内皮细胞(HUVEC)株购自上海拜力生物有限公司;EGM-2培养基(Lonza);标准胎牛血清(兰州民海);胰蛋白酶(Biosharp公司);二甲基亚砜(DMSO,Sigma公司);MMP-9引物(上海生工);miR-21模拟物、阴性对照(上海吉玛);RNAiso Plus、RT-PCR试剂盒、SYBR GreenI RT-PCR试剂盒(TaKaRa);TNF-α(R﹠D公司);DNA Marker DLiOO(碧云天生物技术有限公司);ECL Plus Western Blotting Detection System(GE Healthcare公司,美国);Trizol试剂(Invitrogen公司);鼠抗人MMP-9单克隆抗体、鼠抗GAPDH一抗(Gilbertsville, PA);考马斯亮兰、羊抗小鼠辣根过氧化物酶HRP标记二抗(北京中杉)。
1.3 主要仪器
倒置显微镜(日本OLYMPUS);CO2培养箱(日本SANYO公司);超净工作台(苏净安泰);UVP凝胶成像仪(UVP公司);垂直电泳仪及转膜仪(北京六一);荧光定量PCR仪LightCycler480 System(Roche公司);S3006L型高压匀质机(Niro Soavi公司);细胞计数板(武汉成龙科贸有限公司);Realtime PCR扩增仪(美国)。
1.4 苏子油含药血清的制备
健康雄性大鼠12只,其中6只,使用苏子油软胶囊(0.028 g/mL)灌胃,每次给药容积15 mL/kg,2次/d,连续10 d,末次给药后1 h经腹主动脉采血,室温放置2 h,3 000 r/min离心10 min,分离血清,56 ℃灭活30 min,经0.45 μm微孔滤器过滤除菌,置于冰箱-20 ℃冷冻备用。另取雄性SD大鼠6只,以等体积等渗盐水灌胃,所取血清作为对照使用。
1.5 细胞培养
内皮细胞株HUVEC从液氮灌中取出,迅速投入37 ℃超纯水中解冻,转移至离心管中,加4 mL DMEM高糖培养基,离心1 000 r/min×3 min,弃去上清,用完全培养液(含100 mL/L胎牛血清、100 IU/mL青霉素、100 IU/mL链霉素的DMEM)接种于培养瓶中,置于37 ℃、50 mL/L CO2条件下培养,24 h换液,弃去没贴壁的细胞。待细胞长满至约80%时,传代。在显微镜下观察细胞形态,并拍照。
1.5.1 MTT法检测苏子油对TNF-α诱导的HUVEC细胞活力的影响 将处于对数生长期的细胞接种于96孔板中,以200 U/mL的TNF-α对细胞进行造模[7],实验分为空白组、模型组及苏子油高、中、低剂量组。空白组细胞以常规培养的细胞;模型组细胞以TNF-α的EGM-2培养基培养12 h;低剂量组使用50 mL/L含药血清(50 mL/L为含药血清在培养基内的血清稀释浓度)预先处理HUVEC 6 h,加入200 U/mL的TNF-α培养HUVEC 12 h;中剂量组使用100 mL/L含药血清(100 mL/L为含药血清在培养基内的血清稀释浓度)预先处理HUVEC 6 h,加入200 U/mL的TNF-α培养HUVEC 12 h;高剂量组使用200 mL/L含药血清(200 mL/L为含药血清在培养基内的血清稀释浓度)预先处理HUVEC 6 h,200 U/mL的TNF-α培养HUVEC 12 h。干预完成后,每孔加入20 μL质量浓度为5 mg/mL的MTT,继续孵育,4 h后每孔加入150 mL的DMSO,用酶标仪于490 nm波长处测定吸光度(A)值,记录结果。
1.5.2 RT-PCR检测miR-21和MMP-9的表达 培养即分组方法如1.5.1,每组12个复孔,将同一组别的细胞收集至同一EP管中,以Trizol溶液提取总RNA。使用SYBR®Premix ExTaqTMⅡ试剂盒进行实时荧光定量PCR反应,以mRNA为模板,Random为引物,1 μg RNA逆转录酶合成cDNA,cDNA连同特异性引物的最终浓度为1×SYBRGreen,1×Ampli-taqPCR buffer,3 mmol/L MgCl2,dNTPs(200 μm/L),引物0.9 μm(上游和下游),25 μL H2O中Ampli-taqGold DNA聚合酶1.25单位,内参β-actin的反应体系和条件同上。反应条件:在95 ℃ 20 s解链后,95 ℃ 5 s,53 ℃ 20 s,进行45个循环[8]。检测miR-21和MMP-9表达水平。
依据MMP-9基因的cDNA片段(NC_005102.4),设计两段与模板两端互补的寡核苷酸序列,根据所要连接的载体上的限制性酶切位点设计下游引物,在上下游引物的5′端和3′端各加一段酶切位点。引物由上海生工公司合成。MMP-9具体的序列为:上游:5′-AATCTCACCGACAGGCAGCT-3′,下游:5′-CCAAACTGG ATGACGATGTC-3′。内参具体的序列为:上游:5′-TGGCACCCAGCACAATGAA-3′,下游:5′-CTAAGTCATAGTCCGCCTAGAAGCA-3′。
1.5.3 细胞转染建立miR-21高表达细胞株 以5×105细胞/孔接种24孔板培养24 h。按照说明书应用LipofectamineTM 2000接种浓度为50 nmol/L的miR-21模拟物。操作如下:将0.8 μg DNA稀释于50 μL无血清无抗生素的培养液中轻轻浑匀。将2 μL Lipofectamine2000稀释于50 μL无血清无抗生素的培养液中,轻轻混匀,室温孵育5 min。5 min后将细胞混合,并轻轻混匀,室温孵育20 min。吸去培养基,用PBS清洗细胞2次。将100 μL的复合物加入培养孔,前后摇动培养板使其分布均匀,孵育4~6 h后,更换成DMEM完全培养基。转染的同时,掺入少量的GFP空质粒,转染24 h后观察转染效率,并拍照,荧光显微镜下观察,转染效率较高,达到80%。稳定转染:换含血清培养基24 h后将细胞以1∶10传代。
利用脂质体转染法将miR-21模拟物和阴性对照转入HUVEC细胞。将实验分成空白组、阴性对照组和模拟组。空白组细胞给予常规培养,阴性对照组为转染相应对照的细胞,模拟组为miR-21模拟物转染的细胞,每组7个复孔。24 h后,弃上清,消化,将同一组别的细胞悬液收集至同一EP管中,离心、收集细胞沉淀,备用。
1.6 Western blot检测转染后MMP-9蛋白的表达
收集各组细胞加入50 mmol/L裂解液(Tris pH=7.5,1 mmol/L EDTA中,50 mmol/L NaCl,77.2 mmol/L Triton-X-100),持续振摇30 min,4 ℃ 2 000 r/min离心20 min,将上清液转移至另外EP管中,4 ℃ 18 000 r/min离心45 min,保存上清液,考马斯亮兰测定蛋白质浓度,样品以上样缓冲液稀释后煮沸5 min使蛋白变性,备用。灌制80 g/L SDS-PAGE凝胶,取已制备好的细胞蛋白,每孔上样量50 μL,在80 V稳压电场中电泳,电泳后用250 mA电流将蛋白置于纤维素滤膜上,脱脂奶粉封闭过夜,剪膜,根据分子量分开后分别以加入PBS缓冲液按1∶1 000稀释的一抗(MMP-9)室温孵育1 h,洗膜3次,将膜与以1∶500稀释的HRP标记二抗共同孵育1 h后洗膜,暗室中X光片曝光,Gel-analyze分析软件分析条带灰度,进行半定量比较分析。
1.7 统计学分析
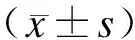
2 结 果
2.1 细胞形态学观察
HUVEC细胞轮廓清晰,呈长多角形、多角形或薄椭圆形,形态不一,胞质丰富且清亮,可见少量空泡颗粒,细胞融合成单层,贴壁生长,“铺路石样”结构明显(图1A);进入对数生长期后,增殖加快,排列紧密。TNF-α诱导后的细胞贴壁不稳,呈鹅卵石样排列,细胞有皱缩、不规则,胞质空泡颗粒增多(图1B)。苏子油干预后细胞形态清晰,细胞量多,空泡颗粒明显减少(图1C)。

图1 各组HUVEC细胞的形态学变化
Fig.1 Morphological observation of HUVEC cells in each group (×100)
A:正常细胞;B:TNF-α诱导后的细胞;C:苏子油高剂量组干预后的细胞。
2.2 苏子油对TNF-α诱导的HUVEC细胞活力的影响
与空白组比较,模型组A值显著降低(P<0.01),苏子油干预组与模型组比较A值均显著升高(P<0.01),但低于空白组(P<0.05);且各苏子油组的A值随着苏子油剂量的升高而升高,说明苏子油对内皮细胞的保护呈剂量依赖关系(表1)。
表1 苏子油对TNF-α诱导的HUVEC细胞活力的影响
Tab.1 Effect of Perilla oil on viability of HUVEC cells induced by TNF-α


组别给药剂量(μg/mL)A490空白组-0.867±0.113模型组-0.429±0.057**苏子油高剂量组0.40.711±0.081*△△苏子油中剂量组0.20.683±0.062*△苏子油低剂量组0.10.603±0.044*△
与空白组比较,*P<0.05,**P<0.01;与模型组比较:△P<0.05,△△P<0.01。
2.3 HUVEC细胞miR-21、MMP-9基因的表达
采用RT-PCR法检测miR-21、MMP-9基因表达,结果显示,模型组miR-21及MMP-9的表达均高,苏子油干预后,miR-21及MMP-9基因的表达逐渐减弱,且二者分别与模型组比较,差异有统计学意义(P<0.05,表2、图2)。
表2 苏子油对miR-21、MMP-9基因表达的影响
Tab.2 Effect of Perilla oil on miR-21 and MMP-9 gene expressions
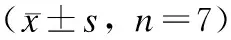
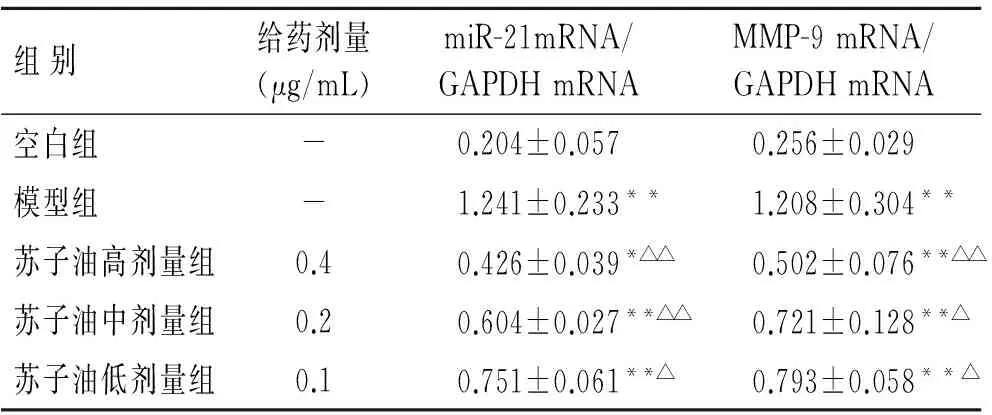
组别给药剂量(μg/mL)miR-21mRNA/GAPDHmRNAMMP-9mRNA/GAPDHmRNA空白组-0.204±0.0570.256±0.029模型组-1.241±0.233**1.208±0.304**苏子油高剂量组0.40.426±0.039*△△0.502±0.076**△△苏子油中剂量组0.20.604±0.027**△△0.721±0.128**△苏子油低剂量组0.10.751±0.061**△0.793±0.058**△
与空白组比较,*P<0.05,**P<0.01;与模型组比较,△P<0.05,△△P<0.01。

图2 各组miR-21、MMP-9基因的表达
Fig.2 The expressions of miR-21 and MMP-9 gene
A:空白组;B:模型组;C、D、E:苏子油高、中、低剂量组。
2.4 转染后MMP-9蛋白的表达
Western Blot结果表明,HUVEC细胞转染miR-21模拟物后,模拟组MMP-9蛋白的表达显著增高,与阴性对照组比较,差异有统计学意义(P<0.01),空白组与阴性对照组比较无差异(图3)。

图3 Western Blot检测转染后MMP-9的表达
Fig.3 The expression of MMP-9 after transfection detected by Western blot
2.5 靶向结合位点 ST利用targetscan(http://www.targt tscan.org)生物信息学软件预测miR-21与MMP-9 mRNA 3′UTR区的靶向结合作用,结果显示,MMP-9 mRNA 3′UTR区与miR-21存在靶向结合位点。
3 讨 论
动脉粥样硬化的发生是多层次的多种因素和细胞成分间相互影响的瀑布式的发展过程,其中心环节是血管内皮受损[9]。内皮由于各种原因(机械因素、Ox-LDL、毒素)受损时可分泌单核细胞趋化因子,使单核细胞黏附于受损的内皮细胞,两种细胞膜的直接接触可能刺激血管内皮细胞分泌基质金属蛋白酶(MMPs),同时还可释放大量的细胞因子,如白介素-1(IL-1)、肿瘤坏死因子-α(TNF-α)等。这些因子通过自分泌或旁分泌也可刺激血管内皮细胞表达MMPs,促使内皮屏障功能进一步降低[10]。因此,细胞因子和MMPs与动脉粥样硬化的形成有重要的内在联系。基于此,本实验体外培养HUVEC,以TNF-α对细胞进行造模,从miR-21及其靶向基因MMP-9的表达水平分析苏子油对细胞的保护作用。
本实验结果显示,TNF-α对HUVEC进行造模后,细胞形态发生明显变化,贴壁不稳,细胞变短变圆,细胞有皱缩、不规则,胞质空泡颗粒增多,细胞A值较空白组显著下降,说明以TNF-α建立细胞损伤模型成功;而以苏子油含药血清干预后,细胞状态明显改善,细胞增殖明显,排列整齐,胞质空泡颗粒减少,且各苏子油组的A值随剂量的升高而升高,说明苏子油能对损伤模型的HUVEC产生保护作用,并呈剂量依赖关系。
MMP-9的主要生物学功能是参与细胞外基质(extracellular matrix, ECM)的降解及重构。ECM是血管壁的主要成分,也构成了粥样斑块的纤维帽部分,ECM的重构是参与形成AS的重要过程[11]。在AS发生过程中,损伤部位活化 MMP-9[12-13],降解ECM,促进血管平滑肌细胞增殖和移行,在AS的发生、发展及斑块破裂过程中发挥着重要作用;同时发现AS斑块内MMP-9表达水平越高,被检出微栓子的阳性率越高[14]。microRNA(miRNA)是非常保守的内源性非编码单链小RNA分子,广泛存在于哺乳动物体内,长度约为21~23 nt,能够与靶mRNA的3′UTR碱基配对[15]。miR-21在血管细胞中有丰富表达,并且在修复损伤血管中表达上调,促进新生内膜的形成[16]。在本实验中,TNF-α对HUVEC进行造模后,模型组miR-21及MMP-9高表达,说明TNF-α造成细胞损伤,刺激细胞合成和分泌MMP-9;不同剂量的苏子油干预后,miR-21的表达随剂量增大逐渐减弱,而MMP-9基因的表达也随剂量增大逐渐减弱,推测苏子油通过抑制miR-21表达,降低MMP-9表达对血管内皮细胞发挥保护作用。进一步对miR-21与MMP-9是否存在靶向关系的研究发现,细胞经miR-21模拟物转染后,模拟组MMP-9蛋白的表达较阴性对照组显著增高。miR-21与MMP-9 mRNA 3′UTR区通过生物信息学软件预测,结果显示MMP-9 mRNA 3′UTR区与miR-21存在靶向结合位点。
如上所示,苏子油干预后,miR-21及MMP-9的表达显著降低,与转染结果一致,说明苏子油通过干预miR-21靶向调控MMP-9的表达对血管内皮细胞发挥保护作用。
[1] 周文阳. 三七皂苷对内皮细胞MMP-活性、巨噬细胞炎症因子表达及血小板凝集抑制作用的实验研究[D]. 中国医科大学, 2012.
[2] 陈君君. MicroRNA-21在ox-LDL诱导的血管内皮细胞中的功能及丹皮酚的干预作用[D]. 安徽中医药大学,2013.
[3] 袁梅. MMP-9基因3’UTR多态性与动脉粥样硬化性脑梗死相关性及miRNA-491介导的多态调控机制研究[D]. 中南大学湘雅学院,2012.
[4] GHODKE Y, CHOPRA A, SHINTRE P, et al. Profiling single nucleotide polymorphisms (SNPs) across intracellular folate metabolic pathway in healthy Indians[J]. Indian J Med Res, 2011, 133(3):274-279.
[5] 熊雁. 血管内皮细胞microRNA-21在高糖环境及冠心病病人中表达的差异及其功能研究[D]. 遵义医学院, 2012.
[6] 李英霞,张岩. 苏子油复方制剂对高脂血症模型大鼠血栓素B2和6-酮-前列腺素F1A的影响[J]. 中医药导报, 2007, 13(9):17-18.
[7] 于晓红,王小明,李瑶,等. NADHP氧化酶在TNF-α诱导HUVEC HO-1表达中的作用[J]. 基础医学与临床,2006, 26(5):461-465.
[8] 赵峰. miR-335与胃癌侵袭转移的相关性及其机制的研究[D]. 中国医科大学,2012.
[9] 姚义安,张抒扬. 内皮细胞与动脉粥样硬化[J]. 中华内科杂志,2008, (1):63-64.
[10] 孙恕. 他汀类干预血管内皮细胞基质金属蛋白酶-1的表达[D]. 江西医学院,2004.
[11] 鲁其良,毕立志,乔涛. 阿托伐他汀对急性冠脉综合征患者血清基质金属蛋白酶-9及其组织抑制因子-1的影响[J]. 中国基层医药, 2010, 17(19):2653-2654.
[12] 杨春海,代全德,张建平,等. 依那普利对肾性高血压大鼠脑缺血再灌注后脑组织基质金属蛋白酶-2、-9表达的影响[J]. 中国基层医药, 2010, 17(15):2081-2083.
[13] 李毅,孙瑞红,肖玲,等. MMP-9及NF-κB对人颅内动脉粥样硬化斑块稳定性的影响[J]. 中风与神经疾病杂志, 2009, 26(4):396-398.
[14] 张天. MMP-9、TIMP-1、CD147在人粥样硬化冠状动脉中表达的相关性研究[D]. 大连医科大学,2012.
[15] 张政. MicroRNA靶向PTEN/PI3K信号途径调控早期糖尿病肾病的研究[D]. 重庆医科大学,2009.
[16] 王子栋. miR-21在大鼠血管平滑肌细胞中对MMP2、MMP9表达的影响[D]. 哈尔滨医科大学,2012.
(编辑 卓选鹏)
Mechanism of Perilla oil’s intervention in vascular endothelial cell miR-21 targeted regulation of MMP-9
HUANG Xuan-bin, CHEN Jin-shui, WU Tian-min, CHEN Jin-xiong
(Department of Traditional Chinese Medicine, the First Affiliated Hospital of Fujian Medical University, Fuzhou 350005, China)
Objective To explore the intervention of different concentrations of Perilla oil in miR-21 and matrix metalloproteinase 9 (MMP-9) expressions of human umbilical vein endothelial cells (HUVECs) to provide the basis for Perilla oil’s improvement of atherosclerosis. MethodsInvitroumbilical vein endothelial cells were induced by TNF-α, and then divided into blank group, model group as well as Perilla oil high-, medium- and low-dose groups. A value was detected by MMT method, and gene levels of cell miR-21 and MMP-9 were detected by PT-PCR. Liposome transfection method was used to put the miR-21 analog into HUVEC cells; the expression of MMP-9 protein after transfection was detected by Western blot. Results Perilla oil of three doses could obviously improve HUVEC injury induced by TNF-α, and Perilla oil’s protection of endothelial cells was dose-dependent. miR-21 and MMP-9 gene expressions detected by RT-PCR showed that both of them were higher in model group. After Perilla oil intervention, the expression of miR-21 and MMP-9 gene gradually decreased with the dose of Perilla oil, both of which differed significantly from those in model group (P<0.05). After cell transfection of miR-21, the expression MMP-9 protein was significantly increased. MiR-21 and MMP-9 mRNA 3’UTR region detected by bioinformatics software could predict target binding site. Conclusion Perilla oil can protect vascular endothelial cells by intervening in miR-21’s regulation of MMP-9 expression, thus having anti-atherosclerosis effect.
Perilla oil; miR-21; MMP-9; targeted control; anti-atherosclerosis
2015-05-07
2015-07-20
福建省中医药科技项目(No.wzzy201316) Supported by the Science and Technology Project of Fujian Province (No.wzzy201316)
黄楦槟. E-mail: hxb2138@sina.com
R543.5
A
10.7652/jdyxb201601024
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20151209.1719.024.html(2015-12-09)
