NRP-1在胃癌组织及细胞系中的表达及临床意义
2016-04-05周培华王孝珑陈南征李孝彬孙学军
张 立,张 迪,周培华,王孝珑,王 炜,陈南征,李孝彬,孙学军
(西安交通大学:1. 第二附属医院普通外科,陕西西安 710004;2. 第一附属医院普通外科,陕西西安 710061)
NRP-1在胃癌组织及细胞系中的表达及临床意义
张 立1,张 迪1,周培华2,王孝珑2,王 炜2,陈南征2,李孝彬2,孙学军2
(西安交通大学:1. 第二附属医院普通外科,陕西西安 710004;2. 第一附属医院普通外科,陕西西安 710061)
目的 研究神经纤毛蛋白1(NRP-1)在胃癌组织的表达,探讨其与胃癌发生、发展及临床病理因素的关系及可能的临床意义。方法 应用免疫组织化学染色检测180例胃癌患者的胃癌组织及癌旁组织标本NRP-1表达,用免疫印迹方法检测胃癌组织及不同分化程度的胃癌细胞NRP-1表达,K-M生存曲线和多因素回归模型用于分析胃癌预后。结果 胃癌组织中NRP-1表达水平明显高于癌旁组织(P<0.001),胃癌组织中NRP-1高表达与肿瘤分化程度、淋巴结转移、AJCC分期、T分期呈正相关(P<0.05)。多因素生存分析表明高表达NRP-1是胃癌患者总生存期的独立预后因子。结论 过表达NRP-1可能在胃癌进展中发挥着重要作用,过表达NRP-1可作为生物标志物预测胃癌患者的不良预后。
神经纤毛蛋白-1(NRP-1);胃癌;免疫组织化学;免疫印迹;生存曲线;多因素回归模型
胃癌发病率在世界范围内排列第五位,其死亡率在肿瘤相关疾病中居第三位,严重危害人类健康[1]。而胃癌患者半数分布在中国等东亚国家,中国胃癌的发病率和死亡率在所有肿瘤中排列第三位[2]。手术切除是治疗胃癌的主要手段。但由于胃癌具有高增殖和高转移的特点,患者就诊时多已经处于晚期,5年生存率仅为28%[3]。尽管已经广泛应用传统的临床病理因素如胃癌的分级、分期、淋巴结转移等预测胃癌术后的复发转移,但是,在术前早期预测胃癌的生存预后,探索新的生物标志物以指导临床治疗则迫在眉睫。
神经纤毛蛋白1(neuropilin-1, NRP-1)是一种跨膜糖蛋白受体,表达于内皮细胞、树突细胞、某些正常和肿瘤细胞表面[4-6]。最近研究发现不仅NRP-1在多种肿瘤细胞表达,而且NRP-1的异常表达还与许多肿瘤的恶性发展和不良预后密切相关,其中包括膀胱癌、皮肤鳞癌、结直肠癌、胰腺癌、非小细胞肺癌、骨肉瘤等[7-12]。尽管NRP-1在胃癌细胞系中已有研究,如MicroRNA-338通过下调NRP-1的表达,抑制胃癌细胞生物学功能[13],AKAGI等[14]发现表皮生长因子受体(EGFR)的激活调控胃癌血管生成过程涉及到NRP-1调节机制,但是NRP-1的表达与胃癌临床病理联系和预后关系,目前尚未明确报道。本研究通过检测NRP-1在胃癌组织、癌旁组织以及不同分化的胃癌细胞系的表达,初步探讨胃癌组织中NRP-1的表达与患者临床病理因素和预后的相关性。
1 材料与方法
1.1 组织标本
180例胃腺癌组织标本取自2009年1月至2011年12月在西安交通大学第二附属医院普通外科行手术切除的胃癌组织及癌旁组织(规定距癌组织2 cm以上),所有标本分为两部分,分别保存于液氮或40 g/L多聚甲醛固定,后常规石蜡包埋,切片保存。
所有标本均经术后病理证实,术前均未接受抗肿瘤治疗。其中,男118例,女62例,年龄60岁及以上101例,60岁以下79例。肿瘤原发部位上1/3部(U区)32例,中1/3部(M区)98例,下1/3部(L区)50例;肿瘤直径<3 cm者82例,≥3 cm者98例;高分化癌26例,中分化癌62例,低分化癌92例;有淋巴结转移者124例,无淋巴结转移者56例;Lauren分型肠型109例,弥漫型71例;淋巴结切除数目25个以下67例,25个以上113例;采用美国癌症联合会(AJCC)制定的第7版胃癌TNM分期:Ⅰ期63例,Ⅱ期49例,Ⅲ期60例,Ⅳ期8例。本实验经西安交通大学第二附属医院伦理委员会批准,严格遵照《赫尔辛斯基宣言》医学伦理道德准则实施,与所有患者或家属进行充分沟通并签署试验知情同意书。
1.2 细胞株及细胞培养
胃癌细胞系N87、SGC7901、AGS、HGC27购置于中国科学院上海细胞库。HGC27细胞培养于DMEM细胞培养液(Gibco,含2 mmol/L L-谷氨酰胺、100 mL/L血清、100 U/mL青霉素、100 U/mL链霉素)中。3株细胞N87、SGC7901、AGS培养在RPMI 1640细胞培养液中(均加入100 mL/L胎牛血清)。将对数生长的细胞悬液均匀地分布于25 cm×25 cm细胞培养瓶中,其中含5 mL培养液,细胞密度为5×104个/mL,每周传代2次,置于37 ℃、50 mL/L CO2孵箱中培养。
1.3 免疫组织化学检测
切片经二甲苯脱蜡、梯度乙醇水化后进行抗原修复、封闭内源性过氧化物酶及正常山羊血清封闭抗原,依据试剂说明滴加稀释后(1∶100稀释)兔抗人NRP-1单克隆抗体(北京中杉金桥公司)4 ℃冰箱过夜,湿盒室温复温1 h后滴加生物素标记二抗,37 ℃孵育30 min,PBS冲洗后DAB显色,苏木紫衬染,重新脱水透明,封片,显微镜下观察。所有染色采用已知阳性癌组织切片作为阳性对照,磷酸盐缓冲液(PBS)代替一抗作为阴性对照。
结果判定标准:NRP-1主要表达在细胞膜和细胞质中,根据肿瘤细胞膜和细胞质的染色程度和染色细胞百分率分析评分。以出现淡黄-棕褐色颗粒作为阳性结果,由2名副高级职称病理医师进行独立双盲评分。每张病理切片随机选取5个10×40倍光学显微镜视野,将NRP-1的染色范围及染色强度依据以下标准半定量化,结果取平均值。标准如下:A染色范围:染色阳性细胞数占总细胞数的比率按≤5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,≥76%为4分;B染色强度:按照未染色为0分、淡黄色为1分,棕色为2分,棕褐色为3分。将染色范围与染色强度计分相乘得出结果:0~4分为低表达,5~12分为高表达。
1.4 免疫印迹法检测NRP-1表达
常规方法抽提胃癌细胞和组织标本蛋白,以每个泳道20 μg上样,经SDS-PAGE电泳后转移至PVDF膜,用50 g/L牛血清白蛋白(BSA)封闭PVDF膜,加入封闭液稀释的一抗NRP-1(Abcam 1∶1 000)、β-actin(1∶5 000)4 ℃孵育过夜,洗膜后再加入二抗(1∶5 000)孵育2 h,洗膜后采用超敏ECL试剂盒进行显色,在暗房中进行X光显影获得显示条带的胶片并照相保存。Image J分析软件将每个条带灰度数字化,以β-actin为参照,计算蛋白表达的相对强度,实验重复3次。
1.5 随访
所有患者术后进行3年定期随访,开始时间为接受手术的时间,截至日期为2014年12月31日。采用门诊随访及电话随访,平均每6月1次,规定死亡患者死亡时间为终止时间,中途失访者的终止时间为最后1次随访时间,亦纳入生存分析。
1.6 统计学处理
采用Pearsonχ2检验计算NRP-1的表达与不同临床病理特征的关系,运用Kaplan-Meier法进行生存分析,Log-rank检验分析曲线有无统计学差异。可信区间为95%,P<0.05为差异具有统计学意义,统计学分析采用SPSS 18.0统计软件进行。
2 结 果
2.1 NRP-1的表达情况
NRP-1阳性染色主要位于细胞膜和细胞质中,呈棕色、棕黄色颗粒样,在胃癌组织中,47.78%(86/180)染色结果低表达,52.22%(94/180)高表达,在癌旁组织中,所有染色结果NRP-1为低表达(图1)。
2.2 NRP-1表达与胃癌临床病理因素的关系
NRP-1在胃癌组织中的表达与患者性别、年龄、Lauren分型、远处转移、胃癌大小和切除淋巴结数目等因素无关,胃癌组织中NRP-1高表达与肿瘤分化程度、淋巴结转移、AJCC分期、T分期呈正相关(表1)。

图1 胃癌组织中NRP-1的表达
Fig.1 The expression of NRP-1 in gastric cancer tissues
A:阴性表达;B:弱阳性表达;C:中阳性表达;D:强阳性表达。
表1 胃癌组织中NRP-1表达水平与患者临床病理因素之间的相关性
Tab.1 The correlation between NRP-1 expression level in gastric cancer and clinicopathological factors

临床病理因素例数(%)NRP-1低表达高表达P值性别 女62(34.44)3329 男118(65.56)53650.289年龄(岁) <6079(43.89)4138 ≥60101(56.11)45560.328分化水平 高+中分化88(48.88)5335 低分化92(51.12)33590.001Lauren分型 肠型109(65.56)5653 弥漫型71(36.44)30410.231T分期 T1+T2122(67.78)6656 T3+T458(32.22)20380.014淋巴结 N056(31.11)3521 N1+N2+N3124(68.89)51730.008转移 是6(3.34)42 否174(96.66)82920.346TNM分期 Ⅰ+Ⅱ112(62.22)6250 Ⅲ+Ⅳ68(37.78)24440.009肿瘤大小(cm) <382(45.56)3646 ≥398(54.44)50480.341切除淋巴结数目 <2567(37.22)3631 ≥25113(62.77)50630.218
2.3 生存分析
所有患者随访1~36月,平均随访时间为16月,中途失访20例,中途失访患者亦纳入生存分析。NRP-1低表达患者术后3年生存率为31.1%,平均生存时间为28月,中位生存时间为26月;NRP-1高表达患者术后3年生存率为20.3%,平均生存时间为21月,中位生存时间为20月。NRP-1高表达患者平均生存时间显著短于低表达者,两者差异具有统计学意义(Log-rank检验,P<0.05,图2)。
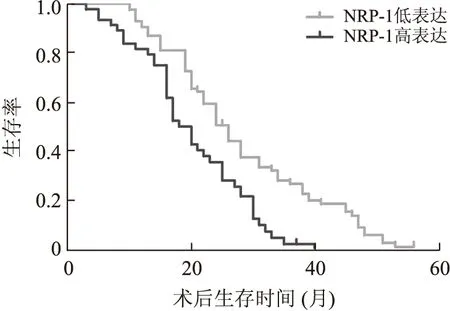
图2 根据NRP-1的表达用Kaplan-Meier统计分析术后生存曲线
Fig.2 Based on the expression of NRP-1, the survival curves were analyzed by Kaplan-Meier
对胃癌患者生存时间的单因素和多因素分析结果表明,NRP-1的表达、肿瘤分化程度、AJCC分期、T分期等与胃癌的生存时间相关(表2)。
2.4 在胃癌组织和细胞系中检测NRP-1的表达
提取3例胃癌患者不同分化程度的胃癌组织(高分化胃癌、中分化胃癌、低分化胃癌),检测NRP-1的表达情况。3组胃癌患者NRP-1在胃癌癌组织比对应癌旁组织NRP-1表达高(图3A)。低分化的胃癌组织NRP-1的表达比高中分化胃癌组织表达量高(图3B)。在NCI-N87高分化胃癌细胞、SGC7901中分化胃癌细胞、AGS低分化胃癌细胞、HGC27未分化胃癌中,HGC27细胞NRP-1表达量最高,NCI-N87细胞NRP-1表达量最低(图3C)。
表2 影响180例胃癌患者生存时间的单因素和多因素分析
Tab.2 Single factor and multi-factor analysis of the survival time of 180 patients with gastric cancer
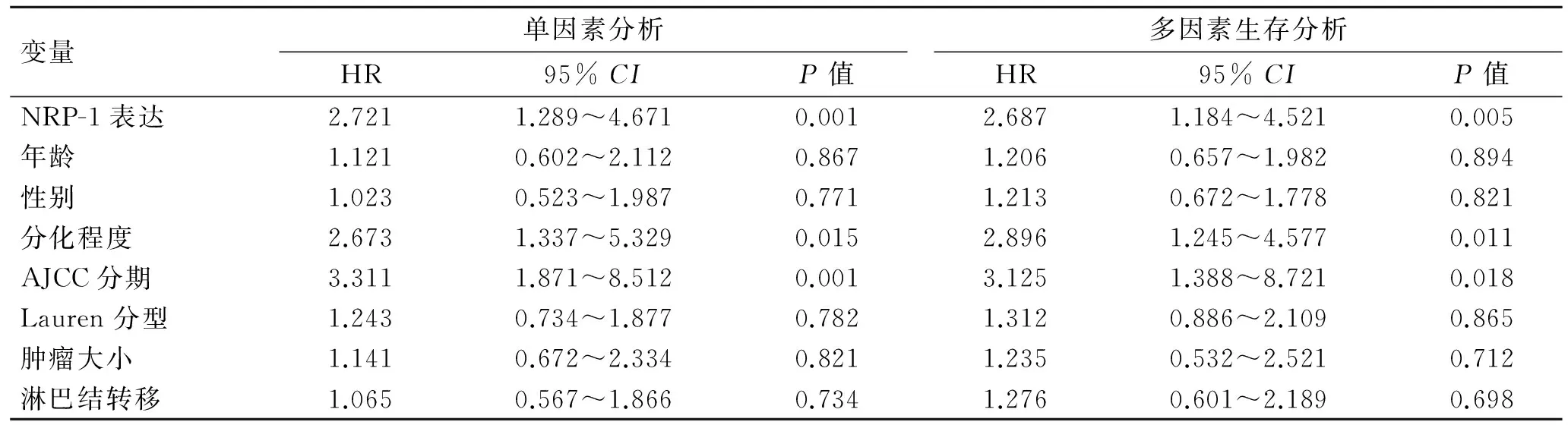
变量单因素分析HR95%CIP值多因素生存分析HR95%CIP值NRP-1表达2.7211.289~4.6710.0012.6871.184~4.5210.005年龄1.1210.602~2.1120.8671.2060.657~1.9820.894性别1.0230.523~1.9870.7711.2130.672~1.7780.821分化程度2.6731.337~5.3290.0152.8961.245~4.5770.011AJCC分期3.3111.871~8.5120.0013.1251.388~8.7210.018Lauren分型1.2430.734~1.8770.7821.3120.886~2.1090.865肿瘤大小1.1410.672~2.3340.8211.2350.532~2.5210.712淋巴结转移1.0650.567~1.8660.7341.2760.601~2.1890.698
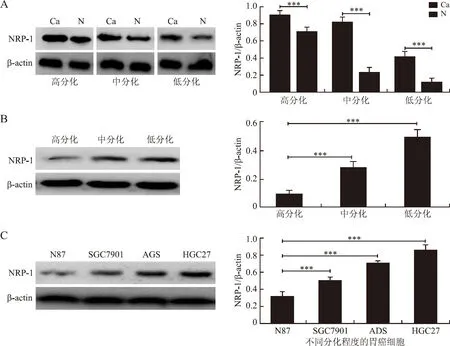
图3 免疫印迹方法检测胃癌组织及不同分化程度的胃癌细胞NRP-1表达
Fig.3 The expression of NRP-1 in gastric cancer tissue and gastric cancer cells with different differentiation degrees detected by Western blot
A:胃癌组织(Ca)和癌旁(N)NRP-1的表达;B:不同分化程度的胃癌组织NRP-1的表达;C:不同分化程度的胃癌细胞系中NRP-1的表达。
3 讨 论
临床上许多临床病理因素如肿瘤TNM分期、肿瘤病理类型及分化程度都相同的胃癌患者,其预后结局仍然差异很大。目前,这种异质性机制仍未阐明,因此,迫切需要研究者发现新的生物标志物来判断胃癌的生存预后,指导临床治疗。
NRP家族包括NRP-1和NRP-2,是细胞膜糖蛋白家族成员可以与血管内皮生长因子(VEGF)配体家族反应[15]。NRP-1首次发现是作为信号受体参与神经元成熟[16-17],先前研究已经发现NRP-1过表达与多种肿瘤恶性进展及不良预后相关[7,11-12,18-19]。已经有研究报道了NRP-2的表达可作为判断胃癌预后的指标[20],但未有报道NRP-1在胃癌中的表达情况及与胃癌的临床病理因素间的联系和生存预后情况。本研究首先通过免疫组化检测了NRP-1在180例胃癌患者的胃癌及其配对癌旁组织的表达情况,发现癌组织相对于癌旁组织高表达NRP-1,这提示NRP-1在胃癌发生过程中有重要作用,可能是胃癌的癌基因。进一步分析了NRP-1的表达和胃癌临床病理因素的关系,发现胃癌组织中NRP-1高表达与肿瘤分化程度、淋巴结转移、AJCC分期、T分期呈正相关(P<0.05)。研究发现NRP-1作为促血管形成因子,参与构成血管内皮生长因子受体1(VEGFR1)及血管内皮生长因子受体2(VEGFR2),进而提高了血管内皮生长因子165(VEGF165)结合到血管内皮生长因子受体家族(VEGFRs),促进了VEGF165介导的肿瘤血管形成,细胞侵袭及肿瘤发生进展[21]。因此,推测NRP-1高表达的胃癌患者恶性进展可能与此有关。
进一步通过免疫印迹方法的检测结果显示胃癌中NRP-1的表达也显著高于配对癌旁组织的表达,低分化的胃癌组织标本高表达NRP-1;在胃癌细胞系中,NRP-1的表达水平与细胞的分化程度之间具有一定的相关性,未分化HGC27细胞NRP-1表达量最高。我们通过生存分析发现高表达NRP-1的胃癌患者生存期显著低于低表达NRP-1的胃癌患者,多因素分析发现NRP-1可作为胃癌预后的独立预测因子。因此,通过检测NRP-1表达水平可作为一个辅助工具判断胃癌患者进展及预后,推测NRP-1在胃癌发生发展的生物学机制中扮演着重要角色,NRP-1参与胃癌的发生机制需要更多实验来验证。
本实验证明了胃癌组织中NRP-1的表达增加,高表达NRP-1与胃癌分化程度、淋巴结转移,临床分期显著相关。并且过表达NRP-1预示着胃癌患者的恶性进展及不良预后,NRP-1可作为重要的生物标志物判断胃癌患者的预后,有助于指导临床进行个体化肿瘤治疗和监控。
[1] FERLAY J, SOERJOMATARAM I, DISKSHIT R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 36(5):359-386.
[2] CHEN W, ZHENG RS, ZENG HM, et al. Annual report on status of cancer in China, 2011[J]. Chin J Cancer Res, 2015, 27(1):2-12.
[3] DESANTIS CE, LIN CC, MARIOTTO AB, et al. Cancer treatment and survivorship statistics, 2014[J]. CA Cancer J Clin, 2014,64(4):252-271.
[4] BAGRI A, TESSIER-LAVIGNE MR. Watts Neuropilins in tumor biology[J]. Clin Cancer Res, 2009, 15(6):1860-1864.
[5] ELLIS LM. The role of neuropilins in cancer[J]. Mol Cancer Ther, 2006, 5(5):1099-1107.
[6] PELLET-MANY C, FRANKEL P, JIA H et al. Neuropilins:structure, function and role in disease[J]. Biochem J, 2008, 411(2):211-26.
[7] CHENG W, FU D, WEI ZF, et al. NRP-1 expression in bladder cancer and its implications for tumor progression[J]. Tumour Biol, 2014, 35(6):6089-6094.
[8] SHOKOUFEH SF, LILI W, ZWAANS BMM, et al. Neuropilin 1 expression correlates with differentiation status of epidermal cells and cutaneous squamous cell carcinomas[J]. Lab Invest, 2014, 94(7):752-765.
[9] KAMIYA T, KAWAKAMI T, ABE Y, et al. The preserved expression of neuropilin (NRP) 1 contributes to a better prognosis in colon cancer[J]. Oncol Rep, 2006, 15(2):369-373.
[10] BEN Q, ZHENG J, FEI J, et al. High neuropilin 1 expression was associated with angiogenesis and poor overall survival in resected pancreatic ductal adenocarcinoma[J]. Pancreas, 2014, 43(5):744-749.
[11] DING M, LIU L, HU C, et al. Expression of VEGFR2 and NRP-1 in non-small cell lung cancer and their clinical significance[J]. Chin J Cancer Res, 2014, 26(6):669-677.
[12] ZHU H, CAI H, TANG M,et al. Neuropilin-1 is overexpressed in osteosarcoma and contributes to tumor progression and poor prognosis[J]. Clin Transl Oncol, 2014, 16(8):732-738.
[13] PENG Y, LIU YM, LI LC, et al. MicroRNA-338 inhibits growth, invasion and metastasis of gastric cancer by targeting NRP1 expression[J]. PLoS One, 2014, 9(4):e94422.
[14] AKAGI M, KAWAGUCHI M, LIU W, et al. Induction of neuropilin-1 and vascular endothelial growth factor by epidermal growth factor in human gastric cancer cells[J]. Br J Cancer, 2003, 88(5):796-802.
[15] CAO Y, E GQ, WANG EF, et al. VEGF exerts an angiogenesis-independent function in cancer cells to promote their malignant progression[J]. Cancer Res, 2012, 72(16):3912-3918.
[16] HE Z, TESSIER-LAVIGNE M. Neuropilin is a receptor for the axonal chemorepellent Semaphorin III[J]. Cell, 1997, 90(4):739-751.
[17] KOLODKIN AL, LEVENGOOD DV, ROWE EG, et al. Neuropilin is a semaphorin III receptor[J]. Cell, 1997, 90(4):753-762.
[18] OSADA H, TOKUNAGA T, NISHI M, et al. Overexpression of the neuropilin 1 (NRP1) gene correlated with poor prognosis in human glioma[J]. Anticancer Res, 2004, 24(2b):547-552.
[19] FAKHARI M, DIETER PMS, ABRAHAM D,et al. Selective upregulation of vascular endothelial growth factor receptors neuropilin-1 and -2 in human neuroblastoma[J]. Cancer, 2002, 94(1): 258-263.
[20] 徐卫国,刘云,贾纯亮,等. 胃癌组织中神经纤毛蛋白2表达与肿瘤淋巴管新生和临床病理因素的相关性[J]. 中华医学杂志, 2014, 94(14):1067-1070.
[21] GLINKA Y, STOILOVA S, MOHAMMED N,et al. Neuropilin-1 exerts co-receptor function for TGF-beta-1 on the membrane of cancer cells and enhances responses to both latent and active TGF-beta[J]. Carcinogenesis, 2011, 32(4):613-621.
(编辑 国 荣)
Clinical significance of the expression NRP-1 in gastric cancer
ZHANG Li1, ZHANG Di1, ZHOU Pei-hua2, WANG Xiao-long2, WANG Wei2, CHEN Nan-zheng2, LI Xiao-bin2, SUN Xue-jun2
(1. Department of General Surgery, the Second Affiliated Hospital of Xi’an Jiaotong University, Xi’an 710004; 2. Department of General Surgery,the First Affiliated Hospital of Xi’an Jiaotong University, Xi’an 710061, China)
Objective To analyze the expression of neuropilin-1 (NRP-1) in gastric cancer tissues and assess its clinicopathological parameters and prognostic significance. Methods NRP-1 expression was determined by immunohistochemistry in specimens of primary cancer tissues and the adjacent non-cancerous tissues in 180 patients with gastric cancer. NRP-1 expression was analyzed by Western blot in gastric cancer tissues and different gastric cancer cell line. Kaplan-Meier plots and Cox’s proportional hazards regression model were used to analyze the prognosis of gastric cancer. Results By immunohistochemistry, the expression of NRP-1 was significantly higher in gastric cancer than that in adjacent noncancerous tissues (P<0.001). High expression of NRP-1 was positively associated with histologic grade, tumor stage, lymph node metastasis and tumor T stage (P<0.05). Multivariate analysis showed that the high expression of NRP-1 was an independent prognostic factor for overall survival. Conclusion Overexpression of NRP-1 may play an important role in the progression of gastric cancer, and NRP-1 overexpression may serve as a biomarker for poor prognosis of gastric cancer patients.
neuropilin-1 (NRP-1); gastric cancer; immunohistochemistry; Western blot; survival curve; multi-factor regression model
2015-06-26
2015-09-09
国家自然科学基金资助项目(No.81172362,No.81172359) Supported by the National Natural Science Foundation of China (No.81172362, No.81172359)
孙学军. E-mail: sunxy@mail.xjtu.edu.cn
R735.2
A
10.7652/jdyxb201601016
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20151208.1659.008.html(2015-12-08)
