一种有效急性酶分离大鼠心肌细胞及复钙的方法*
2016-03-31程俊曾晓荣谭晓秋李鹏云文静毛亮杨艳
程俊,曾晓荣,谭晓秋,李鹏云,文静,毛亮,杨艳
(医学电生理学教育部重点实验室,四川医科大学心血管医学研究所,四川泸州646000)
一种有效急性酶分离大鼠心肌细胞及复钙的方法*
程俊,曾晓荣,谭晓秋,李鹏云,文静,毛亮,杨艳
(医学电生理学教育部重点实验室,四川医科大学心血管医学研究所,四川泸州646000)
目的:本研究旨在探讨一种既简便又高效的急性酶分离大鼠心肌细胞及有效复钙的方法,拟建立一种稳定高效分离大鼠心肌细胞且复钙后细胞成活率高的方法,为进一步研究单个心肌细胞的各种生理机制等诸多实验提供有利的前提保障。方法:应用II型胶原酶于Langendorff灌流装置下进行恒压或恒流灌流,得到横纹清晰、立体感较强的大鼠心肌细胞,然后应用三步法对心肌细胞进行复钙。结果:应用Langendorff灌流系统对大鼠心脏进行恒压或恒流灌流II型胶原酶,成功得到横纹清晰、立体感较强的大鼠心肌细胞,且复钙后在台式液中存活率仍然高达50%。结论:成功建立了一种既简便高效又稳定的急性分离大鼠心肌细胞且复钙后心肌细胞成活率较高的方法,为今后研究大鼠心肌细胞舒缩功能及其基本生理特性提供良好的单个细胞。
大鼠;心肌细胞;Langendorff
急性分离单个大鼠心肌细胞常常应用于细胞收缩功能检测以及膜片钳实验记录心肌细胞上的各种通道电流等,但这些检测对单个心肌细胞的质量要求都非常高。运用酶解法分离单个心肌细胞时遇到的最大困扰是分离出的心肌细胞常常发生“钙反常”现象,刚刚分离下来的心肌细胞保存在正常台式液中恢复其生理钙离子浓度时,常常会发生大量皱缩及死亡[1-4]。因此获得形态和生理活性良好及耐钙的心肌细胞是膜片钳实验成功的关键。本实验的目的在于得到一种简便而高效的大鼠心肌细胞分离方法,且复钙后耐钙性好,从而得到用于后续实验的细胞状态良好且功能较稳定的单个心肌细胞。
1 材料与方法
1.1 材料
1.1.1 研究对象
SD大鼠,雌雄不拘。由四川医科大学动物中心提供。
1.1.2 实验溶液
1.1.2.1 10×台式液(mmol/L)
NaCl 137,HEPES 10,KCl 5.4,MgCl21.2,NaH2PO42,H2O 1.2;pH用NaOH调至7.40。
1.1.2.2 KB液(mmol/L)
KOH 80,KCl 40,KH2PO425,MgSO43,L-Glutamic 50,Taurine 20,HEPES 10,EGTA 1,D-Glucose 10;pH用KOH调至7.20[5]。
1.1.2.3 台式液(Ca2+-free)
取50 mL 10×台式液(无钙)加入10 mmol/L葡萄糖,加入去离子水至500 mL。NaOH调节pH至7.40。台式液和KB液充氧30 min。备用。
1.1.2.4 Buffer A
取上述台式液100 mL加10 mmol/L牛磺酸。
1.1.2.5 Buffer E
取30 mL Buffer A,加入15μL 100 mmol/L Ca2+(终浓度50 μmol/L),加入30 mg小牛血清白蛋白(BSA),再加入24 mgⅡ型胶原酶。
1.1.2.6 Buffer B
取台式液(Ca2+-free)50 mL,加入60μL 1 mol/ L Ca2+(终浓度1.2 mmol/L)。
1.2 方法
1.2.1 实验前准备
1.2.1.1 灌流装置的清洗
(1)用灭菌水对整个灌流系统进行清洗。
(2)将恒温装置打开,流出液温度保持在37℃。
(3)打开气瓶,Buffer A和Buffer E充氧。以Ca2+-free灌流液冲洗灌流装置,排净气泡,并使其充满整个装置,然后切换到Buffer A灌流2 min。灌流速度6 mL/min。
(4)准备好系心脏的线圈,注射器和血管套管(注射器抽取20 mL台式液(Ca2+-free)),以备挂心脏时用。
1.2.1.2 台式液预冷
用50 mL的离心管取出台式液(Ca2+-free)一部分放入-20℃冰箱中预冷至冰水混合物。
1.2.1.3 准备大鼠
取一只180~240 g SD大鼠,雌雄不拘,采用腹腔注射0.3 mL/100 g 10%水合氯醛的方法进行麻醉。
1.2.2 大鼠心肌细胞分离
(1)开胸取心脏,置于冰冷的台式液(Ca2+-free)灌流液中。去除多余组织。找到主动脉。
(2)将主动脉套在套管底部。用缝合线扎紧。(从开胸到开始灌流时间不要超过2 min,恒压灌流请直接开始第4步)
(3)恒流灌流:①Buffer B灌流约2 min,泵出血污。换Buffer A灌流液灌5 min,使心脏的血液完全排出。正常心脏颜色粉红。②氧饱和的Buffer E 30 mL循环灌流。不断检查心脏硬度。灌流约30 min后待心脏变得柔软,终止消化。
(4)恒压灌流:Buffer A灌流液灌5 min,氧饱和的Buffer E 30 mL循环灌流。最初灌流消化液时其速度为20~24 D/10 s(D/10 s,每10 s的滴数,可用普通输液器缓冲管计数),约2 min后灌流速度减慢,最低时可达8 D/10 s,随后灌流速度逐渐增加,当灌流速度重新达到20~24 D/10 s时,即可终止循环消化。
(5)终止消化后,用注射器注射20 mL Buffer A冲洗心脏内消化酶。剪下左心室至KB液中,用剪刀剪碎。轻轻吹打细胞加速分离,100目筛网过滤,吸取上清到离心管中,500 rpm离心40 s,去掉上清。
(6)用KB液重悬细胞,然后静置,待细胞自然沉降6 min,弃去上清,KB液重悬细胞。室温静置。
(7)清洗灌流系统:用超纯水200 mL清洗系统,用75%的酒精灌流清洗并充满灌流系统,保持约30 min,用超纯水200 mL清洗系统。
1.2.3 复钙
待细胞KB液中静置1 h,开始复钙。分3次复钙,每次让细胞自然沉降,弃上清液加入下一浓度的钙溶液中。
(1)1/3 Ca2+:2 mL Buffer B+4 mL台式液(Ca2+-free),放置,10 min。
(2)2/3 Ca2+:4 mL Buffer B+2 mL台式液(Ca2+-free),放置6 min。
(3)Buffer B:6 mL Buffer B,放置6 min,弃上清,加Buffer B,静置备用。
2 结果
2.1 急性酶分离大鼠心肌细胞形态
运用本实验方法分离出的大鼠心肌细胞形态好、横纹清晰、边缘折光性好,初始分离出的心肌细胞成活率大于80%,见图1。
2.2 急性酶分离大鼠心肌细胞复钙后的形态
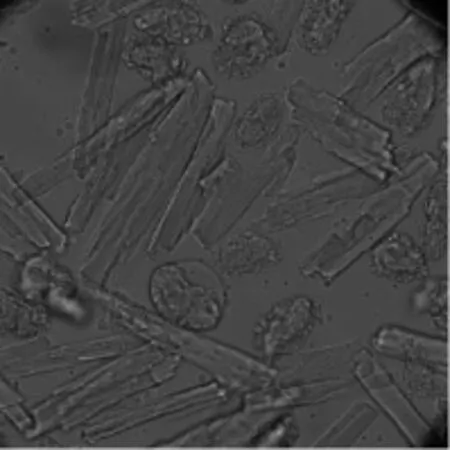
图1 应用Langendorff灌流系统分离的大鼠心肌细胞形态图(×200)
应用本实验方法急性酶分离出的大鼠心肌细胞经过前两步复钙后,细胞成活率约60%,见图2。经过第三步复钙后,耐钙细胞高达50%。见图3。
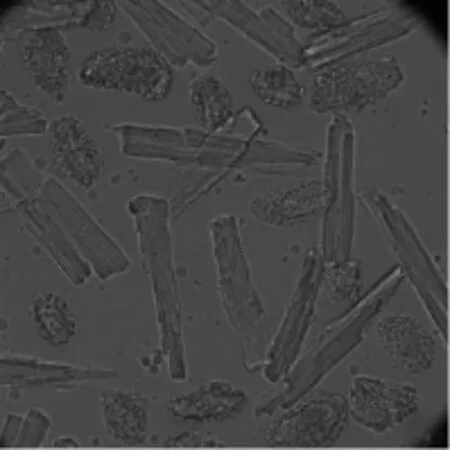
图2 应用Langendorff灌流系统分离的大鼠心肌细胞,经过前两步复钙后的形态图(×200)
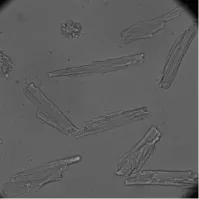
图3 应用Langendorff灌流系统分离的大鼠心肌细胞,经过最后一步复钙后的形态图(×200)
3 讨论
1976年Powell等[6]首次成功分离出了单个成熟且耐钙的心肌细胞以后,研究者三十多年来一直在探索怎么提高成熟心肌细胞的获得率以及改善心肌细胞“钙异常”。心肌细胞分离的每一步都对最终分离的细胞状态产生重要的影响。实验室温度、Langendorff装置设定温度、心脏摘取速度、水质、溶液pH值、酶的活性及浓度、操作者的熟练程度等都可影响心肌细胞状态。
本实验方法的优点在于:首先灌流含钙台式液,有利于恢复心脏的跳动,减少心腔内的残存血液;接着灌流无钙台式液,有利于减弱心肌细胞间依赖钙的紧密连接,这些都有利于得到单个有活性的心肌细胞。
另外本实验方法把握分离心肌细胞时的终止酶消化时间也是非常重要的,胶原酶的浓度过高,可造成消化时间缩短,而酶浓度过低又需要延长消化时间,这些都将造成细胞膜的不可修复的损害。有报道认为当观察到心脏的颜色变黄,且表面松弛时立即终止酶消化比较好[7]。但是那样造成分离下的细胞较多,但复钙后其耐钙性不好,死细胞特别多。而我们的经验是胶原酶消化到20~30 min时,观察到心脏呈现浅白色,且用眼科镊轻轻夹心脏表面感觉较软时,滴下的灌流液中在显微镜下可找到单个的心肌细胞,这时终止酶液消化较好。终止酶消化后,在剪碎心肌组织、吹打细胞等时动作均要轻柔,同时离心时间也需要尽量短,以免造成细胞的再次损害。
由于无钙台式液灌流造成Ca2+的丢失,为了补偿心肌细胞内钙库中的Ca2+,我们采用了三步复钙法,逐渐递增复钙液中的Ca2+,使心肌细胞内的Ca2+逐渐恢复正常,钙存储达到其生理浓度,这在后续的诸多实验是必须且重要的。
总之,想要得到横纹清晰、活性良好的单个心肌细胞,需要从方方面面注意,其中包括最初的液体配制、灌流系统的清洗、细胞分离过程中换液体的时间把握、酶终止时间的把握、剪碎细胞动作的轻柔、复钙等,这些都对心肌细胞的生理活性有重要的影响。任何一步的疏忽都会造成分离的心肌细胞形态和活性的变化,最终影响后续的诸多实验。
1.Wittenberg BA,Robinson TF.Oxygen requirements, morphology,cell coat and membrane permeability of calcium-tolerant myocytes from hearts of adult rats[J].Cell Tissue Res,1981(2):231-251.
2.Tytgat J.How to isolate cardiac myocytes[J].Cardiovasc Res, 1994(2):280-283.
3.Dow JW,Harding NG,Powell T.Isolated cardiac myocytes.Preparation of adult myocytes and their homology with the intact tissue[J].Cardiovasc Res,1981(9):483-514.
4.于继强,高尔,韩慧蓉,等.钙耐受大鼠心肌细胞分离方法研究[J].中国药房,2009(4):224-225.
5.石晓璐,柳絮,郭会彩,等.大鼠心肌细胞分离方法的改进[J].中国药理学通报,2010,26(5):687-690.
6.Powell T,Twist VW.A rapid technique for the isolation and purification of adult cardiac muscle cells having respiratory control and a tolerance to calcium[J].Biochem Biophys Res Commun,1976,72(1):327-333.
7.Mitra R,Morad M.A uniform enzymatic method for dissociation of myocytes from hearts and stomachs of vertebrates[J].Am J Physiol,1985,249(5 Pt 2):H1056-1060.
(2015-10-30收稿)
An effective method of acute isolation of cardiomyocytes and calcium recovery in rats
Cheng Jun,Zeng Xiaorong,Tan Xiaoqiu,Li Pengyun,Wen Jing,Mao Liang,Yang Yan
Key Laboratory of Medical Electrophysiology,Sichuan Medical University,Ministry of Education,and Institute of Cardiovascular Research of Sichuan Medical University,Luzhou 646000,Sichuan Province,China
Objective:To establish a simple and efficient method for acute isolation of myocardial cells and effective recovery of calcium in rats,so as to provide a favorable prerequisite protection of cardiomyocytes for further downstream studies of the physiological mechanism of single myocardial cell and many other experiments.Methods:Using type II collagenase in Langendorff irrigation flow device under constant pressure or constant flow perfusion,cardiomyocytes were isolated from rats,followed by a three-step calcium recovery was applied. Results:Cardiomyocytes were successfully isolated from rats using Langendorff irrigation flow system at a constant pressure or constant flow perfusion of collagenase type II,which showed a clear cross striations and strong three-dimensional sense of myocardial cells.After calcium recovery,the survival rate of cardiomyocytes remains as high as 50%in Tyrode solution.Conclusion:A new and high efficient method of acute isolation of cardiomyocytes in rats was established successfully,which can provide functional single cardiomyocyte for further downstream studies.
Rat;Cardionyocyte;Langendorff
R33-33
A
10.3969/j.issn.1000-2669.2016.01.004
国家自然科学基金资助项目(No:81173661),泸州市-泸州医学院联合专项(2013LZLY-J49)
程俊(1977-),女,副研究员,硕士
杨艳(1962-),女,研究员。E-mail:yangyan65317@163.com
