羊膜干细胞用于修复损伤子宫内膜的动物实验研究
2016-03-30张燕燕许慕慧马玲璇刘桂香徐成康
张燕燕 许慕慧 马玲璇 刘桂香 徐成康 李 玺
羊膜干细胞用于修复损伤子宫内膜的动物实验研究
张燕燕 许慕慧 马玲璇 刘桂香 徐成康 李 玺
目的通过使用羊膜干细胞修复损伤的小鼠子宫内膜实验,了解羊膜干细胞是否有助于子宫内膜的修复,为将来进一步应用于临床提供依据。方法参照人羊膜干细胞方法先制备小鼠羊膜干细胞,再建立小鼠子宫内膜损伤模型,然后根据方法不同分为3组(造模组50只,假手术组20只,对照组20只)。造模术后10 d取造模组10只,假手术组10只,对照组10只处死,肉眼观察宫腔改变,取出各组小鼠子宫置入中性甲醛固定,HE及Masson染色,对其进行纤维化半定量评分。各组再取10只小鼠与雄性小鼠合笼饲养,妊娠10 d开腹记数着床胚胎数作为评价生育能力指标。另外30只造模组行粘连分离后分别给予宫腔内注射羊膜干细胞、口服雌激素及空白。结果模型组在造模后宫腔纤维化面积比例增加,腺体数量减少,妊娠能力明显下降,而假手术组及对照组无明显变化,造模组与假手术组及对照组相比,3项指标都有显著性差异(P<0.05),对造模成功组采用不同治疗方案,结果显示,干细胞宫腔内注射可以改善宫腔纤维化面积及腺体数量,而雌激素无明显作用,3组治疗相比,干细胞组比其他组作用更明显,差异有显著性((P<0.05)。结论宫腔粘连分离后注入羊膜干细胞有利于子宫内膜的修复。
羊膜干细胞;子宫腔粘连;内膜修复
【Author's address】 Dafeng hospital in Chaoyang of Santou,Santou,515154,China
根据以往研究认为子宫内膜的再生来源于干细胞以及羊膜含有丰富干细胞的结果,本研究采用羊膜干细胞进行内膜修复实验。了解羊膜干细胞宫腔内注射治疗是否有利于内膜修复。为临床上使用羊膜干细胞治疗因内膜损伤引起的严重宫腔粘连提供依据。现报告如下。
1 材料与方法
1.1 小鼠羊膜间充质干细胞的制备与分离
①小鼠羊膜间充质干细胞(mAMCs)分离方法[1]:用0.075%胰蛋白酶消化新鲜小鼠羊膜4次,每次10min,每次之间在4℃低温下离心5min,1800 r/min,去上清,加入新鲜的消化液,最后应用0.075%胶原酶消化90min,用10%FBS液洗涤,可以得到上皮细胞及间质细胞混合的单细胞悬液。将mAMCs悬浮于含10%FBS的DMEM液中,调整为1.5×104/mL接种于细胞培养皿中,附壁生长。②细胞收集:在37℃,通气(95%O2和5%CO2)的条件下,用0.01%胰酶及0.02%乙二胺四乙酸(EDTA)消化贴壁的细胞8~10min。在倒置显微镜下观察,待80%以上的细胞开始变圆时加入适量的含10%FBS的DMEM培养液终止消化,并将消化后的细胞收集至离心管中,以1500 r/min离心3min,弃上清,用1mL细胞重悬液悬起细胞。③免疫荧光及免疫组化染色:取在小鼠羊膜铺片、培养皿上培养的mAMCs,在4℃用4%多聚甲醛固定后,用含0.1%Triton-X100和0.5%BSA的磷酸盐缓冲液(PBS)透膜同时封闭45min,以1∶200稀释的抗八聚体结合转录因子(OCT)3/4、胚胎阶段特异性细胞表面抗原(SSEA-1)一抗于4℃下反应,隔夜,用0.05 mol/L TBS液清洗后再加入Histofine Immunostaining kit中相应的二抗于室温下孵育45min,清洗后用FITC或Texas red-Conjugated Streptavidin于室温下孵育30min,用0.01 mol/L PBS液清洗后加入10倍稀释的Hoechst33258核染,以Glycergel Mounting Medium封片,荧光倒置显微镜下观察细胞并采集图像。阶段特异性胚胎抗原1(SSEA-1)的免疫组化染色采用Vector Red Alkaline Phosphatase Substrate Kitt(Vector Laboratories)按比例配好的显色液(含左旋咪唑Dako Corp.)显色5min,清洗后,应用 Hematoxylin细胞核染色1min。Glycergelmounting Medium(Dako Corp)封片,显微镜下观察细胞并采集图像,余同免疫荧光染色。
1.2 内膜缺失动物模型建立后分组及治疗
按文献方法,造模组50只麻醉后于下腹部正中,尿道上端约1cm处切开皮肤,暴露子宫,用4号针头于子宫分叉处向左子宫内缓慢注入25%苯酚胶浆0.04mL。假手术组20只开腹后向右侧子宫注入0.04mL生理盐水。术后第10天处死造模组10只,假手术组10只,正常对照组10只,取出各组小鼠的子宫组织置入中性甲醛固定。各组再取10只的大鼠随机1只宫腔粘连组雌性大鼠、1只假手术对照或正常对照组雌性大鼠与1只雄性大鼠合笼饲养,次晨行雌鼠的阴道细胞涂片,以涂片发现精子当日为妊娠第1天D1),妊娠D10开腹,计数着床胚胎数。剩下的30只造模组行宫腔粘连分离后分3组给予不同处理,分别是宫腔内注入干细胞、口服雌激素及空白。
1.3 子宫内膜纤维化程度半定量评分
结合高慧[2]提出的分级方法对子宫进行宫腔粘连大体分级,根据纤维蛋白原的增多及腺体数目的减少对子宫内膜纤维化程度进行半定量评分:将获取的右侧子宫内膜样组织进行HE、Masson染色,参照以下标准进行阅片。
1.4 羊膜干细胞移植
在模型建立成功后,对有粘连的宫腔进行分离,恢复正常形态后行干细胞移植。用体积分数为0.125%胰酶消化已贴壁生长呈梭形的鼠羊膜间充质干细胞(mAMCs),用胎牛血清终止消化,然后用吸管反复吹打直至细胞脱落,1000 r/min离心5min,弃上清,用PBS重悬细胞,1000 r/min离心3min,弃上清,再用PBS重悬细胞,计数mAMCs按3.0×106/只宫腔移植,分mAMCs移植组和空白对照组。
1.5 子宫内膜切片组织学观察
每周取材1次,每次各组取2只小鼠,对mAMCs治疗组和损伤组小鼠子宫内膜外观拍照,将取出的子宫内膜组织浸泡于体积分数为10%的中性福尔马林中,24 h后,常规梯度酒精脱水、二甲苯处理后做石蜡包埋切片,切片厚度为4μm,经HE染色后在普通光学显微镜下观察子宫内膜的组织学变化。
1.6 统计学方法
采用SPSS10.0统计学分析软件进行数据处理,计量资料采用均数±标准差,并进行t检验,P<0.05为差异有统计学意义。
2 结果
2.1 羊膜间充质细胞及其分化潜能
麻醉后动物手术,显示鼠 Y型子宫结构(见图1)。从羊膜中分离出间充质细胞(HAMCs),经体外扩增后显示出有分化成脂肪细胞、骨细胞、软骨细胞的潜能(见图2)。

图1 鼠Y型子宫结构

图2 羊膜间充质细胞及其分化潜能
2.2 小鼠造模后宫腔粘连纤维化评分及对妊娠的影响
造模组在造模后宫腔纤维化面积比例增加,腺体数量减少,妊娠能力明显下降,而假手术组及对照组无明显变化,造模组与假手术组及对照组相比,3项指标都有显著差异(P<0.05),见表1。
表1 各组造模后宫腔纤维化面积比率及腺体数量比较(n=10,±s)
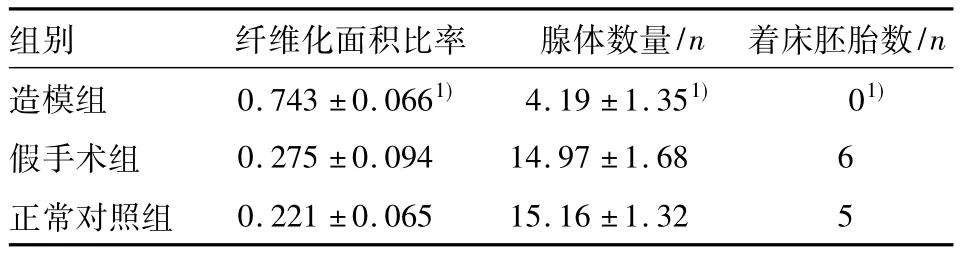
表1 各组造模后宫腔纤维化面积比率及腺体数量比较(n=10,±s)
注:与正常对照组及假手术组相比,均1)P<0.05
组别 纤维化面积比率 腺体数量/n 着床胚胎数/n造模组 0.743±0.0661)4.19±1.351)01)假手术组 0.275±0.094 14.97±1.68 6正常对照组0.221±0.065 15.16±1.32 5
2.3 造模成功组在分离粘连及干细胞移植后宫腔恢复情况
对造模成功组采用不同治疗方案,结果显示,干细胞宫腔内注射可以改善宫腔纤维化面积及腺体数量,而雌激素无明显作用,3组治疗相比,干细胞组比其他组作用更明显,差异有显著性(P<0.05),见表2。
表2 造模成功组分离粘连及干细胞移植后宫腔纤维化面积比率及腺体数量比较 (n=10,±s)
注:与空白对照组及雌激素治疗组相比,均1)P<0.05
组别 纤维化面积比率 腺体数量干细胞治疗组 0.533±0.0251)10.68±1.551)雌激素治疗组 0.236±0.054 5.11±1.24空白对照组0.225±0.038 4.21±1.16
3 讨论
随着各种子宫腔内操作手术(如人流刮宫、纵隔切除等)的增多,发生宫腔粘连(Asherman's syndrome)的病例也随着增加,而这一并发症严重影响了女性的生育能力。虽然以往采用了多种治疗措施,但严重宫腔粘连的治疗效果仍然很差[3-4],致使临床医生束手无策,很多患者因此丧失了生育的能力。因此,探索新的治疗方法,减少宫腔粘连,尽量避免女性患者丧失生育能力是当前妇科需要解决的任务。目前的临床研究显示在处理粘连恢复宫腔形态方面效果显著,但在预防粘连复发及修复内膜方面仍无良策。文献报道[5],宫腔粘连术后复发率为3.1%~23.5%,其中20.0%~62.5%为重度粘连,预防复发是治疗成功的关键。已有的研究结果表明,宫腔粘连术后预防再粘连的处理,无论是放置宫内节育器、放置球囊导尿管、雌孕激素周期治疗、血管扩张剂、生长激素、透明质酸钠、医用几丁糖的应用,都不能有效解决宫腔粘连处理后内膜修复的问题。到目前为止尚未能寻找到行之有效的办法来解决宫腔粘连处理后内膜修复的问题,探索新的更有效的修复内膜措施成为生殖及计划生育领域亟需解决的难题。已有实验研究表明[6],胚胎干细胞(ESCs)移植有助于小鼠新鲜损伤的子宫内膜修复,外源的干细胞部分地补充了组织干细胞的功能,但也表现出高致瘤性。本研究拟采用羊膜干细胞作为种子细胞用于子宫内膜修复的研究,有望解决胚胎干细胞高致瘤性的缺点,而且羊膜来源容易,费用极低,是理想的种子细胞来源,因此,研究它的有效性具有广泛的应用价值。
本研究采用小鼠作为动物模型,主要在于饲养成本低,适合大规模复制。造模用的是化学物苯酚,曾经用于输卵管结扎,此造模方法简单、可靠、周期短,造模成功后病理结果与人类宫腔粘连病理结果一致。在造模成功后,妊娠率明显下降,说明宫腔粘连会引起妊娠困难。人羊膜干细胞分离培养及培养已经成熟,而小鼠羊膜干细胞分离培养比较少,本实验中采用小鼠干细胞特异标志物Oct3/4及SSEA-1进行筛选,得到了比较纯的羊膜干细胞。Oct3/4基因只能在多能细胞中表达[7],SSEA-1是干细胞未分化的标志物[8]。在分离粘连后植入羊膜干细胞可以明显改善再次粘连的发生,与以往常用的补充雌激素相比,效果更明显。有理由认为用羊膜干细胞治疗将成为未来临床治疗宫腔严重粘连的措施之一。
[1]滕 赞,王 嫘,李 智,等.小鼠羊膜干细胞的分离与培养[J].中国老年学杂志,2012,32(19):4215-4218
[2]高 慧.中药盆炎康对实验性大鼠慢性子宫内膜炎及炎性粘连模型的影响[J].承德医学院学报,1996,13(3):187-191.
[3]刘晓梅,姜晓英,杜伯涛,等.绝经后宫颈下段粘连行宫颈环形电切术造口取宫内节育器1例[J].实用妇产科杂志,2012,28(1):76.
[4]叶敏欢,王 黎,方建华,等.子宫中隔电切术后宫腔放置医用生物蛋白胶和水囊的效果分析[J].现代医院,2015,15(3):64-65.
[5]YU D,WONG Y M,CHEONG Y,et al.Asherman syndrome-one century Later[J].Fertil Steril,2008,89(4):760
[6]曲军英,王燕华,吕一帆,等.子宫内膜细胞诱导胚胎干细胞修复小鼠受损子宫内膜[J].生殖与避孕,2013,33(10):647-651
[7]NERI T,MONTI M,REBUZZINI P,et al.Mouse fibroblasts are reprogrammed to Oct-4 and Rex-1 gene expression and alkaline phosphatase activity by embryonic stem cell extracts[J].Cloning Stem Cells,2007,9(3):394-406.
[8]CUI L,JOHKURA K,YUE F,et al.Spatial distribution and initial changes of SSEA-1 and other cell adhesion-related molecules on mouse embryonic stem cells before and during differentiation[J].J Histochem Cytochem,2004,52(11):1447-1457.
Experimental Study of Amniotic Mesenchymal Stem Cells Used for Repair the Injuried Endometrium of Mouse
ZHANG Yanyan,XU Muhui,MA Lingxuan,et al
ObjectiveTo investigate whether the amniotic mesenchymal stem cells(mAMC)could repair injured mouse endometrium.MethodsFemale moue amniotic mesenchymal stem cells(mAMC)were established with reference to the method that used in human Amniotic mesenchymal stem cells collection.The mouse models of the injured mouse endometrium were established and then were divied into three groups(model qroup,n=50,false group,n=20 and normal control group,n=20)according to the methods used,10 days after operation.10 mice were selected in every group and were killed and change of uterine cavity were observed,then uterines were fixed with neutral formalin and then were dyed with HE and Masson.The fibrosis of endometrium was evaluated.another10 female mice in each group were reared with male mice,the number of implanted embryo was counted as indication of fertility after10days of pregnancy.Another30 mice in model group were treated with mAMC,estrogen and empty after separation of fibre adhesion and the reparation of injured endometrium after transplanted stem cells were observed.ResultsAfter opertion,the fibrosis of endometrium increased,the number of gland decreased and the fertility droped in model group,there was no change in other groups.There was a obvious difference between operation group and other group(P<0.05).In the model group,different treatment were used after separation of fibre adhesion,mAMC intrauterin-injected could obviously improved the result of repairation.ConclusionmAMC intrauterin-injected could obviously improved the result of repairation after separation of fibre adhesion in uterine.
Amniotic Mesenchymal Stem Cells;Endometrium;Repairement Of Injuried Endometrium
R-332
:Adoi:10.3969/j.issn.1671-332X.2016.08.008
广东省科技计划项目(编号:2012B061700065);汕头市科技计划项目重点项目[编号:(2014)242-70]
张燕燕 许慕慧 马玲璇 刘桂香:汕头市潮阳区大峰医院 广东汕头 515154
徐成康:中山大学附属第一医院 广东广州 510080
李 玺:中山大学附属第三医院 广东广州 510630
李 玺
