水晶纳交联透明质酸用于鼻唇沟皱纹治疗的安全性和有效性
2016-03-30曹海茹刘志飞王晓军
曹海茹,龙 笑,刘志飞,曾 昂,白 明,王晓军
中国医学科学院 北京协和医学院 北京协和医院整形外科,北京1000730
水晶纳交联透明质酸用于鼻唇沟皱纹治疗的安全性和有效性
曹海茹,龙 笑,刘志飞,曾 昂,白 明,王晓军
中国医学科学院 北京协和医学院 北京协和医院整形外科,北京1000730
目的 评价水晶纳交联透明质酸应用于中国人群鼻唇沟皱纹治疗的安全性和有效性。方法 本临床试验方案为前瞻性、随机、阳性对照的非劣效性试验。本中心共招募120例受试者,根据入选标准和排除标准确定受试对象并自愿签署知情同意书。受试者按入组时间顺序编号并随机分为试验组和对照组,分别采用水晶纳交联透明质酸和瑞蓝2对受试者双侧鼻唇沟纹进行填充治疗。每例患者注射次数为1~2次 (第1次注射后4周,可进行第2次修正注射),注射量根据皱纹深度每侧不超过2 ml。所有受试者在最后一次注射后第1、3、6、12个月进行随访,随访内容包括对受试者按统一标准拍照、受试者上交填写的注射后15 d局部不良反应日志、研究者和受试者分别进行皱纹严重程度评价 (Wrinkle Severity Rating Scale,WSRS)。在试验结束后,独立第三方作WSRS,以6个月评价结果作为主要疗效指标,WSRS与基线比较改善1个或以上等级定义为有效。筛选时与6个月随访时进行血尿常规和肝肾功能等实验室检查。结果 两组受试者各项基线指标差异均无统计学意义,两组间均衡可比。独立第三方对两组受试者术后6个月随访WSRS结果显示两组差异无统计学意义 (P>0.05);术后6个月两组WSRS与基线比较鼻唇沟纹等级改善差异无统计学意义 (P=0.105);术后6个月试验组和对照组有效率差异无统计学意义 (93.0%比96.7%,P=0.431)。试验过程中出现2例不良反应,但与产品和手术可能无关。无手术相关的实验室检查结果改变。结论 水晶纳交联透明质酸用于鼻唇沟纹治疗试验期间未见与材料相关的不良反应,其组织相容性好,试验者能够接受。水晶纳交联透明质酸对鼻唇沟纹有明显改善作用,且疗效非劣效于对照材料瑞蓝2。
透明质酸;鼻唇沟纹;注射充填剂;有效性;安全性
人类皮肤组织由表皮、真皮和皮下组织构成。表皮由可更新的稳态细胞构成,起到屏障保护作用。真皮包含两种重要物质:松软有弹力的胶原纤维网和其内充满的大量透明质酸。皮下组织包含脂肪层。真皮和皮下组织的饱满程度构成了皮肤的轮廓线。随着年龄的增加,表皮会形成细纹,真皮胶原纤维逐渐失去弹性而支撑作用变弱,皮下脂肪组织减少[1]。皮肤轮廓随之发生改变,表现为皱纹增多、加深。为改善面部皮肤轮廓,软组织充填术成为目前越来越流行的非手术美容技术[2]。
透明质酸是自然界广泛存在的多糖分子,具备良好的非免疫原性,符合软组织填充剂的要求。但自然界的透明质酸会在2 d内快速被淋巴组织清除并通过肝脏降解。为此,研究者采用交联技术制作出更大更稳定的透明质酸分子,且具有抗酶降解作用[3]。作为软组织充填材料的一种,交联透明质酸钠在生物医学领域得到广泛应用。加拿大PROLLENIUM医疗技术公司生产的水晶纳交联透明质酸即为一种交联透明质酸凝胶,注射到真皮层可用于治疗中到深度的面部皱褶、皱纹及面部塑形,已获得加拿大政府批准,通过欧洲统一安全认证,并接受美国食品药品监督管理局的审批。为进一步评价水晶纳交联透明质酸在中国人群中应用的安全性和有效性,由中国人民解放军总医院、北京协和医院、中日医院共同参与水晶纳交联透明质酸用于鼻唇沟纹填充治疗的临床试验,本文对北京协和医院单中心研究进行报道。
对象和方法
研究对象
本中心共招募120例受试者,受试者分别按入组时间顺序编号。受试者纳入标准:年龄18岁以上;鼻唇沟有填充需求 (局部皱纹严重程度评分在3~4级);愿意按试验要求进行治疗和随诊;治疗部位未进行过其他填充剂的治疗,无永久性填充物;签署知情同意书。排除标准:怀孕或哺乳期妇女;瘢痕体质患者;痤疮或其他皮肤炎症患者;对治疗效果期望过高者;在1年内或在试验期间进行面部提升手术或其他改善面部皱纹的手术治疗者;6个月内或试验期间治疗部位进行过其他除皱治疗;鼻唇沟部曾接受过软组织填充剂治疗者;严重器质性疾病患者;感染性疾病患者。剔除病例标准:已入组病例但符合以下之一者,应予以剔除:误诊、误纳;符合排除标准。退出(脱落)病例标准:受试者不合作,失访;研究者决定其退出 (依从性差、严重不良事件等)。脱落病例应详细记录原因,并将其最后一次实验室主要检测结果结转为最终结果进行统计分析,其病例报告表应保存备查。
试验方法
本临床试验方案为前瞻性、随机、阳性对照的非劣效试验。试验方案通过北京协和医院伦理委员会审核。根据病例入选标准和排除标准确定受试对象,受试者自愿签署知情同意书 (访视1)。受试者按入组编号于注射前顺序开启密封的随机信封来确定随机分组。试验组使用水晶纳交联透明质酸 (Revanesse Ultra,加拿大PROLLENIUM医疗技术公司),对照组使用瑞蓝2(Restylane,瑞典Q-Med公司),均由北京爱缇菲斯医疗科技有限公司提供。治疗过程:对受试者双侧鼻唇沟部位真皮层注射填充物,注射量根据皱纹深度确定,每侧最大注射量不超过2 ml。每位受试者注射次数为1~2次,第一次注射后,如果需要修正,在4周后进行第二次注射 (访视2、3)。所有受试者在最后一次注射后第1、3、6、12个月进行随访(访视4~7),随访内容包括对受试者按统一标准拍照、受试者上交填写的注射后15 d局部不良反应日志、询问受试者在试验期间的任何不良事件、研究者和受试者分别进行皱纹严重程度评价 (Wrinkle Severity Rating Scale,WSRS)。在试验结束后,独立第三方进行WSRS,作为主要疗效指标。实验室检查在访视1、访视6时进行,检测项目包括尿妊娠试验 (女性)、血常规、尿常规、肝功能 (丙氨酸氨基转移酶、天门冬氨酸氨基转移酶)、肾功能 (肌酐、尿素氮)。
评价方法
安全性评价:包括生命体征 (血压、心率、呼吸)、实验室检查结果、注射部位的不良事件 (受试者日志和医生随访过程中记录)、研究过程中出现的其他不良事件/反应及严重不良事件/反应。
有效性评价:根据治疗部位皱纹深度,由医生、受试者分别于每次随访进行WSRS,作为参考。试验结束后由独立第三方根据照片评估受试者皱纹严重程度和整体美容效果,且以其为最终结果。对于WSRS,以双侧脸中最差的结果作为该受试者最终的有效性评价。主要疗效指标为注射后6个月时皱纹严重程度改善的有效率 (随访时皱纹严重程度相对于基线改善1个或以上等级定义为有效,分别计算试验组和对照组的有效率)。
统计学处理
统计分析软件采用SAS 9.13。所有统计分析在双侧、0.05显著性水平下进行。计数资料采用频数和构成比描述,计数资料组间比较采用连续校正χ2检验,当超过25%的单元格理论频数小于5时,使用Fisher精确概率法。计量资料采用均数和标准差描述。正态分布的计量资料组间比较采用成组t检验;非正态分布的计量资料组间比较采用Wilcoxon秩和 (Wilcoxon Rank Sum)检验。安全性评价按试验组和对照组分别描述治疗前正常、治疗后异常例数及所占比例。不良事件用不良事件发生例数及发生率进行描述,并对此比例进行连续校正χ2检验或Fisher精确概率法检验。同时,详细描述各组病例出现的全部不良事件的具体表现、程度及其与研究材料的关系。
结果
一般资料
共120例受试者入组,117例完成试验,其中试验组57例,对照组60例。无剔除病例,脱落病例3例,脱落原因为术后3个月失访1例,术后6个月失访2例。
均衡性分析结果
受试者基线资料各项指标在两组间的差异均无统计学意义 (P>0.05),两组间均衡可比 (表1)。
疗效分析结果
独立第三方在注射后第6个月对两组受试者双侧鼻唇沟纹等级评价结果显示,两组受试者鼻唇沟纹绝大多数达到1级或2级,两组鼻唇沟纹等级的差异无统计学意义 (P>0.05) (表2)。对两组受试者鼻唇沟纹与基线相比较改善等级统计结果显示,82.4%的试验组受试者与85.0%的对照组受试者注射6个月后鼻唇沟纹改善1~2个等级,两组鼻唇沟纹等级改善差异没有统计学意义 (P=0.105) (表3),不论瑞蓝2还是水晶纳交联透明质酸注射进鼻唇沟后,对鼻唇沟纹有同样良好的改善作用。

表1 受试者基线资料
第三方评价试验组和对照组受试者鼻唇沟纹注射后第6个月有效率分别为93.0% (53/57)和96.7% (58/60),两组有效率的差异无统计学意义 (P= 0.431),试验组对比对照组非劣效成立。
安全性分析结果
试验期间共出现2例不良反应 (双面鼻唇沟肿物和注射部位毛囊炎),不良反应与产品和手术可能无关 (表4)。
总结两组受试者注射后15 d日志,试验组注射后局部不良反应 (按术后第1日)发生率依次为肿胀(79.9%)、硬结 (78%)、触痛 (67.3%)、充血(51.9%)、疼痛 (47.7%)和瘙痒 (31.3%)。对照组注射后局部不良反应 (按术后第1日)发生率依次为肿胀 (74.4%)、硬结 (73.5%)、触痛 (67.6%)、疼痛 (46.6%)、充血 (42.0%)和瘙痒 (24.8%)。在注射术后15 d时间内,两组局部不良反应发生率均呈现递减趋势。
实验室检查结果,除1例对照组受试者血白细胞计数术前正常 (8.18×109),术后6个月异常有临床意义 (11.22×109)外,其余所有受试者的实验室检查指标均正常或轻度异常但无临床意义。
讨论

表2 注射后第6个月受试者鼻唇沟纹等级第三方评价结果[例 (%)]
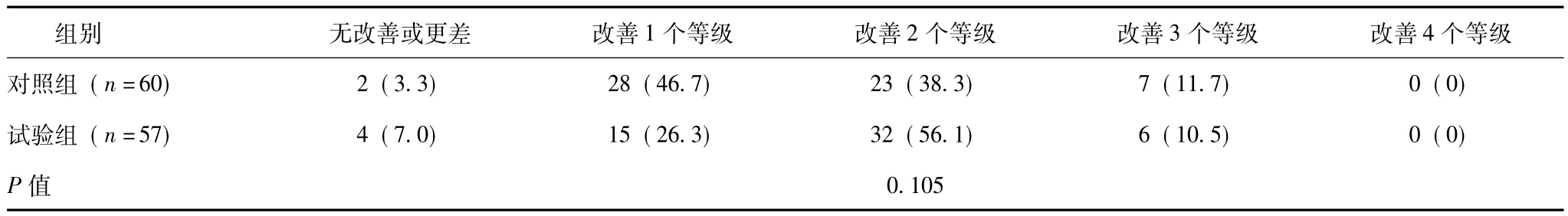
表3 注射后第6个月受试者鼻唇沟纹改善等级第三方评价结果[例 (%)]

表4 鼻唇沟注射试验期间发生的不良事件/反应
关于安全性
本试验过程中出现5例不良事件,其中3例不良事件与产品和手术不相关,另2例不良事件与产品和手术可能无关,成为不良反应。其中1例为注射部位皮肤多发毛囊炎 (试验组),详细询问后发现毛囊炎出现时间为一年随访期的天气炎热期内,天气凉爽后好转,因此考虑可能与受试者的皮肤毛孔易于堵塞发生炎症有关;第2例表现为双面鼻唇沟肿物 (对照组),考虑可能与注射材料在一年随访期内未能完全降解有关,注射物仍有残留,可触及异物。
根据受试者日志,注射后2周,受试者局部出现不同程度的肿胀、瘙痒、疼痛、触痛、充血和硬结等表现。肿胀的发生可考虑两个因素,一是透明质酸本身具有强大的吸水性,会导致注射部位肿胀明显,有个别受试者反映整个面部皮肤都有水润表现;二是局部穿刺导致的短暂性肿胀。其他局部表现如疼痛、触痛、充血等通常考虑与穿刺和塑形操作有关。而硬结通常为注射物,与操作手法相关。以上均为常见和可接受症状,且随注射后时间增加,局部不良反应发生率呈现递减趋势。
实验室检查发现血白细胞水平正常而注射后异常者1例,为对照组受试者,表现为治疗后6个月时白细胞增高。白细胞异常为单发,因此考虑原因为感染性疾病如感冒的可能性大。
综上,试验期间未见与注射材料相关的不良反应,试验材料的组织相容性好,受试者能够接受。
关于有效性
第三方对受试者注射后第6个月鼻唇沟纹等级评价显示,两组绝大多数受试者鼻唇沟纹均由注射前3、4级改善为注射后的1、2级,两种材料均对鼻唇沟纹有明显改善作用,两组间差异无统计学意义 (P>0.05);受试者鼻唇沟纹改善等级评价的统计分析结果显示,82.4%的试验组和85.0%的对照组受试者注射后鼻唇沟纹能改善1~2个等级,两组鼻唇沟纹改善等级差异无统计学意义 (P>0.05);两组鼻唇沟纹注射后改善的有效率差异亦无统计学意义 (93.0%比96.7%,P>0.05)。
综上,不论瑞蓝2还是水晶纳注射进鼻唇沟后,对鼻唇沟纹都有同样良好的改善作用。从统计分析结果可以得出结论:试验组注射材料非劣效于对照组。
存在问题及改进建议
临床试验设计中,试验时间仍嫌短。基于前期动物实验与文献查阅,关于注射材料的可降解性尤其是交联剂的毒副作用与降解性仅依据材料的组成获得,在人体内的代谢与降解过程、时限差异、代谢率、代谢途径等无确切研究记载。关于交联透明质酸的免疫原性,单独的白细胞检查不具有特异性的临床意义。因此建议坚持更长时期、更大样本量的观察,或寻找可追踪手段有效评价,进行深入的代谢与降解方面的安全性研究。
总之,在本组120例受试者历时12个月的临床试验中,未出现严重的不良反应及不良事件;相关实验室检查未出现与本试验相关的不良结果;受试部位的局部组织反应对机体不构成明显损害。对鼻唇沟纹的改善,注射材料水晶纳交联透明质酸非劣效于已上市材料瑞蓝2。
[1]Hotta T.Dermal fillers.The next generation[J].Plast Surg Nurs,2004,24:14-19.
[2]Fran a Wanick FB,Almeida Issa MC,Luiz RR,et al.Skin remodeling using hyaluronic acid filler injections in photo-aged faces[J].Dermatol Surg,2016,42:352-359.
[3]Roh NK,Kim MJ,Lee YW,et al.A split-face study of the effects of a stabilized hyaluronic acid-based gel of nonanimal origin for facial skin rejuvenation using a stamp-type multineedle injector:a randomized clinical trial[J].Plast Reconstr Surg,2016,137:809-816.
Safety and Efficacy of Cross-linked Hyaluronic Acid Revanesse Ultra for Treatment of Nasolabial Folds
CAO Hai-ru,LONG Xiao,LIU Zhi-fei,ZENG Ang,BAI Ming,WANG Xiao-jun
Department of Plastic Surgery,Peking Union Medical College Hospital,Chinese Academy of Medical Sciences&Peking Union Medical College,Beijing 100730,China
WANG Xiao-jun Tel:010-69158975,E-mail:pumchwxj@163.com
Objective To evaluate the safety and efficacy of cross-linked hyaluronic acid Revanesse Ultra for treatment of nasolabial folds in Chinese population.Methods A total of 120 participants were enrolled in this prospective,randomized,positive controlled,non-inferiority clinical trial in accordance to inclusion and exclusion criteria,and signed informed consents were obtained.The participants were numbered in the order of enrollment and randomized into Restylane group and Revanesse group,receiving hyaluronic acid injection to correct bilateral nasolabial folds.Each person received 1 or 2 times of injection(a touch-up injection could be administered 4 weeks post the first injection).According to the original depth of the wrinkles,no more than 2 ml hyaluronic acid was injected into each side.All the participants were followed up at 1,3,6,and 12 months after thelast injection and standardized photographs were taken at each visit.All the participants were asked to fill the form of local adverse events within the first 15 days after injection.Investigators and the participants both evaluated wrinkles based on Wrinkle Severity Rating Scale(WSRS).The WSRS score according to the pictures of 6 months post-injection were compared with the pictures which were taken before the injection(baseline)by independent staff at the end of the trial.One or more grades of WSRS improvement compared with the baseline was considered as effective.Laboratory tests including blood and urine routine,liver and renal function tests were carried out at screening visit and 6 months after injection.Results The baseline features between the two groups were comparable(all P>0.05).There was no significant difference in the WSRS 6 months after injection between the two groups(P>0.05).There was no significant difference in the WSRS improvement compared with baseline between the two groups(P=0.105).There was no significant difference in the rate of effectiveness between the two groups(93.0%vs.96.7%,P=0.431).Two participants reported minor adverse events,although both of which might not be associated with the product or procedure.No laboratory test change was found during the trial.Conclusions No severe adverse event associated with the injection material was observed during this clinical trial.According to the result,Revanesse Ultra may have good histocompatibility and tolerance.It could provide obvious improvement in the nasolabial folds,with effectiveness comparable to that of Restylane.
hyaluronic acid;nasolabial folds;dermal filler;efficacy;safety Med J PUMCH,2016,7(2):88-92
王晓军 电话:010-69158975,E-mail:pumchwxj@163.com
R622+.9
A
1674-9081(2016)02-0088-05
10.3969/j.issn.1674-9081.2016.02.002
2015-01-27)
